从黑茶中分离和筛选产单宁酶菌株
2015-12-26朱继新杨民和
高 琛, 朱继新, 黄 婧, 杨民和,2*
(1.福建师范大学 生命科学学院,福建 福州 350108;2.福建师范大学 工业微生物教育部工程研究中心,福建 福州 350108)
从黑茶中分离和筛选产单宁酶菌株
高 琛1, 朱继新1, 黄 婧1, 杨民和1,2*
(1.福建师范大学 生命科学学院,福建 福州 350108;2.福建师范大学 工业微生物教育部工程研究中心,福建 福州 350108)
茶叶中富含单宁化合物。从分离自黑茶的真菌菌株中,筛选高产单宁酶的菌株;进而分离纯化单宁酶,分析单宁酶对茶汤的转溶效果。从不同产地的3个黑茶样品中,共分离获得44个真菌分离物;经初步鉴定,这些真菌分离物以曲霉属(Aspergillus)、青霉属(Penicillium)和散囊菌属(Eurotium)的真菌居多。以单宁酸为底物的鉴别培养基初筛表明,其中26个真菌分离物在鉴别平板上产生透明圈,显示单宁水解酶活性;通过固体发酵复筛,筛选到1株产单宁酶活性较高的菌株,初步鉴定为青霉属(Penicillium)菌株,命名为青霉MP-24菌株。青霉MP-24可以以茶叶、茶梗和麸皮等农副产品作为原料固体发酵产生单宁酶。以麸皮为原料的发酵产物经过硫酸铵分级沉淀、DEAE阴离子交换层析和葡聚糖G-150凝胶层析等分离纯化步骤,得到分子量为70 kDa的单一蛋白质条带,单宁酶活力达到603.68 U/mg。纯化获得的单宁酶对茶汤有良好的转溶效果。研究结果表明,在黑茶相关微生物中含有丰富的产单宁酶菌株,是工业酶制剂的重要资源。
黑茶;真菌;单宁酶;分离纯化;儿茶素
单宁酶(tannase),全称单宁酰基水解酶(tannin acyl hydrolase,EC 3.1.1.20),可催化水解没食子单宁、复杂单宁和没食子酸脂等分子中的脂键、缩酚键和糖苷键,水解产物为葡萄糖和没食子酸(gallic acid,GA)[1]。单宁酶的作用底物主要是单宁类物质,而单宁被认为是自然界第二大类多酚类物质。单宁酶在食品工业、饲料工业、生物制药、制革工业和污水处理等行业中应用广泛。例如,单宁酶的水解产物没食子酸就是一种重要的化工原料,应用范围广,用量巨大[2]。同时,单宁酶也是茶叶深加工和茶叶食品开发中重要的酶制剂之一,在茶叶有效成分提取、生物转化、茶汤转溶和茶产品质量改良等方面有巨大的应用潜力[3]。目前,商品化的单宁酶主要由印度、日本和德国的少数几家公司通过微生物发酵生产[2]。随着经济的发展,单宁酶的市场需求量增大。但是,受酶的产量低、成本高、提取纯化过程复杂,以及生产工艺条件不成熟等因素的影响,目前单宁酶的产量很小,还未能形成大规模的工业化生产[2]。已报道的产单宁酶微生物包括细菌、酵母和真菌等,但以丝状真菌和细菌为多,特别是曲霉属和青霉属的真菌[1,4]。这些微生物主要从各种植物的叶片、表皮、根等部位分离纯化获得,或者是来源于富含单宁的土壤或工业废水[2,5]。大量研究表明,单宁酶的生产主要决定于生产菌株、诱导底物、发酵方式和发酵条件等4个因素。其中,分离和筛选产酶能力强、催化位点特异和酶学性质优良的菌株,依然是单宁酶制剂生产的关键。茶多酚又称为茶单宁或茶鞣质,一般占茶叶干重的18%~36%。茶多酚既是茶叶的主要成分,也是决定茶水风味和生理活性的主要因子[6]。已有的研究结果表明,在体内和体外条件下微生物对茶多酚的生物转化均非常重要[7]。无论在黑茶(Chinese dark tea)生产过程中,还是在以茶叶或茶叶成分为主要基质的微生物发酵试验中,均发现脂型儿茶素成分的减少和没食子酸含量的提高,暗示单宁水解酶可能参与了茶多酚的生物转化[8-9]。黑茶是我国六大茶类之一,属于传统的后发酵茶。我国丰富的黑茶种类、特有的生产工艺和各具特色的发酵条件,形成了茶叶发酵微生物的特有类群。本文从不同产地的黑茶样品中分离、纯化和筛选产单宁酶菌株,并分离纯化单宁酶,分析单宁酶对茶汤转溶和茶多酚分解的作用,旨在为开发新的单宁酶菌种资源,进而为应用于茶叶深加工和其他工业创造条件。
1 材料与方法
1.1 材料
1.1.1 茶样 3个市售黑茶品种分别是勐海七子饼茶(普洱熟茶,云南西双版纳勐海天福祥茶厂, 2007年3月产品)、六堡茶(熟茶,梧州中茶茶业有限公司,2007年11月产品)和南糯山普洱(普洱生茶,勐海源味祥茶业有限公司,2013年3月18日产品)。用于发酵试验的茶叶和茶梗购自小型超市。
1.1.2 主要试剂 没食子酸丙酯(PG)和没食子酸(GA)购自上海阿拉丁生化科技股份有限公司;罗丹宁购自上海生工;单宁酸购自天津福晨化学试剂公司;N,N-亚甲双丙烯酰胺、十二烷基硫酸钠(SDS)、CTAB、EDTA均购自BBI公司;DEAE-阴离子交换树脂、葡聚糖G-150凝胶均购自GE公司;含量99%茶多酚绿茶提取物购自福州日冕科技开发有限公司;标准品表儿茶素(EC)、表儿茶素没食子酸酯(ECG)、表没食子酸儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)等均购于美国LKT公司。色谱甲醇、色谱磷酸均为国产色谱纯。
1.1.3 培养基 PDA培养基;单宁酶鉴别培养基:NaNO36 g/L,KCl 0.52 g/L,MgSO4·7H2O 0.52 g/L,KH2PO41.52 g/L,CuSO4·5H2O、ZnSO4·7H2O、FeSO4·7H2O 微量,琼脂20 g,蒸馏水定容至1 000 mL,121 ℃灭菌20 min;固体发酵培养基:单宁酸10% (质量分数),麸皮90% (质量分数),无机盐溶液5 mL (质量分数分别为NH4Cl 1.0%,MgSO4·7H2O 1.0%,NaCl 0.1%),pH 5.0,121 ℃灭菌20 min。
1.1.4 仪器与设备 HRSR-H系列生化培养箱,购自常州国华电器厂;UV-1100紫外可见光分光光度计,购自上海美谱达有限公司;Olympus BX51光学显微镜,购自日本奥利巴斯有限公司;ABI2720型PCR仪,购自ABI公司;DYY-8C电泳仪,购自北京六一仪器厂;HD-21C-A核酸蛋白检测仪,购自上海康华生化仪器制造公司。
1.2 方法
1.2.1 真菌分离 将勐海七子饼茶、六堡茶和南糯山普洱茶3个茶样分别混合均匀,无菌条件下,用无菌镊子分别取大小相近的茶叶碎片置于PDA固体培养基上,每个平板放置8个茶叶块,每种茶样20个平板。28 ℃恒温培养5~10 d,挑取菌落边缘菌丝体,接入新的PDA平板,将分离到的菌株经多次纯化后,接种于PDA斜面培养基,编号,4 ℃冰箱中保存。
1.2.2 产单宁酶菌株初筛 将分离得到的菌株在PDA培养基上活化培养5~7 d。制备PDA平板,待培养基冷却凝固后,吸取浓度为0.1 g/mL过滤除菌后的单宁酸溶液,在培养基平板表面涂布均匀;用直径为5 mm打孔器在各菌株菌落边缘打取3个菌饼,分别移接到单宁酶鉴别培养基平板上,每株菌3个重复。于28 ℃恒温培养5 d后,观察各个菌株的生长状况及是否产生透明圈,分别测量透明圈直径(D)和菌落直径(d),以D/d值大小作为初筛指标初步评价菌株的产酶能力。
1.2.3 固体发酵复筛 在装有5 g固体发酵培养基的250 mL三角瓶中,接入1 mL各菌株孢子悬液(1.0×108个孢子/mL),搅拌均匀,每株菌3个重复。28 ℃恒温静置培养96 h后,培养物用于粗酶液的制备和酶活测定,以酶活高低作为复筛的指标。选取酶活较高的菌株进行多次复筛,得到产单宁酶水平较高的菌株。复筛完成后,分别用茶叶和茶梗代替麸皮固体发酵菌株MP-24,获得粗酶液,测定酶活,考察菌株MP-24对不同有机质的适应性和利用能力。
1.2.4 粗酶液的制备和单宁酶酶活测定 在以上固体发酵产物中加入50 mL pH 5.0柠檬酸缓冲液,160 r/min震荡1 h,过滤即得到粗酶液。单宁酶酶活测定参照Sharma等[10]的方法。反应前将浓度为0.005 mol/L的没食子酸丙酯溶液和粗酶液在40 ℃水浴中保温10 min。取9支洁净的具塞试管,分别标记为空白管、对照管和测试管各3支,在所有试管中各加入0.25 mL没食子酸丙酯溶液;将0.25 mL 0.1 mol/L柠檬酸钠缓冲液(pH 5.0)加到空白管,0.25 mL粗酶液加到测试管,并将所有试管置于40 ℃水浴保温5 min;在所有试管中分别加入0.3 mL 0.05 mol/L罗丹宁溶液,40 ℃水浴保温5 min。取0.5 mol/L KOH溶液0.2 mL加到对照管和测试管,40 ℃水浴保温5 min。仅在对照管的反应物中加入0.25 mL粗酶液,最后每支试管中加入4 mL蒸馏水稀释,40 ℃水浴保温5 min。测定反应混合物在520 nm处的吸光值(A),以蒸馏水作为空白对照。酶活单位(U)定义:在40 ℃条件下,每分钟产生1 μmol/L没食子酸所需要的酶量。单宁酶的活性由吸光值的变化来计算:ΔA520=(Atest-Ablank)-(Acontrol-Ablank)。其中,ΔA520为反应混合物在520 nm处的吸光值变化,Atest为测试管的吸光值,Ablank为空白管的吸光值,Acontrol为对照管的吸光值。
用纯单宁酶制剂按照以上方法制得没食子酸与吸光值变化(ΔA520)的标准曲线: Y=0.004 X - 0.024 (R2=0.993)。根据标准曲线计算出粗酶液的单宁酶活力(U/mL),并计算固体发酵每毫克干物质(有机质)所产单宁酶活力(U/mg)。
1.2.5 菌株的鉴定 将筛选获得的产单宁酶菌株接种于PDA固体培养基上,于28 ℃培养3 d后,在真菌菌落的外缘以45°斜角插入3片无菌盖玻片。继续培养2~5 d后观察其菌体形态。通过对菌落、菌丝、孢子形态特征的观察,参照孔华忠的方法[11]进行初步鉴定。菌株MP-24基于ITS序列的系统发育分析参照苏经迁等[12]的方法。将菌株接种于PDA液体培养基,28 ℃、180 r/min摇床震荡培养5 d后,将菌丝体用无菌滤纸过滤,获得湿的菌丝体,再用无菌水清洗2遍,冷冻干燥菌体,采用CTAB法提取菌株DNA,采用真菌通用引物ITS4和ITS5进行PCR扩增nrDNA ITS区域,该引物由上海生物工程有限公司合成。以菌株的ITS序列作为目的序列,在GenBank中用BLAST程序搜索同源序列,挑选与菌株序列相近的参考序列用于构建ITS系统发育树。ITS4:5′-TCCTCCGCTTATTGATATGC-3′;ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′。
1.2.6 硫酸铵分级沉淀 粗酶液中加入不同质量的硫酸铵使其达到不同的饱和度。充分沉淀后,4 ℃、10 000 r/min离心15 min,取少量上清液测定各个饱和度下的单宁酶酶活,以确定最佳的硫酸铵分级沉淀范围。硫酸铵沉淀后的单宁酶酶液经过透析,用PEG-6000 4 ℃包埋浓缩。
1.2.7 DEAE-纤维素阴离子交换柱层析 用移液管将浓缩酶液置于DEAE纤维素阴离子交换柱(2.5 cm×20 cm)上,每次上样量为1~2 mL,再用过滤除菌的柠檬酸-柠檬酸钠缓冲液以1.5 mL/min的流速洗脱,待基线走平后改用浓度为0.3 mol/L NaCl、 pH 5.0、 0.01 mol/L柠檬酸-柠檬酸钠缓冲液行一步式洗脱,洗脱速度同上,每管收集6 mL,合并酶活力较高的酶液,置于透析袋中透析,然后用PEG-6000 4 ℃包埋浓缩。
1.2.8 葡聚糖G-150凝胶层析 将填装有葡聚糖 G-150的层析柱(1.0 cm×40 cm)先用0.01 mol/L柠檬酸-柠檬酸钠缓冲液(pH 5.0)进行平衡,待基线走平后将浓缩酶液上柱,上样量为2~3 mL。用过滤除菌的、浓度为0.01 mol/L的柠檬酸-柠檬酸钠缓冲液(pH 5.0)洗脱,洗脱速度0.4 mL/min,每管收集2 mL,测定并记录洗脱峰范围的各管酶活和蛋白质吸光值,合并酶活部分置于透析袋中,用PEG-6000 4 ℃包埋浓缩。
1.2.9 SDS-PAGE凝胶电泳 将粗酶液、经过DEAE-纤维素离子交换层析以及葡聚糖 G-150凝胶柱层析纯化得到的样品加入不同泳道,进行SDS-PAGE凝胶电泳,检测各个步骤的纯化效果,测定单宁酶的蛋白相对分子质量。电泳条件:分离胶浓度12%,浓缩胶浓度5%,浓缩电压80 V,分离电压120 V,电泳2 h。电泳完成后考马斯亮蓝R-250染色,7%冰醋酸脱色。
1.2.10 茶汤转溶分析 称取1 g铁观音茶叶,用100 mL蒸馏水煮沸,制备茶汤。取9支干净具塞的试管,各加入2 mL茶汤(pH自然)。1支试管作为对照,其余8支分别加入不同体积纯化的单宁酶酶液,于40 ℃水浴反应1 h后,立即置于冰水浴中冷却,观察茶汤的浑浊度变化,测定460 nm处吸光值,分析单宁酶对茶汤的转溶效果。
1.2.11 数据分析 真菌分离率(Isolation rate,IR)表示为生长出真菌的茶叶组织块占分离样品总数的百分率。采用Microsoft Excel软件对试验数据进行处理,差异显著性分析采用SPSS18.0软件。IR=(真菌分离物数目/茶叶组织块总数)×100%。
2 结果与分析
2.1 产单宁酶菌株的分离
利用PDA培养基对勐海七子饼茶(简称MP)、六堡茶(简称LB)和南糯山普洱茶(简称NP)3种黑茶进行微生物分离。共分离得到44株菌株,有真菌、细菌和酵母菌,但以真菌为主。其中,勐海七子饼茶真菌分离率为61.36%,六堡茶为27.27%,南糯山普洱茶为11.36%。主要真菌经形态鉴定分别属于曲霉属(Aspergillus)、青霉属(Penicillium)和散囊菌属(Eurotium)。由于本研究的主要目标是筛选产单宁酶菌株,对分离获得的菌株均编号保存,大部分菌株未作进一步的鉴定。
2.2 菌株初筛
将分离获得的44株菌株分别接种到单宁酶鉴别培养基上,培养5d后,其中的26株真菌显示透明圈(图1),MP-03、MP-04、NP-01和NP-05等4株菌株生长迅速,产生大量的孢子,孢子散开后形成新的菌落,使透明圈直径难于测量。其他菌株透明圈直径与菌落直径的比值(D/d值)见表1。由表1可知,MP-23、LB-03和MP-08等3株菌株的D/d值都大于2.0,但这3株菌株在单宁酶鉴别培养基上均生长缓慢,菌落直径较小。
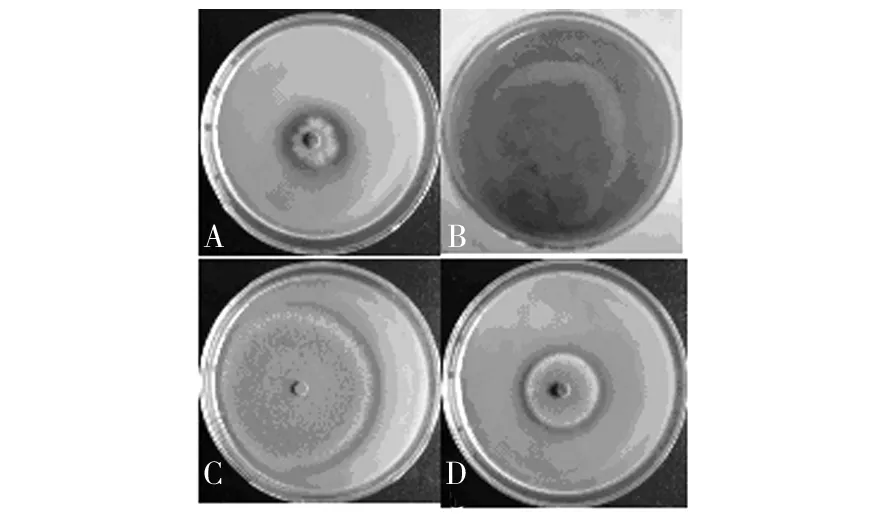
图1 真菌在单宁酶鉴别培养基上产生透明圈Fig.1 Clear zone of hydrolysis of tannic acid shown by different fungal strains on specific agar plate
2.3 菌株复筛
将平板初筛获得的26 株菌株,分别接种至固体发酵培养基中,28 ℃恒温培养96 h后加入柠檬酸缓冲液浸提,获得单宁酶粗酶液,测定其酶活力。经过固体发酵复筛后得到8株单宁酶酶活力相对较高的菌株,再以每株菌做5个重复进一步复筛,结果见表2。经多次筛选,得到1株分离自勐海七子饼茶中的菌株MP-24产酶活力相对较高,达到46.36 U/mg,其单宁酶酶活与其他菌株相比达到极显著水平(P< 0.01)(表2)。经过多次传代,该菌株产酶性能比较稳定,因此初步确定菌株MP-24为后续试验菌株并对其进行鉴定,同时进行单宁酶的分离纯化以及酶学性质的研究。利用茶叶和茶梗发酵,其酶活分别为55.84 U/mg和17.86 U/mg。
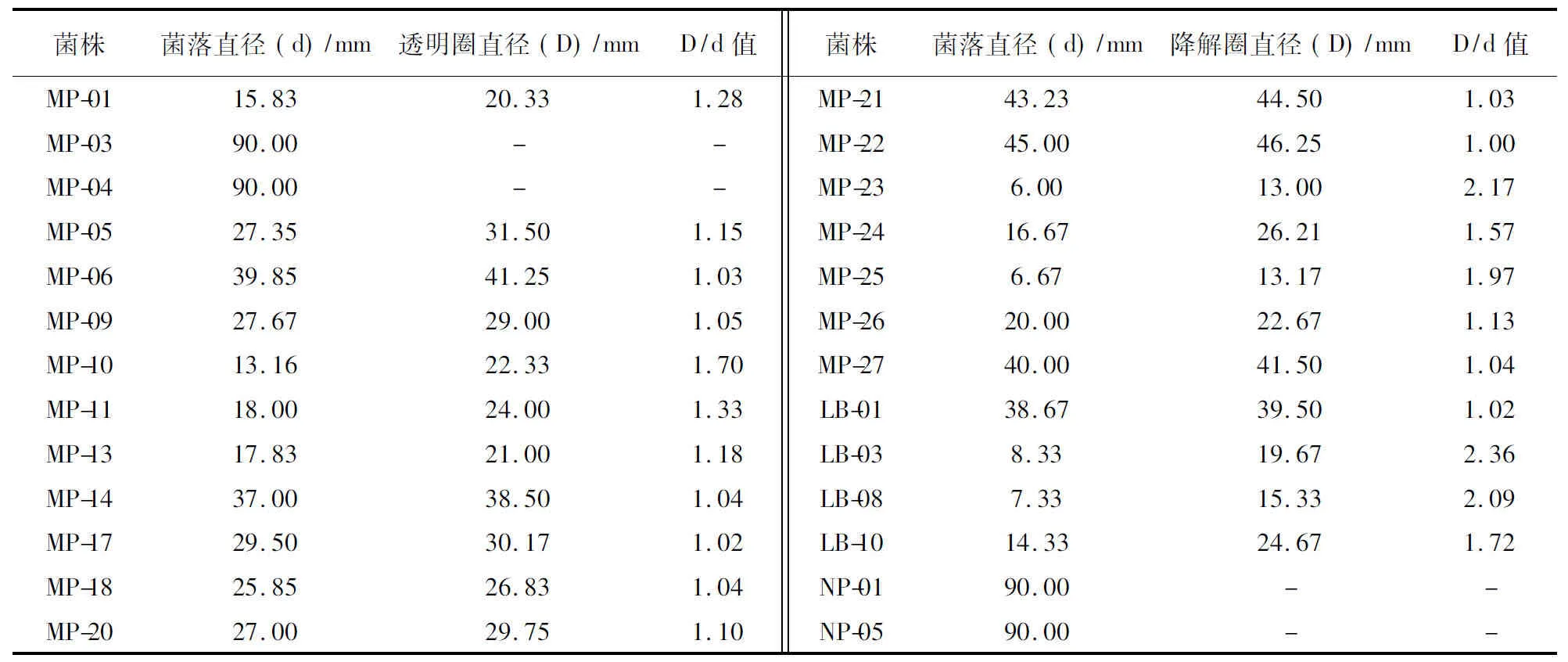
表1 不同菌株在单宁酶鉴别培养基产生的降解圈比较
注:“-”表示无法测量
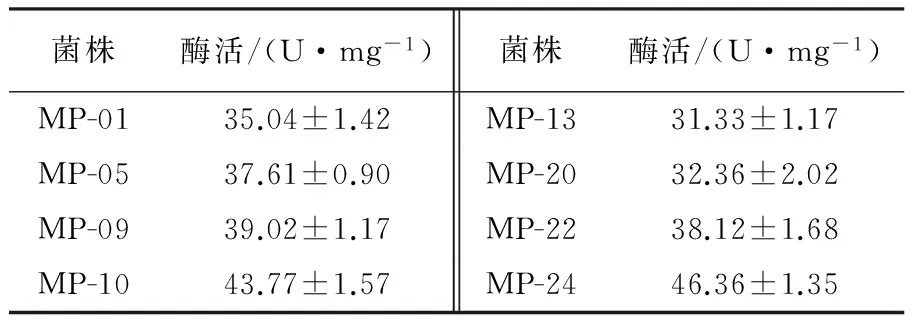
表2 固体发酵复筛菌株的单宁酶活力
2.4 菌株的初步鉴定
菌株MP-24在PDA培养基上28 ℃培养7 d后,菌落直径达到70 mm。菌落质地绒状,近圆形,生长初期为乳白色,逐渐变成浅绿色,最后变成青绿色。菌落边缘呈白色环状,中间有浅黄色至棕红色水滴,菌落背部呈红褐色(图2A)。菌株MP-24分生孢子梗顶端形成对称的扫帚状,有多个分枝,分枝紧凑,小梗顶端逐渐变细,在瓶梗上形成椭圆形、串生、个体较小的分生孢子(图2B)。参照《中国真菌志》(第35卷)[11]的描述并结合系统发育树(图3),初步将MP-24鉴定为青霉属(Penicillium)菌株,命名为青霉MP-24菌株。

图2 菌株MP-24菌落形态及产孢结构Fig.2 Colony morphology and sporogenous structures of strain MP-24A:菌株MP-24在PDA培养基上菌落形态;B:菌株MP-24的产孢结构(箭头)和分生孢子A:colony morphology on PDA;B: morphological characters of the conidiophore (arrow) and conidia
2.5 单宁酶分离纯化
以麸皮为主要有机质,菌株MP-24固体发酵产生的单宁酶经过硫酸铵沉淀、DEAE-纤维素阴离子层析和葡聚糖G-150凝胶层析三步骤分离纯化,测定各步骤收集的单宁酶酶液的酶活和蛋白质含量,结果见表3。经过三步骤的纯化得到酶的比活力为603.68 U/mg,回收率为15.21%,纯化倍数为8.75。将最后纯化得到的单宁酶进行SDS-PAGE纯度检测,得到单一蛋白条带,分子量大小约为70 kDa(图4)。说明经过各步骤纯化,己将绝大部分杂蛋白除去,达到电泳纯,可用于后续酶学性质及其他方面的进一步研究。
2.6 单宁酶对茶汤的转溶效果
加入不同体积的单宁酶酶液对铁观音茶汤转溶结果见图5和表4。由表4可知,随着单宁酶酶液量的增加,茶汤在460 nm处吸光值逐渐下降,茶汤的浑浊度逐渐降低,茶汤逐渐变得较为澄清, 说明经过纯化后的单宁酶对茶汤有较好的转溶效果。
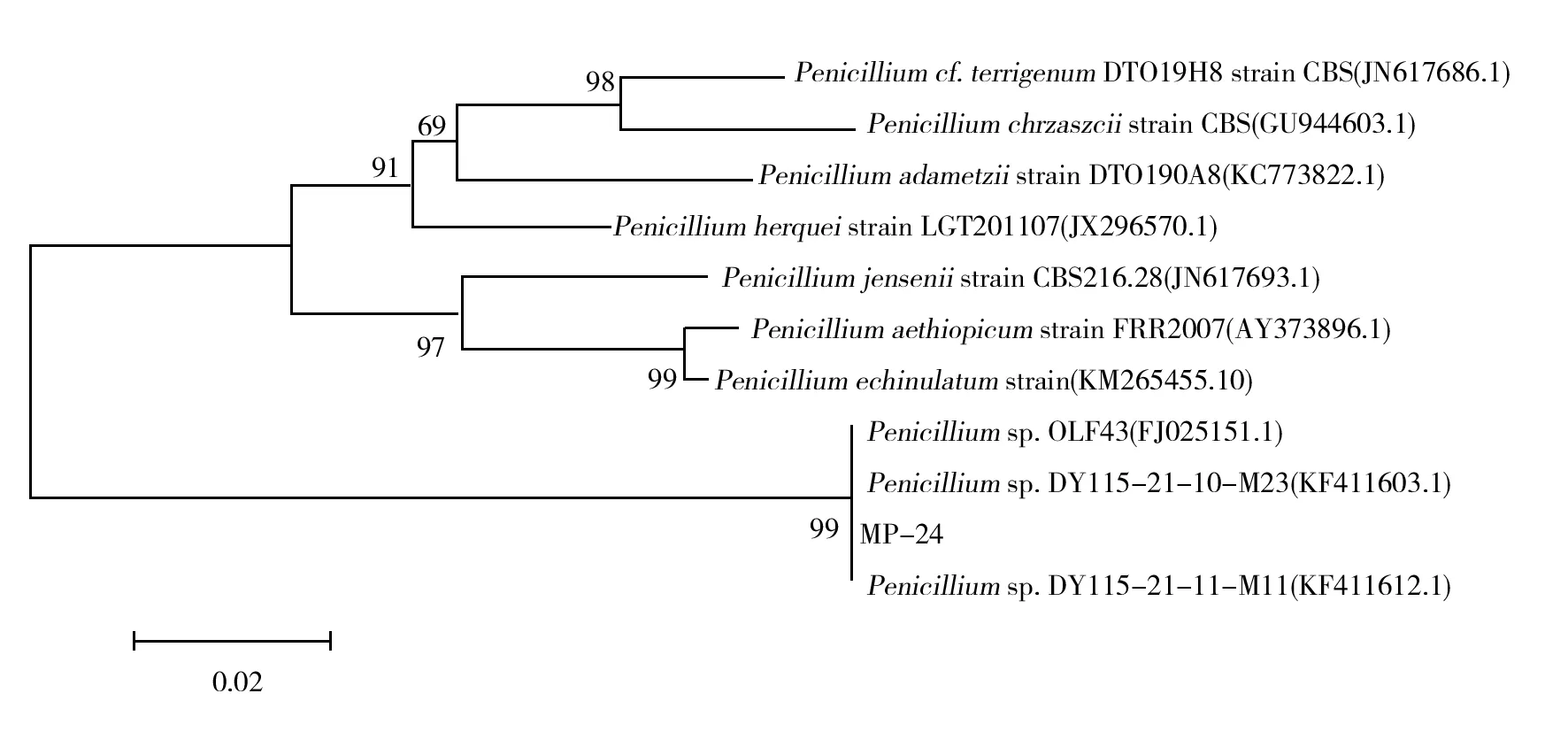
图3 菌株MP-24基于ITS序列的系统发育树Fig.3 Phylogenetic tree of strain MP-24 based on the sequence of ITS
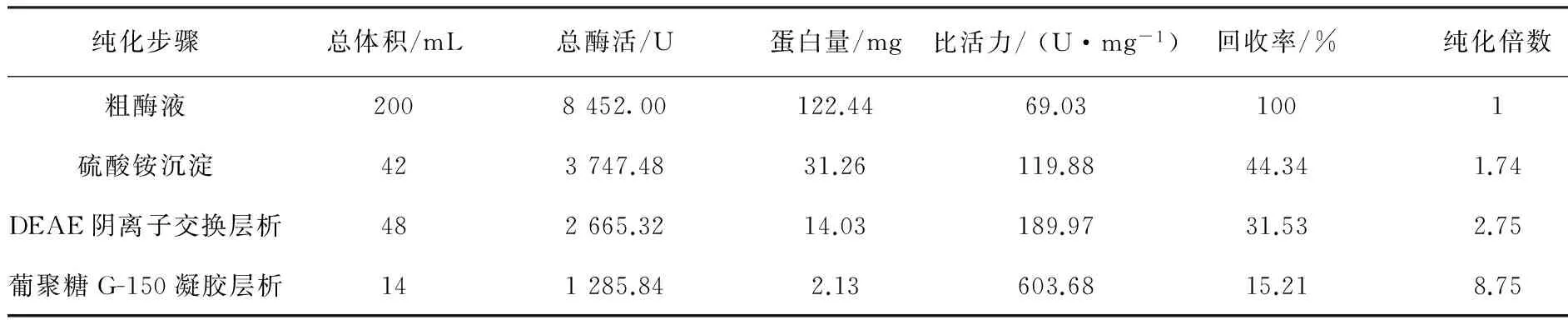
纯化步骤总体积/mL总酶活/U蛋白量/mg比活力/(U·mg-1)回收率/%纯化倍数粗酶液2008452.00122.4469.031001硫酸铵沉淀423747.4831.26119.8844.341.74DEAE阴离子交换层析482665.3214.03189.9731.532.75葡聚糖G-150凝胶层析141285.842.13603.6815.218.75
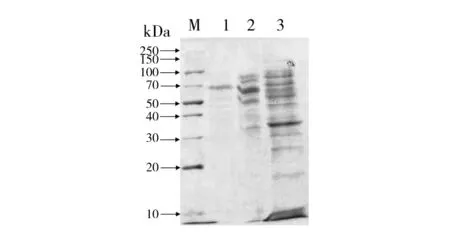
图4 单宁酶SDS-PAGE电泳图谱Fig.4 SDS-PAGE of tannaseM:Marker;1:葡聚糖G-150凝胶层析;2:DEAE-纤维素阴离子交换层析;3:粗酶液M: marker;1: gel filtration Sephadex G-150 column;2: ion exchange chromatography DEAE-Cellulose column;3: crude enzyme
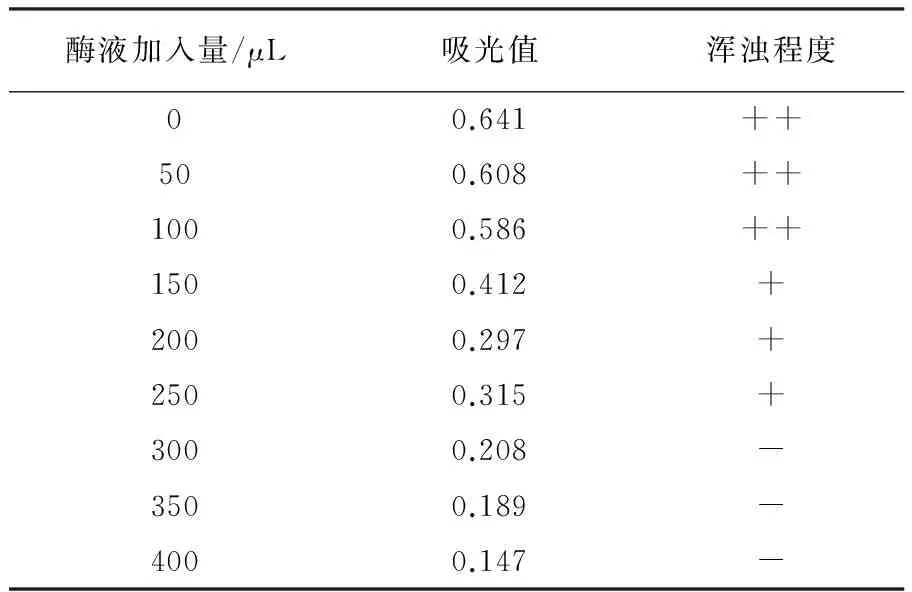
酶液加入量/μL吸光值浑浊程度00.641++500.608++1000.586++1500.412+2000.297+2500.315+3000.208-3500.189-4000.147-
注:“++”浑浊;“+”较浑浊;“-”较澄清
3 讨 论
黑茶是我国特有的茶类,主要品种包括黑毛茶、普洱茶、茯砖茶和六堡茶等,是后发酵茶(post-fermented tea)[6,13]。相比较于绿茶、青茶和红茶等,其特点是在茶叶的制作过程中有微生物参与发酵过程,这些微生物包括真菌、细菌、放线菌和酵母菌[13-14]。目前,对产自我国不同地域的黑茶相关微生物均有研究,其中真菌的研究较多。参与不同地域、不同品种黑茶发酵的微生物各有特色,如参与黑毛茶和普洱茶发酵的优势菌主要是酵母菌、曲霉属(Aspergillus)、青霉属(Penicillium)、根霉属(Rhizopus)的一些种[14-15];参与茯砖茶发酵的主要是散囊菌属(Eurotium)的种[16];而参与六堡茶发酵的主要是曲霉属、酵母菌和散囊菌属的真菌[17]。这些不同微生物的发酵作用是形成不同黑茶品质风味的基础。但是,由于传统的黑茶后发酵时间长,涉及的微生物群落复杂,不同地域环境各异,因此,已有的研究还显得不够系统,对具体某一黑茶生产过程中微生物的种类、数量、种群演替及其功能还不清楚。本研究采用常规的微生物分离方法,从勐海七子饼茶、六堡茶和南糯山普洱茶等3个黑茶品种中分离获得44株菌株,主要为曲霉属、青霉属和散囊菌属的种类,进一步验证已有的研究结果。但是,不同黑茶品种其真菌分离率不同,其中勐海七子饼茶中真菌分离率最高,达到61.36%,表明不同黑茶品种中微生物数量是有差异的。
分离获得的44株真菌,经过单宁酶鉴别培养基初筛,其中26株产生透明圈,显示出此26株菌能产生分解单宁酸的物质。在鉴别平板上,利用微生物对单宁酸的分解作用而初步判断菌株的产单宁酶活性[5],对于大量菌株的快速筛选,本研究的结果表明是可行的。产单宁酶菌株占供试菌株的59.10%,这些单宁酶分解菌株分别存在于曲霉属、青霉属和散囊霉属的菌株中,表明我国黑茶中存在丰富的产单宁酶微生物。通过以麸皮为主要基质的固体发酵、酶活测定、单宁酶的分离和纯化,本研究筛选到1株产单宁酶水平相对较高的青霉菌株MP-24。已有的产单宁酶微生物菌株主要分离自植物(包括枯枝落叶)和富含单宁的土壤、工业废水等,获得的菌株主要是真菌类的曲霉属和青霉属的种类,单宁酶的生产菌株也主要来自于这两个属的真菌[1,5]。我国黑茶种类多,生产地域广,不同生产环境各具特色,蕴含丰富的微生物菌种资源,今后可以加强研究和开发。
茶水[18-20]、茶叶提取物(如茶多酚、儿茶素、EGCG[21-22])、茶叶[23]等在单宁酶作用下,其中的主要成分儿茶素、黄酮类等的数量和种类会发生变化。茶树植物单宁酶的研究很少,聂志银等[24]自新鲜茶叶中鉴定一种脂型儿茶素水解酶,催化脂型儿茶素分解成没食子酸(GA)和非脂型儿茶素,具有与单宁酶类似的功能。然而,经高温杀青后,茶叶细胞自身的酶类(包括单宁酶)基本被钝化而失去活力。黑茶后发酵过程中参与茶叶成分代谢和生物转化的酶类主要来自微生物[25-26],但具体是哪些微生物的哪些酶类参与茶叶成分的代谢,仅有较少的报道。Sariri等[27]和蔡正安等[28]分别研究了1株曲霉菌(Aspergillussp.)和1株冠突散囊菌(E.cristatum) 的纤维素酶;Mohammad等[29]在伊朗分析了10个制茶厂样品中芽胞杆菌种群,检测到16个菌株的多酚氧化酶和过氧化物酶活性。青霉MP-24菌株分离自黑茶,利用茶叶和茶梗为唯一有机质固体发酵生产单宁酶,对茶汤有良好的澄清效果,为微生物参与茶叶成分的生物转化提供佐证,也为后续研究和开发应用打下基础。
[1] Aguilar CN,Rodríguez R,Gutierrez-Sanchez G,et al.Microbial tannases: advances and perspectives[J].Applied Microbiology and Biotechnology,2007,76: 47-59.
[2] Chávez-González M,Rodríguez-Durán LV,Balagurusamy N,et al.Biotechnological advances and challenges of tannase: an overview[J].Food and Bioprocess Technology,2011,5(2): 445-459.
[3] 龚玉雷,魏春,王芝彪,等.生物酶在茶叶提取物加工技术中的应用[J].茶叶科学,2013,33(4): 311-321.
[4] Batra A,Saxena R.Potential tannase producers from the generaAspergillusandPenicillium[J].Process Biochemistry,2005,40(5): 1553-1557.
[5] Murugan K,Saravanababu S,Arunachalam M.Screening of tannin acyl hydrolase (E.C. 3.1.1.20) producing tannery effluent fungal isolates using simple agar plate and SmF process[J].Bioresource Technology,2007,98: 946-949.
[6] Li S,Lo C-Y,Pan M-H,et al.Black tea: chemical analysis and stability[J].Food & Function,2013,4: 10-18.
[7] 刘文瑶,陈忠正,李斌,等.绿茶茶汤混菌发酵过程中内质成份的变化[J].茶叶科学,2011,31(3):225-229.
[8] 李适,龚雪,刘仲华,等.冠突散囊菌对茶叶品质成分的影响研究[J]. 菌物学报,2011,33(3):713-718.
[9] Maria John KM,Thiruvengadam M,Enkhtaivan G.Variation in major phenolic compounds and quality potential of CTC black tea elicited bySaccharomycescercevisiaeand its correlation with antioxidant potential[J].Industrial Crops and Products,2014,55: 289-294.
[10]Sharma S,Bhat T,Dawra R.A spectrophotometric method for assay of tannase using rhodanine[J].Analytical Biochemistry,2000,279(1): 85-89.
[11]孔华忠.中国真菌志(第35卷 青霉属及其相关有性型属)[M].北京:科学出版社,2007.
[12]苏经迁,黄彬,邱慧,等.产生物碱和石杉碱甲蛇足石杉内生真菌的初步研究[J].中国药学杂志,2011,46(19):1477-1481.
[13]Zhang L,Zhang Z-Z,Zhou Y-B, et al.Chinese dark tea: postfenmentation, chemistry and biological activities[J].Food Research International,2013,53: 600-607.
[14]温琼英,刘素纯.黑茶渥堆(堆积发酵)过程中微生物种群的变化[J].茶叶科学,1991,11(增刊): 10-16.
[15]Abe M,Takoka N,Idemote Y,et al.Charateristic fungi observed in fenmentation process for Puer tea[J].International Journal of Food Microbiology,2008,124: 199-203.
[16]Xu A,Wang Y,Wen J,et al.Fungal community associated with fenmentation and storage of Fuzhuan brick-tea[J]. International Journal of Food Microbiology,2011,146: 14-22.
[17]温志杰.六堡茶渥堆过程中真菌菌群构成与主要菌种添加发酵效果的研究[D].南宁:广西大学,2013.
[18]Lu M-J,Chen C.Enzymatic modification by tannase increase the antioxidant activity of green tea[J].Food Research International,2008,41: 130-137.
[19]Macedo JA,Ferreira LA,camara LE,et al.Chemopreventive potential of the tannase-mediated biotransformation of green tea[J].Food Chemistry,2012,133: 358-365.
[20]Yao J,Chen Q,Zhong G,et al.Immobilization and characterization of tannase from a metagenomic library and its use for removal of tannins from green tea infusion[J].Journal of Microbiology and Biotechnology,2014,24(1): 80-86.
[21]Battestin V,Macedo GA,De Freitas VAP.Hydrolysis of epigallocatechin gallate using a tannase fromPaecilomycesvariotii[J].Food Chemistry,2008,108: 228-233.
[22]Noh DO,Choi H-S,Suh HJ.Catechine biotransformation by tannase with sequential addition of substrate[J].Process Biochemistry,2014,49 : 271-276.
[23]Hong Y-H,Jung EY,Park Y,et al.Emzymatic improvement in the polyphenol extractability and antioxidant activity of green tea extracts[J].Biosci.Biotechnol.Biochen.,2013,77(1): 22-29.
[24]聂志银,刘亚军,刘莉,等.茶树脂型儿茶素水解酶鉴定及其检测体系的建立[J].茶叶科学,2011,31(5):439-446.
[25]刘仲华,黄建安,施兆鹏.黑茶初制中主要酶类的变化[J].茶叶科学,1991,11(增刊): 17-22.
[26]黄建安,刘仲华,施兆鹏.茯砖茶制造中主要酶类的变化[J].茶叶科学,1991,11(增刊): 63-68.
[27]Sariri R,Najati F,Arasteh A.The effect of callulase extracted from symbiotic tea fungus on the quality of Iranian tea[J].Enzyme and Microbial Technology,2006,39: 308-310.
[28]蔡正安,刘素纯,刘仲华,等.茯砖茶中冠突散囊菌纤维素酶的酶学性质研究[J].茶叶科学,2010,30(1):57-62.
[29]Mohammad FG,Alireza T.Isolation and characterization of polyphenol oxidase-and peroxidase-producingBacillusstrains from fully fermented tea(Camelliasinensis)[J].World Journal of Microbiology and Biotechnology,2007,23: 1327-1332.
Isolation & Screening of Tannase Producing Strains from Chinese Dark Tea
GAO Chen1, ZHU Ji-xin1, HUANG Jing1, YANG Min-he1, 2
(1.Coll.ofLifeSci., 2.Engin.Res.Ctr.ofIndust.Microbiol.,Minist.ofEduc.,FujianNormalUni.,Fuzhou350108)
Tea leaves are rich in tannin compounds. The present study was to screen tannase high-producing strains from fungi isolated from Chinese dark tea and proceed to isolate and purify the tannase, analyze the trans-soluble effect of tannase on tea broth. A total of 44 fungal strains were isolated from 3 kinds of Chinese dark tea samples. Most of them were initially identified as members ofAspergillus,PenicilliumandEurotium. Twenty-six isolated fungal strains showed tannic acid hydrolysis activity by producing transparent circle on identification agar plate, which indicated tannase producing potential, by using agar plate tests. A fungal strain MP-24 with fairly high tannase activity after re-screening on solid state fermentation was screened, it was initially identified as a strain ofPenicillium, and named asPenicilliumMP-24 strain. It could produce tannase by solid fermentation using tea leaf, tea stem, wheat bran and other agricultural and side-line products as raw materials. Fermented product using wheat bran as raw material obtained a single protein band of 70 kDa in molecular weight, after precipitated in grades with ammonium sulfate, DEAE-cellulose anion exchange chromatography and Sephadex G-150 chromatography and other isolation and purification measures, and the tannase activity was as high as 603.68 U/mg. The purified tannase had a good trans-soluble effect on tea broth. The results of the study suggested that microbes related to Chinese dark tea are rich in tannin producing strains; it is an important resource of industrial tannase preparation.
Chinese dark tea; fungi; tannase; isolation and purification; catechin
福建省科技厅重点项目(2012N0013);福建省自然科学基金项目(2012J01122)
高琛 男,硕士研究生。研究方向为应用微生物学。E-mail:327776558@qq.com
* 通讯作者。男,硕士生导师,博士。研究方向为微生物资源与生态、微生物代谢产物。E-mail: minhe214@fjnu.edu.cn
2014-11-09;
2015-01-20
Q934
A
1005-7021(2015)05-0028-08
10.3969/j.issn.1005-7021.2015.05.006