黄芪多糖联合顺铂对人肺癌A549细胞增殖抑制作用及其机制研究
2015-12-26李蓉章运生谭小武
李蓉,章运生,谭小武
(1.南华大学附属第二医院呼吸内科,湖南衡阳421001;2.南华大学附属第二医院临床研究所,湖南衡阳421001)
·肿瘤治疗研究专题·
黄芪多糖联合顺铂对人肺癌A549细胞增殖抑制作用及其机制研究
李蓉1,章运生2,谭小武1
(1.南华大学附属第二医院呼吸内科,湖南衡阳421001;2.南华大学附属第二医院临床研究所,湖南衡阳421001)
目的观察黄芪多糖与顺铂对人肺癌A549细胞增殖、细胞周期、诱导凋亡的影响,并对其作用机制进行初步探讨。方法采用四甲基偶氮唑盐法检测黄芪多糖、顺铂及两药联合对细胞增殖的影响;用流式细胞仪分析对细胞周期及凋亡率的影响;用反转录聚合酶链反应(RT-PCR)和Western blotting法检测对人肺癌A549细胞B细胞淋巴瘤-白血病2(Bcl-2)、Bcl相关X蛋白(Bax)和半胱氨酸天冬氨酸蛋白酶3(Caspase-3)基因表达水平的影响。结果黄芪多糖、顺铂及两药联合对人肺癌A549细胞的增殖抑制作用呈时间-浓度依赖关系;与阴性对照组比较,黄芪多糖作用后可出现G1期细胞阻滞,顺铂作用后出现S期细胞阻滞,两药联合出现G1、S期细胞阻滞,差异均有统计学意义(P<0.01)。两药联合较阴性对照组及单用黄芪多糖、顺铂明显上调Bax、Caspase-3 mRNA及蛋白的表达,下调Bcl-2 mRNA及蛋白的表达,差异均有统计学意义(P<0.01)。结论黄芪多糖可协同顺铂增强对人肺癌A549细胞的促凋亡作用,其作用机制与上调Bax、Caspase-3的表达、下调Bcl-2的表达有关。
黄芪多糖;顺铂;半胱氨酸天冬氨酸蛋白酶3;人肺癌A549细胞;Bcl相关X蛋白;B细胞淋巴瘤-白血病2
肺癌是世界最常见的恶性肿瘤,其发病率和死亡率逐年升高,根据世界卫生组织2014年报告,肺癌为全球癌症死因的首位,已成为累积危险性最高的肿瘤[1]。大多数肺癌患者就诊时已为晚期[2]。目前,非小细胞肺癌的治疗主要采用手术,放、化疗,中药等综合治疗方案,化疗在综合治疗中的地位尤为重要,以铂类联合其他化疗药物的两药方案已成为治疗晚期非小细胞肺癌的标准一线方案[3]。顺铂(DDP)为晚期非小细胞肺癌化疗的一线药物,对肿瘤有肯定的疗效,但其非血液毒性较大,限制了其使用剂量[4]。
中药由于在肿瘤治疗方面有其独特的优势,正受到广泛关注,中医治疗肺癌能减轻手术,放、化疗的不良反应,提高机体免疫力,提高患者生活质量[5-6]。黄芪是我国传统中药,黄芪多糖(APS)是黄芪的主要活性成分之一,具有增强机体免疫系统功能、抗肿瘤、抗氧化、延缓衰老等诸多药理学作用[7-8]。APS应用于临床治疗肿瘤的有效性及安全性已被证实,其可通过诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖等而发挥抑瘤作用。近年来,APS的抗肿瘤作用取得了不少新的研究成果,但APS与抗肿瘤药物联用的研究较少,本研究选用人肺癌A549细胞作为研究对象,探究APS与DDP联合对其增殖、细胞周期及对凋亡相关蛋白——B细胞淋巴瘤白血病-2(Bcl-2)、Bcl相关X蛋白(Bax)和半胱氨酸天冬氨酸蛋白酶3(Caspase-3)的影响,旨在为临床应用APS治疗肺癌提供理论和实验依据,现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞株人肺癌A549细胞株购自上海细胞中心。
1.1.2 主要试剂APS购自上海颖心实验室有限公司,DDP购自山东齐鲁药业股份有限公司,四甲基偶氮唑盐(MTT)购自美国Sigma公司,碘化丙啶(PI)、二喹啉甲酸(BCA)蛋白试剂盒、增强化学发光(ECL)试剂盒均购自碧云天生物研究所,聚合酶链反应(PCR)试剂盒购自Promega公司,Bcl-2兔抗人单克隆抗体、Bax兔抗人单克隆抗体、Caspase-3兔抗人单克隆抗体均购自Santa Crus公司,辣根过氧化物酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司(进口分装)。
1.1.3 主要仪器细胞培养箱购自美国Forma公司,倒置显微镜购自日本奥林巴斯CK-2,离心机购自德国Eppendorf 525L,酶标仪(Rayto RT-6000型)购自深圳雷杜生命科学股份有限公司,流式细胞仪(FACS)购自BD公司,PCR仪(TC-XP-G型)购自杭州博日科技有限公司,电泳仪(DYY-8C型)购自北京市六一仪器厂。
1.2 方法
1.2.1 MTT法检测APS与DDP对人肺癌A549细胞增殖的影响根据倍增时间选择对数生长期人肺癌A549细胞,以每孔5×103个细胞接种于96孔板中,每孔体积200 μL,接种3块板。培养过夜后吸弃培养孔内上清液,单一用药组分别加入质量浓度为50、100、200、400 mg/L APS 100 μL或1、2、4 mg/L DDP 100 μL,联合用药组分别加入质量浓度为2 mg/L DDP和400 mg/L APS 200 μL,每个质量浓度设5个复孔,同时,设阴性对照组,以磷酸盐缓冲液(PBS)填充,置于孵育箱内继续培养,于24、48、72 h各取出1块培养板每孔加入20 μL MTT溶液,继续培养4 h,而后小心吸取孔内液体并加入二甲基亚砜150 μL,置于振荡器上10 min使其充分溶解,用PCR仪以490 nm波长对各孔光密度(OD)值进行检测并记录结果。实验重复3次。细胞增殖抑制率(%)=(1-OD加药组/OD阴性对照组)×100%。
1.2.2 流式细胞术检测细胞周期与凋亡水平选择对数生长期人肺癌A549细胞,调整细胞密度为1×106mL-1,然后接种于6孔板内,相同质量浓度设2个复孔,培养12 h。单一用药组向每孔细胞分别加入APS(200 mg/L)、DDP(2 mg/L),联合用药组加入APS 200 mg/L及DDP 2 mg/L,各2 mL;阴性对照组不加入药物,继续培养48 h。加入PBS1mL清洗2次,胰蛋白酶消化低速离心,弃PBS,加入70%冰醋酸1 mL固定细胞样本,4℃冰箱内过夜。再次离心,将固定液吸出,加入PBS 3 mL重悬,离心后弃PBS。将样品取出再向管内加入50 μg/mLPI溶液1mL,4℃避光染色30 min。选用488 nm激发波长对待测样品进行流式细胞仪检测,实验重复3次。
1.2.3 RT-PCR检测Bax、Bcl-2和Caspase-3 mRNA的表达水平选择对数生长期人肺癌A549细胞,调整细胞密度为1×106mL-1,然后,接种于6孔板内,相同质量浓度设2个复孔,培养12 h。单一用药组向每孔细胞分别加入APS(200 mg/L)、DDP(2 mg/L),联合用药组加入APS(200 mg/L)及DDP(2 mg/L),阴性对照组不加入药物,继续培养48 h。用Trizol法提取总RNA,反转录合成cDNA。引物序列:Bcl-2基因,上游5′-CTTTTGCTGTGGGGTTTTGT-3′,下游5′-GTCATTCTGGCCTCTCTTGC-3′;Bax基因,上游5′-GGAGCTGCAGAGGATGATTG-3,下游5′-CCTCCCAGAAAAATGCCATA-3′;Caspase-3基因,上游5′-AGGGGTCATTTATGGGACA-3′,下游5′-TACACGGGATCTGTTTCTTTG-3′;甘油醛-3-磷酸脱氢酶(GAPDH)基因,上游5′-AGATCCACAACGGATACATT-3′,下游5′-TCCCTCAAGATTGTCAGCAA-3′。RT-PCR严格按照试剂盒说明书操作,反应条件:94℃变性5 min,扩增30个循环(94℃60 s、57℃30 s、72℃60 s),72℃延伸5 min。扩增产物用1.5%琼脂糖进行电泳,用UVP凝胶成像系统观察结果并拍照,实验重复3次,采用Adobe Photoshop CS5进行灰度值分析。
1.2.4 Western blotting法检测Bax、Bcl-2和Caspase-3蛋白的表达水平选择对数生长期人肺癌A549细胞,调整细胞密度为1×106mL-1,然后,接种于6孔板内,相同质量浓度设2个复孔,培养12 h。单一用药组向每孔细胞分别加入APS(200 mg/L)、DDP(2 mg/L),联合用药组加入APS(200 mg/L)及DDP(2 mg/L),阴性对照组不加入药物,继续培养48 h,弃培养液,加入预冷PBS 3 mL漂洗细胞,置冰上加入含1%苯甲基磺酰氟(PMSF)的蛋白裂解液作用30 min,收集上清液。用试剂盒测定蛋白水平。经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳,转移蛋白样品至硝酸纤维素膜上,5%脱脂奶粉封闭90 min,加入一抗溶液(1∶500)4℃过夜。本研究以β-肌动蛋白(β-actin)作为内参基因,用TBST(含0.1%吐温20-Tris缓冲液)洗膜。加入辣根过氧化物酶二抗溶液(1∶2 000),室温孵育2 h。洗膜后加入ECL化学发光液,暗室内曝光胶片,用UVP凝胶成像系统观察结果并拍照,实验重复3次,采用Adobe Photoshop CS5进行灰度值分析。
1.3 统计学处理应用SPSS18.0统计软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析,两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 APS对人肺癌A549细胞增殖的影响APS对人肺癌A549细胞具有增殖抑制作用,在同一作用时间下,随着APS质量浓度的增加,抑制作用逐渐增强;在同一药物质量浓度下,随着APS作用时间的延长,抑制作用逐渐增强,差异均有统计学意义(P<0.01),见表1。
表1 APS不同质量浓度及作用时间人肺癌A549细胞增殖抑制率比较(±s,%)

表1 APS不同质量浓度及作用时间人肺癌A549细胞增殖抑制率比较(±s,%)
注:与阴性对照组同时间点比较,aP<0.01;与同组24 h比较,bP<0.01;与同组48 h比较,cP<0.01。
组别阴性对照组APS(mg/L)50 100 200 400作用时间24 h48 h72 h 0.65±0.120.88±0.111.10±0.15 9.77±0.25abc13.93±1.07ab23.27±0.49abc25.32±0.26abc3.59±0.34a8.08±0.28a12.06±0.23a16.04±0.38a7.32±0.15ab12.80±0.37ab20.60±0.45ab22.53±0.49ab
2.2 DDP对人肺癌A549细胞增殖的影响DDP对人肺癌A549细胞具有显著的增殖抑制作用,在同一作用时间下,随着DDP质量浓度的增加,抑制作用逐渐增强;在同一药物质量浓度下,随着DDP作用时间的延长,抑制作用逐渐增强,差异均有统计学意义(P<0.01),见表2。
表2 DDP不同质量浓度及作用时间人肺癌A549细胞增殖抑制率比较(±s,%)

表2 DDP不同质量浓度及作用时间人肺癌A549细胞增殖抑制率比较(±s,%)
注:与阴性对照组同时间点比较,aP<0.01;与同组24 h比较,bP<0.01;与同组48 h比较,cP<0.01。
组别阴性对照组DDP(mg/L)作用时间24 h48 h72 h 0.65±0.120.88±0.111.10±0.15 124 5.03±0.25a15.46±0.45a23.83±0.25a8.47±0.21ab40.87±0.85ab51.56±0.46ab11.74±0.26abc48.84±0.32abc59.34±1.32abc
2.3 APS联合DDP对人肺癌A549细胞增殖的影响
APS与DDP联合对人肺癌A549细胞增殖有较强抑制作用,随着时间的延长,抑制作用增强,联合用药组抑制率与单一用药组比较,差异均有统计学意义(P<0.01),见表3。
表3 联合用药组与单一用药组人肺癌A549细胞增殖抑制率比较(±s,%)

表3 联合用药组与单一用药组人肺癌A549细胞增殖抑制率比较(±s,%)
注:与联合用药组同时间点比较,aP<0.01;与同组24 h比较,bP<0.01;与同组48 h比较,cP<0.01。
组别作用时间24 h48 h72 h单一用药组APS组DDP组联合用药组16.04±0.38a15.46±0.45a25.12±0.73 22.53±0.49ab40.87±0.85ab53.94±0.25b25.32±0.26ac48.84±0.32ac63.94±0.69c
2.4 APS联合DDP对人肺癌A549细胞周期和凋亡的影响APS作用后可使人肺癌A549细胞中G1期细胞比例上升,出现G1期细胞阻滞;而DDP作用后S期细胞比例有所增加,出现S期细胞阻滞;APS与DDP联合可使G1、S期细胞比例均上升,表现为G1、S期细胞阻滞。联合用药组细胞凋亡率较单一用药组明显增加,差异均有统计学意义(P<0.05),见表4。
表4 各组人肺癌A549细胞周期阻滞及凋亡率比较(±s,%)

表4 各组人肺癌A549细胞周期阻滞及凋亡率比较(±s,%)
注:与阴性对照组比较,aP<0.01;与联合用药组比较,bP<0.01,cP<0.05。
组别阴性对照组单一用药组APS组DDP组联合用药组凋亡率0.99±0.21细胞周期G1SG252.82±0.8432.56±1.2014.65±1.02 10.43±0.83a8.92±0.89a4.69±0.75a11.53±1.24ac16.60±0.69ac19.08±0.86a61.06±0.78ab46.76±1.11ab59.85±1.05a28.51±0.69b44.34±1.82ab35.44±1.01
2.5 APS联合DDP对人肺癌A549细胞Caspase-3、Bcl-2、Bax mRNA表达水平的影响APS及DDP均可促进人肺癌A549细胞Bax、Caspase-3 mRNA表达和抑制Bcl-2 mRNA表达,差异均有统计学意义(P<0.01)。APS与DDP联合作用效果更强,与单一用药组比较,差异均有统计学意义(P<0.01),见图1。各组Bcl-2/GAPDH、Bax/ GAPDH、Caspase-3/GAPDH灰度值比值,见表5。
表5 各组Bcl-2/GAPDH、Bax/GAPDH、Caspase-3/GAPDH灰度值比值(±s,n=3)

表5 各组Bcl-2/GAPDH、Bax/GAPDH、Caspase-3/GAPDH灰度值比值(±s,n=3)
注:与阴性对照组比较,aP<0.01;与联合用药组比较,bP<0.01。
组别Bax/GAPDHCaspase-3/ GAPDH阴性对照组单一用药组APS组DDP组联合用药组Bcl-2/GAPDH 0.87±0.050.15±0.030.33±0.02 0.67±0.10ab0.54±0.07ab0.21±0.06a0.47±0.07ab0.67±0.08ab0.82±0.09a0.42±0.11ab0.64±0.07ab0.71±0.08a
2.6 APS联合DDP对人肺癌A549细胞Caspase-3、Bcl-2、Bax蛋白表达水平的影响与阴性对照组比较,APS与DDP均可明显促进人肺癌A549细胞Bax、Caspase-3蛋白表达,而抑制Bcl-2蛋白表达,APS与DDP联合作用效果更强,与阴性对照组及单一用药组比较,差异均有统计学意义(P<0.01),见图2。各组Bcl-2/β-actin、Bax/β-actin、Caspase-3/β-actin灰度值比值,见表6。

图2 各组人肺癌A549细胞Caspase-3、Bcl-2、Bax蛋白表达水平比较
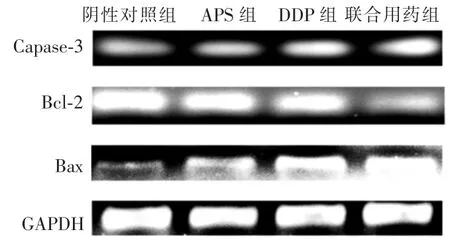
图1 各组人肺癌A549细胞Bax、Bcl-2、Caspase-3mRNA表达水平比较
表6 各组Bcl-2/β-actin、Bax/β-actin、Caspase-3/β-actin灰度值比值(±s,n=3)

表6 各组Bcl-2/β-actin、Bax/β-actin、Caspase-3/β-actin灰度值比值(±s,n=3)
注:与阴性对照组比较,aP<0.01;与联合用药组比较,bP<0.01。
组别Bcl-2/β-actinBax/β-actinCaspase-3/β-actin阴性对照组单一用药组APS组DDP组联合用药组0.75±0.050.53±0.070.59±0.05 0.62±0.04ab0.43±0.01ab0.23±0.05a0.61±0.04ab0.63±0.03ab0.91±0.02a0.79±0.08ab0.85±0.09ab0.89±0.02a
3 讨论
肺癌是世界范围内最常见恶性肿瘤之一,目前还难找到肺癌的特效疗法。DDP为肺癌化疗中的常用药物,但其非血液毒性较大,寻找高效、低毒的肿瘤化疗药物及增强化疗效果迫在眉睫。在我国中医药治疗恶性肿瘤历史悠久,拥有独特的理论体系。APS具有广泛的抗肿瘤作用,可通过诱发细胞凋亡而发挥抗肿瘤作用。有研究表明,APS能诱导人胃癌MKN45细胞凋亡[9]。APS对肝癌BEL-7404细胞有杀伤作用,与DDP联用具有协同抗肿瘤作用。本研究采用MTT法检测细胞存活水平,结果显示,APS联合DDP对人肺癌A549细胞的生长具有浓度依赖性抑制作用。
APS具有抗肿瘤作用,其机制复杂。既往实验研究表明,APS对肿瘤细胞G1期具有阻滞作用,为APS抗肿瘤及协同化疗药物抗肿瘤研究提供了实验依据[10-11]。冯涛等[12]发现,APS将肝癌HepG2细胞阻滞于G1期,从而诱导细胞凋亡。本研究采用流式细胞术检测细胞周期及凋亡率,结果显示,APS作用48 h后细胞周期构成发生变化,G1期细胞比例增多,出现G1期细胞阻滞,与刘爱平等[13]研究结果相似。DDP作用相同时间,S期细胞比例有所增加,联合药物组G1、S期细胞比例均上升。同时,本研究结果显示,细胞凋亡水平增高,与阴性对照组比较,APS、DDP及联合用药凋亡率均增加。提示APS可通过对人肺癌A549细胞G1期的阻滞作用,DDP可通过对人肺癌A549细胞S期的阻滞作用,共同发挥诱导细胞凋亡的作用。
细胞凋亡受多基因的调控,Bcl-2家族和Caspase家族在线粒体途径中发挥了极为重要的调控作用。Bcl-2、Bax是影响细胞凋亡的2个对立因素,Bax具有促进细胞凋亡作用,Bcl-2基因是一种重要的细胞凋亡抑制基因,其可与Bax形成异源二聚体,通过阻断细胞色素C(Cyt-C)的释放,抑制下游Caspase-3的激活[14]。国内外研究表明,Bcl-2与Bax表达水平的高低与凋亡调控直接相关。Caspase-3在细胞凋亡的信号转导中具有中枢效应器作用[15]。Bcl-2、Bax与Caspase-3在细胞凋亡转导过程中既相互联系又相互制约,过表达Bcl-2可与Bax形成异源二聚体,抑制Bax的转位及二聚体化,通过阻断Cyt-C的释放,抑制下游Caspase-3的激活,从而抑制细胞凋亡的发生。Caspase-3表达增强反过来抑制Bcl-2活性,而促进细胞凋亡[16-17]。本研究采用RT-PCR和Western blotting检测人肺癌A549细胞Bcl-2、Bax、Caspase-3 mRNA和蛋白表达情况,结果显示,与阴性对照组比较,单一用药组Bcl-2 mRNA及蛋白表达均下调,Bax、Caspase-3 mRNA及蛋白表达均上调,联合用药组效果更明显,提示APS、DDP可能通过下调人肺癌A549细胞Bcl-2 mRNA和蛋白表达水平,上调BaxmRNA和蛋白表达水平,从而形成同源二聚体而发挥诱导细胞凋亡作用,同时,上调Caspase-3 mRNA和蛋白表达水平,共同诱导细胞凋亡。
综上所述,APS、DDP可能通过下调人肺癌A549细胞Bcl-2 mRNA和蛋白的表达,上调Bax、Caspase-3 mRNA和蛋白表达,从而达到共同诱导细胞凋亡的作用。
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]Chen W,Zheng R,Zhang S,et al.Annual report on status of cancer in China,2010[J].Chin J Cancer Res,2014,26(1):48-58.
[3]Goffin J,Lacchetti C,Ellis PM,et al.First-line systemic chemotherapy in the treatment of advanced non-small cell lung cancer:a systematic review[J]. J Thorac Oncol,2010,5(2):260-274.
[4]Jin XM.The toxic effects and preventive measures of platinum drugs[J]. Mod Med Health,2010,26(21):3294-3295.
[5]刘嘉湘.发挥中西医优势治疗肺癌[J].中医学报,2014,29(3):314-315.
[6]张阳,张伟.扶正补虚法在肺癌治疗中的应用探讨[J].中医学报,2014(1):7-8.
[7]何文涓,袁志坚,何晓升.黄芪多糖的药理作用研究进展[J].中国生化药物杂志,2012,33(5):692-694.
[8]柴旺,何小鹃,朱军璇,等.黄芪多糖对B16-F10荷瘤鼠髓样抑制细胞免疫活性的影响[J].中国中医基础医学杂志,2012,18(1):63-65.
[9]黄惠风,钱建业,谢少茹.黄芪多糖对人胃癌细胞MKN45诱导凋亡和细胞周期的影响[J].实用临床医药杂志,2010,14(19):17-20.
[10]陈瑾歆,何军,张娟娟,等.黄芪多糖对人肝癌细胞HepG2凋亡相关基因表达的影响[J].中国老年学杂志,2014,34(1):124-126.
[11]吴朝妍,张莹雯,叶太生,等.NF-κB抑制介导的黄芪多糖抗人肺癌细胞效应[J].武汉大学学报:医学版,2013,34(2):174-177.
[12]冯涛,张保国.黄芪多糖对肝癌HepG2细胞的抑制作用及其机制[J].实用老年医学,2010,24(6):486-488.
[13]刘爱平,曾峰.黄芪多糖对人肺癌A549细胞增殖的作用及其机制的实验研究[J].肿瘤药学,2011,1(6):499-501.
[14]Pritchard JR,Gilbert LA,Meacham CE,et al.Bcl-2 family genetic profiling reveals microenvironment-specific determinants of chemotherapeutic response[J].Cancer Res,2011,71(17):5850-5858.
[15]Zhou J,Zhang S,Ong CN,et al.Critical role of pro-apoptotic Bcl-2 family members in andrographolide-induced apoptosis in human cancer cells[J]. Biochem Pharmacol,2006,72(2):132-144.
[16]Kuethe F,Sigusch HH,Bornstein SR,et al.Apoptosis in patients with dilated cardiomyopathy and diabetes:a feature of diabetic cardiomyopathy[J]. Horm Metab Res,2007,39(9):672-676.
[17]Lanave C,Santamaria M,Saccone C.Comparative genomics:the evolutionary history of the Bcl-2 family[J].Gene,2004,333:71-79.
Study on proliferation inhibition and its mechanism of astragalus polysaccharide combined with cisplatin on human lung cancer A549 cells
Li Rong1,Zhang Yunsheng2,Tan Xiaowu1
(1.Department of Respiratory Medicine,the Second Affiliated Hospital of University of South China,Hengyang,Hunan 421001,China;2.Clinical Research Institute,the Second Affiliated Hospital of University of South China,Hengyang,Hunan 421001,China)
ObjectiveTo observe the inhibitory effects of astragalus polysaccharides and cisplatin on the cell proliferation,cycle,apoptosis induction of human lung cancer A549 cells,and initially discuss its action mechanism.MethodsThe effects on cell proliferation of astragalus polysaccharides,cisplatin and their combinations was detected by MTT assay.It analyzed the impact of cell cycle and apoptosis rate by flow cytometry.The A549 human lung cancer cells Bax,Bcl-2 and Caspase-3 gene expression levels by reverse transcription polymerase chain reaction(RT-PCR)and Western blotting.ResultsAstragalus polysaccharide,cisplatin and two-drug combination on inhibition of proliferation of human lung cancer A549 cells had a time-concentration-dependent proliferation.Compared with the negative control group,the cell cycle blockage in G1 phase after astragalus polysaccharide action while the cell cycle blockage in S phase after cisplatin action and the application of two-drug combination appeared cell cycle blockage by flow cytometry both in G1and S phases(P<0.01).The expression of Bax,Caspase-3 mRNA and protein were upgraded in the expression of the two-drug combination group and lowered in Bcl-2 mRNA protein compared to the negativecontrolandmonotherapygroup.Thedifferencehad statisticalsignificance(P<0.05).ConclusionTheastragaluspolysaccharide combined with cisplatin may strengthen human lung cancer A549 cells to enhance the pro-apoptosis,whose mechanism is associated with upgrading the expression of Bax,Caspase-3 and lowering the expression of Bcl-2mRNA.
Astragalan;Cisplatin;Caspase 3;human lung cancer A549 cells;Bcl associated X protein;B cell lymphoma/leukemia-2
10.3969/j.issn.1009-5519.2015.04.001
A
1009-5519(2015)04-0481-04
2014-10-29)
李蓉(1987-),女,湖南邵阳人,硕士研究生,主要从事呼吸内科工作;E-mail:919876869@qq.com。
谭小武(E-mail:tanxiaowu1970@163.com)。
