陶瓷膜分离技术在D-核糖发酵液预处理过程中的应用
2015-12-25曾乐杨光郑雄敏杨希
曾乐,杨光,郑雄敏,杨希
(江西诚志生物工程有限公司,江西鹰潭,335000)
D-核糖(D-ribose)[1-5]作为遗传物质核糖核酸(RNA)、脱氧核糖核酸(DNA)的组成成分存在于所有生物细胞之中,在生理上起着重要作用。特别是近年来,D-核糖作为抗癌和抗病毒药物、核黄素及风味增强剂等的合成原料在制药工业和食品工业上的需求逐步增大[6-9]。目前,D-核糖的工业生产广泛采用的是发酵法[10-15]。而对于D-核糖发酵液的预处理,传统工业生产上大多采用的是絮凝板框过滤或转鼓过滤法去除发酵液中的大部分菌体及色素等杂质,但其中存在菌体去除不彻底、D-核糖提取收率低、产品杂质残存明显,产生的固废难以处理等问题,逐步被膜工艺所取代[16-17]。
本研究采用新型、高效的陶瓷膜分离技术对D-核糖发酵液进行预处理,分别从膜过滤时间、膜过滤温度来考察其对渗透通量的影响,以及从加水顶洗量与不同过滤方法两方面来研究其对产品收率的影响,以期达到有效去除发酵液中的菌体、大颗粒蛋白及其他杂质,提高D-核糖的提取收率,降低或减少杂质,同时不产生固废,有利于D-核糖产业化、清洁化生产的目的,为D-核糖发酵液的预处理工艺提供技术参考。
1 材料与方法
1.1 材料与试剂
草酸、黄血盐、硫酸锌、活性炭均为分析纯;D-核糖发酵液由江西诚志生物工程有限公司发酵工序提供;发酵液中产D-核糖的菌体为枯草芽孢杆菌(发酵液中的主要固形物质)。
1.2 仪器与设备
陶瓷膜过滤设备(0.24 m2的全回流分离设备,膜规格为100 nm),江苏久吾高科技有限公司;板框过滤设备,浙江建华集团过滤机有限公司;转鼓过滤设备,安丘汶瑞过滤机械有限公司;Agilent 1260高效液相色谱仪(配有示差检测器RID和LC 1260 Open-LAB色谱工作站),美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 发酵液分离制备
取D-核糖发酵液200 L,通过陶瓷膜过滤设备,除去发酵液中的菌体及较大的蛋白及杂质颗粒。具体分离流程如图1。
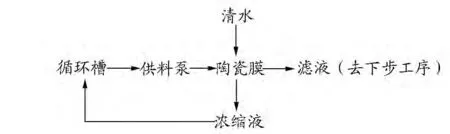
图1 陶瓷膜分离流程示意图Fig.1 Flow diagram of the ceramic membrane separation process
1.3.2 对照实验
取同批发酵液200 L,经过草酸酸化后,加入黄血盐、硫酸锌、活性炭按比例进行絮凝,进行板框过滤,收集滤液作为膜过滤实验的对照样。另取同批发酵液100 L,采用同样方法絮凝后,进行转鼓过滤,收集滤液作为膜过滤实验的对照样。
1.3.3 D-核糖含量的测定
采用高效液相色谱法检测[18],Shodex KS-801糖柱(300 mm KS-8,Showa Denko,Japan),示差折光检测器,进样量为10 μL,色谱柱温度80℃,检测器温度40℃,进样流速为1.0 mL/min,运行时间为15 min。流动相:用0.45 μm的滤膜真空过滤,并于超声波脱气机上超声脱气15 min的超纯水。
1.3.4 样品溶液的制备
取已干燥的D-核糖样品2.0 g(精确至0.000 1 g),置100 mL量瓶中,用流动相溶解,并定容至刻度,摇匀。用注射器吸取上述溶液并用滤膜过滤至进样瓶内,作为供试液(20 μg/mL)待用。
1.3.5 标准品溶液的制备
取D-核糖的标准品,其制备步骤同1.3.4。
2 结果与分析
2.1 陶瓷膜对D-核糖发酵料液渗透性实验
在进膜压力0.3 MPa、出膜压力0.1 MPa,操作温度50℃,不加顶水的条件下,进行了膜单位面积对D-核糖料液渗透性的实验,结果如图2。
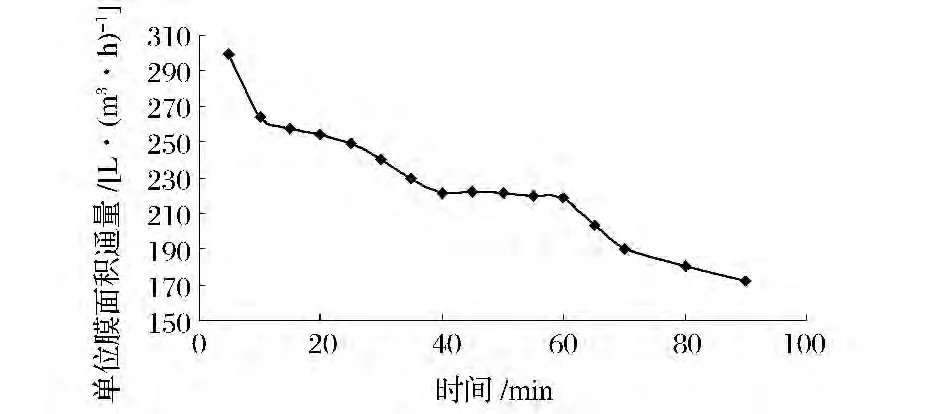
图2 陶瓷膜分离过程中的通量变化曲线Fig.2 Flux changing in the ceramic membrane separation process
图2显示的是D-核糖发酵液在陶瓷膜过滤过程中的通量变化曲线。可以看出在膜过滤初始阶段(0~10 min),料液需形成全回流过程,通量随时间下降明显,此阶段料液体系的组成并没有发生变化;随着膜浓缩过程的进行,大量的菌体、大颗粒蛋白、杂物等物质被陶瓷膜浓缩,通量随时间增长而逐步降低;在膜浓缩过程的持续(40~60 min)期间,料液中的菌体、杂质物质被持续不断的浓缩,因此陶瓷膜的表面形成一层稳定的滤饼层,此时膜通量随时间的增长而变化不大,趋于稳定。最后随着料液体积逐步的减少,料液中的菌体等大颗粒物质的浓度不断升高,通量持续下降。整个过程膜的平均渗透通量为219 L/(m2·h)。
2.2 温度对陶瓷膜通量的影响
通常情况下,温度升高,分子间的热运动加剧,液体的黏度下降,从而使得传质速率加大,图3为温度对D-核糖发酵液在陶瓷膜过滤过程中的通量影响情况。
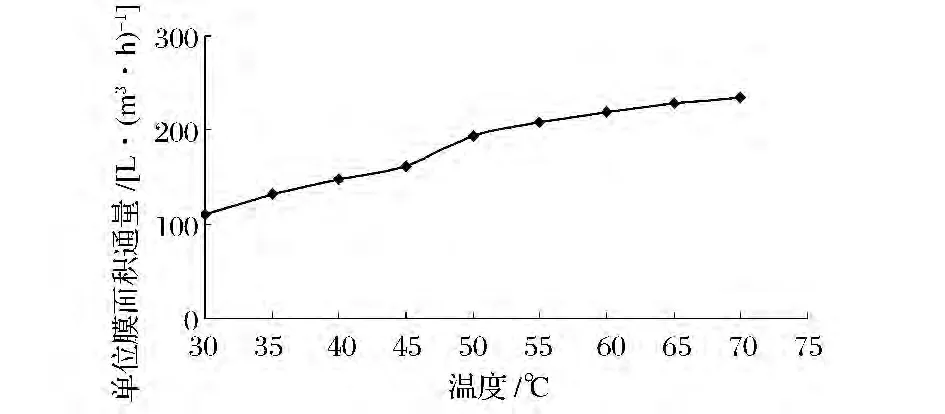
图3 温度对陶瓷膜通量的影响Fig.3 Effect of temperature on the ceramic membrane flux
从图3可以看出,随着温度的升高,D-核糖发酵液在陶瓷膜过滤中的通量逐步增大,因此升高温度是提升D-核糖发酵液在陶瓷膜过滤中通量的有效手段。同时可以看出在45~55℃随着温度升高通量提升的幅度最大,结合实际生产条件及设备要求,D-核糖发酵液在陶瓷膜过滤中的温度控制在45~55℃最佳。
2.3 陶瓷膜过滤加水顶洗量对产品收率的影响
对于发酵液体系的过滤,在板框过滤的滤饼层、陶瓷膜过滤的浓缩液中都会残留部分产品,所以一般都需要加水进行顶洗,达到提高产品收率的目的,减少产品的流失。而具体的顶洗水量,要根据发酵液及产品的性质以及工艺的要求等综合因素来考虑。本试验对顶洗的水量与产品的收率做了考察,实验结果如表1及图4。其中:产品收率=(膜过滤后滤液D-核糖含量×滤液体积)/(膜过滤前发酵D-核糖含量×料液体积)×100%;顶洗水倍数=加水量(L)/过滤60 min后剩余料液量(L)。

表1 顶洗水倍数的变化对D-核糖含量以及产品收率的影响Table 1 Effect of washing water multiples variation on the content of D-ribose and product yield

图4 顶洗水倍数对产品收率的影响Fig.4 Effect of washing multiples on the product yield
开始加水顶洗的时间控制是剩余浓缩液的量越少越好,这时所需要的顶洗水量较少。一般有两种判断加水时间的方法:一是浓缩到一定程度时,通量下降非常明显,这时需要加水提高通量;二是浓缩到一定的浓缩倍数后,就开始加水。本试验采取第一种判断加水时间的方法,根据2.1中陶瓷膜对D-核糖发酵料液渗透性的实验结果,在陶瓷膜过滤60 min后,采用流加的方法进行加水顶洗。从图4可以看出,随着顶洗水的增加,产品收率也在不断提高。但在顶洗水倍数达到0.5倍之后,提取收率趋于稳定,收率可达98%以上。
2.4 不同预处理方式对产品收率的影响
目前,D-核糖工业化生产过程中通常采用的发酵液预处理方法有:板框过滤、转鼓过滤及膜过滤等。本试验通过对板框过滤、转鼓过滤及陶瓷膜过滤3种不同的D-核糖发酵液预处理方式的对比,考察其对发酵液预处理环节D-核糖收率的影响。结果见表2。产品收率=(过滤后滤液D-核糖含量×滤液体积)/(过滤前发酵液D-核糖含量×料液体积)×100%。

表2 不同预处理方法对产品收率的影响Table 2 Effect of different pretreatment methods on the product yield
从表2中可以得出,在板框过滤、转鼓过滤、陶瓷膜过滤3种不同的D-核糖发酵液预处理方式下,陶瓷膜分离方法处理D-核糖发酵液后,产品收率最高,平均收率高达96.02%。这是因为板框过滤及转鼓过滤方式都是属于饼层过滤,即悬浮液在过滤过程中,其中的固型物质沉积于介质表面形成滤饼层,并通过滤饼层真正发挥拦截颗粒的作用。因此不可避免的在滤饼层不断增大的同时,也会逐步附着D-核糖,从而导致在产品收率提升上出现瓶颈。而陶瓷膜过滤利用膜孔隙的选择渗透性,以膜两侧流体压力差为推动力进行固液分离,不产生滤饼层,不存在D-核糖附着的情况发生,极大的提高了产品收率。可见陶瓷膜分离方法比传统的板框及转鼓过滤方法在D-核糖发酵液预处理的应用中更具优势,分离选择性高,能显著提高该阶段的产品收率。
2.5 陶瓷膜的清洗及膜通量的恢复
陶瓷膜在分离料液过程中,水中的微粒、胶体粒子或溶质大分子由于与膜存在物理化学相互作用或机械作用而易引起在膜表面或膜孔内吸附、沉积,从而造成膜孔径变小或堵塞,使膜产生透过流量与分离特性的下降。因此在长时间使用后必须对膜进行清洗,使得膜通量得以恢复。
膜清洗一般是在高流速、低压力条件下进行。由于陶瓷膜具有优异的化学稳定性与高机械强度,可采用广泛的清洗方法进行清洗。本试验采用清水漂洗→碱洗→清水漂洗→酸洗→纯水置换至pH为中性的方式对陶瓷膜进行清洗,可使陶瓷膜通量恢复至新膜通量的90%以上。其中碱洗组成为NaClO 1%~1.5%(V/V)、NaOH 1% ~2%(wt)的混合水溶液,酸洗组成为HNO31% ~2%(wt)的水溶液,纯水为二级反渗透水。
3 结论
(1)D-核糖发酵液在陶瓷膜分离过程中,不加顶洗水的条件下,膜通量随时间变化呈现前期递减、中期稳定、后期递减的现象,整个过程膜的平均渗透通量为219 L/(m2·h)。
(2)膜分离通量随着操作温度的升高而逐渐增大,且在45~55℃温度区间内通量显著提升,工业化应用中可将温度控制在45~55℃。
(3)膜分离过程中随着顶洗水的增加,产品收率也在不断提高;且在顶洗水倍数达到0.5倍后,提取收率趋于稳定,之后增加顶水量对收率的提高甚微。
(4)陶瓷膜分离技术相比传统的板框及转鼓过滤在D-核糖发酵液预处理过程中更具优势,产品收率可达96%以上。
[1] 杨新超,刘建军,赵祥颖.D-核糖的性质、生产及应用[J].中山大学学报(自然科学版),2005,44(增 1):197-202.
[2] 石坡.离子注入D-核糖产生菌的诱变效应及作用机理研究[D].石家庄:河北师范大学,2013:3-8.
[3] Tao S,Rongqiao H.D-ribose,an overlooked player in type 2 diabetes mellitus[J].Science China(Life Sciences),2014,57(3):361.
[4] 魏转,卢伟,石坡,等.离子注入诱变选育D-核糖生产菌株[J].中国食品工业,2014,CFI(8):64-66.
[5] Wulf P D,Vandamma E J.Production of D-ribose by fermentation[J].Applied Microbiology and Biotechnology,1997,48(2):141-148.
[6] 赵丽丽,陈宁,张克旭.代谢工程在D-核糖生产中研究现状及应用前景[J].工业微生物,2002,32(4):42-45.
[7] 高润香.模拟移动床连续离交工艺在D-核糖发酵液净化中的应用[J].生物产业技术,2011,7(4):60-63.
[8] 刘平怀,符健,黄川等.D-核糖对实验性心肌缺血和心律失常的作用研究[J].中国药业,2005,14(10):26-28.
[9] 张文楠,黄险峰,宋国强.1,2,3-三-O-乙酰基-5-脱氧-D-呋喃核糖合成工艺研究[J].常州大学学报(自然科学版),2014,26(4):16-18.
[10] 万响林.降膜式蒸发器在D-核糖浓缩中的应用[J].广东化工,2014,41(9):114.
[11] 廖湘萍,彭其安,王伟平,等.发酵法生产D-核糖的研究进展[J].化学与生物工程,2007,24(3):8-10.
[12] 任鹏飞,彭其安,杨天勇等.D-核糖发酵条件研究[J].生物技术,2008,18(5):75-77.
[13] 魏少军,刘淑云,陈宁,等.D-葡萄糖酸钠对D-核糖发酵的影响[J].天津轻工业学院学报,2002,41(2):4-6.
[14] 张志宏,常景玲.D-核糖发酵条件的优化与中试[J].安徽农业科学,2009,37(22):10 398-10 440.
[15] 彭彦峰.发酵法生产D-核糖参数分析方法和发酵工艺研究[D].河北:河北工业大学,2003:13-19.
[16] 贾秋英,吴兆亮,郑辉杰等.超滤膜过程去除D-核糖发酵液中杂蛋白的工艺研究[J].膜科学与技术,2005,25(4):30-32.
[17] 崔凤霞,任蓓蕾,王敬臣.膜技术在D-核糖提取工艺中的应用研究[J].价值工程,2010,7(8):182-183.
[18] 张津枫,王健刚,邓国才,等.葡萄糖发酵液D-核糖含量的高效液相色谱分析[J].高等学校化学学报,2001,22(1):43-45.
