蚌肉盐溶蛋白提取工艺优化及其功能特性研究*
2015-12-25王伯华雷颂刘玉娇李梅杨品红
王伯华,雷颂,刘玉娇,李梅,杨品红
(湖南文理学院生命科学学院,水产高效健康生产湖南省协同创新中心,环洞庭湖水产健康养殖及加工湖南省重点实验室,湖南常德,415000)
河蚌,又名河歪、河蛤蜊等,属软体动物门瓣鳃纲蚌科,是一种普通的贝壳类水生动物。据《本草纲目》记载,河蚌肉对人体有清热解毒、滋阴平肝、明目防眼疾等保健功效。我国河蚌资源十分丰富,但蚌肉的精深加工尚未形成规模,尤其是珍珠采收后的蚌肉大部分未能进一步加工而当作废料处理,不仅造成资源浪费,而且严重污染生态环境。市场上由河蚌副产物生产的产品,多为粗加工、低技术含量的饲料和肥料及工艺制品,并且供求已接近饱和,而高技术附加值的产品尚未在市场形成规模。
蚌肉可作为一种蛋白质生产原料,也可为酶解河蚌蛋白制备具有生理功能的肽类提供物质基础[1]。蛋白质的功能特性指的是乳化、黏结、凝胶作用等在食品中起着重要作用的物理化学性质。其对食品的感官质量及质地结构均有较大影响[2]。贝类肌原纤维蛋白质在加工特性上与其他肌肉肌原纤维蛋白类似,其热诱导凝胶性能影响着肉糜制品的黏着力、保水性、弹性、质构等产品品质[3]。有研究表明,仅0.5%的肌原纤维蛋白经热诱导就足以产生凝胶,而其他蛋白质含量须达10%左右时才能形成凝胶[4]。
1 材料与方法
1.1 实验材料
河蚌肉:购买体长约80~100 mm的新鲜三角帆蚌,将其剖开,取出外套膜和蚌肉,用4℃冰水清洗3次后置于豆浆机中绞碎,碎肉装入样品袋中于-18℃条件下贮存备用。
新鲜猪肉、白砂糖、食盐、大豆油、味精、鸡蛋、香辛料,市售;牛血清白蛋白,Sigma公司;PVDC肠衣,河北雄县鸿达包装制品有限公司;小麦蛋白,浚县天龙面业有限公司;大豆蛋白,谷神生物科技股份集团有限公司;玉米变性淀粉,长春大华淀粉有限公司;卡拉胶,青岛德慧海洋生物科技有限公司。
1.2 主要试剂
NaOH、NaCl、KI、无水 CuSO4、酒石酸钾钠、H2SO4、HCl等,购自天津市科密欧化学试剂有限公司,均为分析纯。
1.3 仪器设备
A-88组织捣碎匀浆机,江苏省金坛市医疗仪器厂;ZB20斩拌机,嘉信食品机械有限公司;S-25数显pH计,上海精密科学仪器有限公司;AL204电子分析天平,梅特勒-托丽多仪器有限公司;LD4-2A低速离心机,北京医用离心机厂;721可见光分光光度计,上海舜宇恒平科学仪器有限公司;DZF-6050真空干燥箱,金坛市荣华仪器制造有限公司;FW100万能粉碎机,天津市泰斯特仪器有限公司;HH-S4恒温水浴锅,北京科伟永兴仪器有限公司;BCD-265CMX冰箱,合肥美的荣事达冰箱有限公司。
1.4 蚌肉盐溶性蛋白的提取方法
将冷冻河蚌肉在4℃下解冻,加入4倍质量0~4℃的蒸馏水,用高速组织捣碎匀浆机进行匀浆处理(6 000 r/min,5 min)。再转入离心管中,离心(3 000 r/min,10 min),去除上清液,重复1次,向沉淀中加入不同提取条件的NaCl溶液,充分搅匀在4℃ 静置20 h后,取出匀浆液,再经(4 000 r/min,30 min)离心后所得上层溶液即为盐溶蛋白质溶液[5]。
1.5 蛋白质含量的测定
采用双缩脲法进行蛋白质含量的测定。
1.6 蚌肉盐溶蛋白提取工艺的优化
1.6.1 单因素试验
盐浓度对盐溶蛋白得率的影响,取盐浓度(mol/L)为0.4、0.5、0.6、0.7、0.8 五个梯度进行试验;固液比对盐溶蛋白得率的影响,取固液比为1∶2、1∶3、1∶4、1∶5、1∶6 五个梯度进行试验;浸提时间对盐溶蛋白得率的影响,取浸提时间(h)为 8、12、16、20、24 五个梯度进行试验;浸提pH对盐溶蛋白得率的影响,取浸提 pH 值为4.0、5.0、6.0、7.0、8.0 五个梯度进行试验。
1.6.2 正交试验确定最佳提取条件
根据单因素试验结果,选取盐浓度、固液比、浸提pH、浸提时间四项主要影响因素作为考察因素,依据L9(34)正交试验表进行4因素3水平正交试验,以确定提取蚌肉盐溶蛋白的最佳工艺参数。

表1 正交试验因素水平Table 1 Factors and levels for the orthogonal test
1.7 蚌肉盐溶性蛋白功能特性的研究方法
1.7.1 溶解性的测定方法
配制2.5 g/100 mL蚌肉盐溶性蛋白样品溶液各20 mL,分别调节 pH 值至 4、5、6、7、8、9,室温振荡 40 min后,以4 000 r/min离心分离30 min,测定上清液中蛋白质含量,用上清液中蛋白质量占样品中总蛋白质量的百分比表示溶解度[6]。
1.7.2 持水性(WA)的测定方法
称取0.5 g蚌肉盐溶性蛋白样品置于50 mL离心管中,加入5 mL蒸馏水使样品完全浸湿,充分混匀1 min后,在室温下静置30 min,于2 100 r/min离心10 min。离心后,去除上清液,称重。若没有上清液,则应继续加水、混匀、再离心,至离心后有少量上清液为止。按下式计算持水性[7]。

式中:m,样品质量,g;m1,离心管和样品质量,g;m2,离心管和沉淀物质量,g
1.7.3 持油性(FA)的测定方法
称取0.5 g蚌肉盐溶性蛋白样品置于50 mL离心管中,加入5 mL大豆油混匀1 min后,在室温下静置30 min,于3 000 r/min离心20 min,吸去上层油后称重。按下式计算持油性[7]。
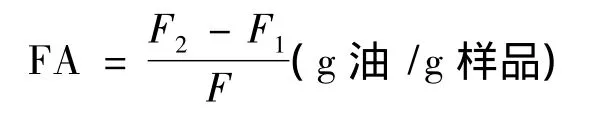
式中:F,样品重量,g;F1,离心管和样品质量,g;F2,离心管和沉淀物质量,g
1.7.4 起泡能力(FC)及泡沫稳定性(FS)的测定方法
100 mL不同浓度样品溶液,搅拌20 min后调节pH值,转入匀浆机高速(10 000 r/min)搅打2 min后,迅速转入500 mL量筒,读取泡沫体积(V0)。静置30 min后,读取泡沫体积(Vr),按下式计算起泡能力和泡沫稳定性[6]。
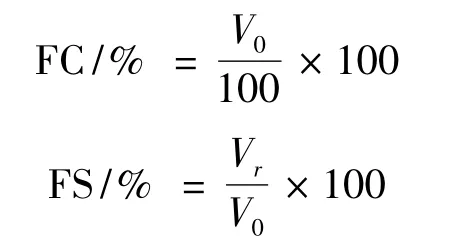
1.7.5 乳化能力(EC)及乳化稳定性(ES)的测定方法
取25 mL不同浓度样品溶液匀浆30 s,加入25 mL大豆油并搅匀,继续匀浆2 min后转入刻度离心管,以3 000 r/min离心10 min,记录体积。另取同法制得混合液于80℃保温40 min,冷却至室温后离心,记录体积。按下式计算乳化能力和乳化稳定性[6-7]。

1.7.6 凝胶形成与保水性测定方法
将盐溶蛋白溶液置于干净离心管中,然后于水浴锅中加热,从20℃ 缓慢升温到70℃(1℃/min),并在设定温度下恒温5 min,形成的凝胶用自来水冷却30 min,置于4℃下保存24 h,然后测定保水性。
凝胶保水性的测定:先称离心管质量m,将盐溶蛋白放在离心管中制备凝胶,在4℃下保存24 h,称离心管和蛋白质量m1,然后将凝胶在1 000 r/min、4℃下离心10 min,称倾去水分后的管和凝胶的质量m2,按下式计算凝胶保水性[8]。

1.8 蚌肉盐溶性蛋白在西式香肠中的初步应用
1.8.1 工艺流程

1.8.2 西式香肠配方及操作要点
参照周光宏[8]的西式香肠配方及操作要点进行试验。
1.8.3 产品的感官评价
用蚌肉盐溶蛋白替代原大豆蛋白,添加到西式香肠配方中,将其与添加大豆蛋白制成的西式香肠进行比较。感官评价小组由20人组成,分别从形态色泽、内部结构、香气滋味、弹性、折曲性试验五个方面对西式香肠进行评价。具体评分标准见表2。

表2 西式香肠感官评定标准Table 2 Criteria for sensory analysis of western sausage
2 结果与讨论
2.1 蛋白质含量标准曲线
如图1所示,双缩脲法测定盐溶蛋白含量的标准曲线为y=0.079 4x+0.000 6,其 R2=0.999 9,具有较好的拟合度,可用于后续试验。
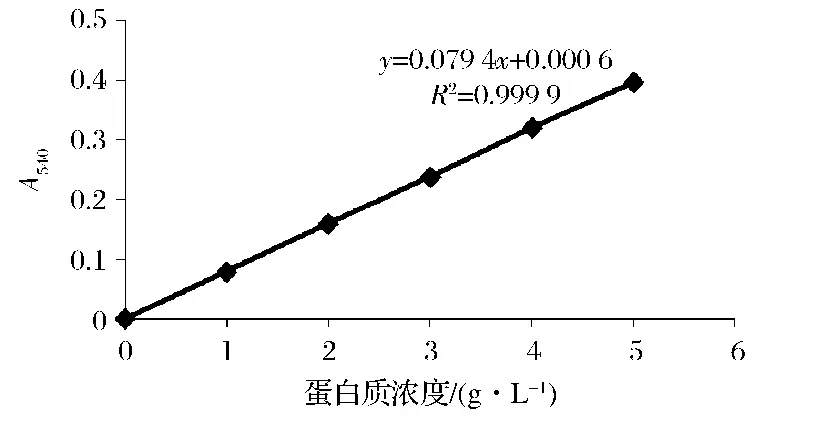
图1 蛋白质含量标准曲线Fig.1 Protein content standard curve
2.2 盐溶蛋白提取单因素试验
2.2.1 盐溶液浓度对提取盐溶蛋白的影响
在提取时间(20 h)、固液比(1∶4)、pH 7.4的条件下,用不同浓度的NaCl溶液提取盐溶蛋白,结果如图2所示。NaC1浓度在0.4~0.5 mol/L内,蛋白得率随盐浓度的增加而增加,说明在这个范围内较高的盐溶度能提高盐溶蛋白的浸出率;盐浓度在0.5~0.8 mol/L内,蛋白得率随盐浓度的增加而趋于减少,说明在这个范围内过高的盐浓度反而抑制了盐溶蛋白的析出;NaC1浓度为0.5 mol/L时提取率最高。也有研究表明,虽然高浓度的盐溶液可以提高蛋白的提取率,但是当盐溶度高于0.7 mol/L时,热凝时蛋白会形成较粗糙的凝胶,降低凝胶浓度[9-10]。

图2 盐浓度对盐溶蛋白提取量的影响Fig.2 Effects of salt concentration on salt soluble protein yield
2.2.2 固液比对提取盐溶蛋白的影响
在盐浓度0.5 mol/L、浸提时间20 h、浸提 pH 7.4的条件下,采用不同固液比提取盐溶蛋白。由图3可看出,提取液的蛋白总量在固液比1∶2~1∶4之间增幅显著,1∶4~1∶6时则相对缓慢,说明在固液比为1∶4时,盐溶蛋白已经能够较好的浸出。因此,在要求提取液的盐溶蛋白浓度和浓度总量尽可能高的情况下选用固液比1∶4进行后续试验。
2.2.3 浸提时间对提取盐溶蛋白的影响
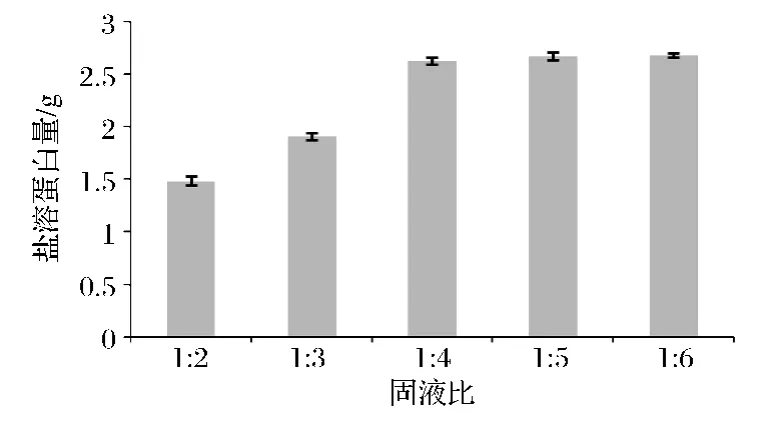
图3 固液比对盐溶蛋白提取量的影响Fig.3 Effects of solid-liquid ratio onsalt soluble protein yield
在NaC1浓度为0.5 mol/L、固液比1∶4、提取 pH 7.4的条件下,考察了不同提取时间对盐溶蛋白提取量的影响。由图4可知,在8~20 h时,随着提取时间的延长,盐溶蛋白提取量增加,而20 h后,蛋白质得率增加幅度缓慢。这是因为提取时间达到20 h后,可溶于NaCl溶液的蛋白几乎全部溶出。考虑到提取时间过长可能会使部分蛋白变性,不利于后期试验,而且长时间提取也会增大提取成本,所以选择提取时间为20 h进行后续试验。
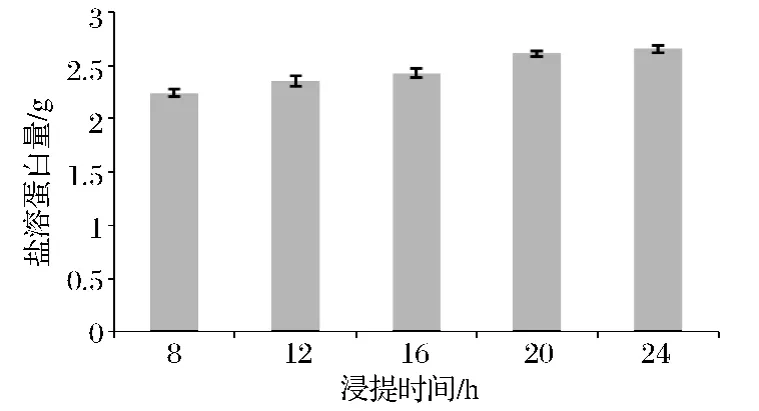
图4 浸提时间对盐溶蛋白提取量的影响Fig.4 Effects of extraction time onsalt soluble protein yield
2.2.4 pH值对盐溶蛋白提取的影响
在 NaCl浓度 0.5 mol/L、固液比 1∶4、提取时间为20 h的条件下,考察了不同pH对盐溶蛋白提取的影响。由图5可知,pH值为5时,提取的盐溶蛋白含量最少,主要是因为肌原纤维蛋白的等电点在pH 5附近,蛋白质发生沉淀,影响了盐溶蛋白提取量。随着pH值的升高,肌原纤维蛋白所带的同种电荷增多,由于同种电荷的相互排斥作用,使其更易在较高离子强度下溶解析出[11],在pH值为8时,盐溶蛋白含量达到最大。
2.3 盐溶蛋白提取正交试验结果与分析
通过正交试验确定最佳盐溶蛋白提取工艺条件,根据极差R的大小进行因素的水平变化对试验影响的主次排序。R越大,表示该因素的水平变化对试验影响越大。反之,R越小,则该因素的水平变化对试验影响越小。通过表3可知,蚌肉盐溶蛋白提取的最佳工艺条件为A3B2C2D3,即提取液中NaCl浓度为0.7 mol/L、固液比为1∶4、pH值为7、浸提时间为24 h。4个因素中,对试验的影响大小顺序为A>B>C>D,表明盐浓度对试验的值影响最大,其次为固液比和pH值,浸提时间对试验的影响最小。

图5 pH对盐溶蛋白提取量的影响Fig.5 Effects of pH onsalt soluble protein yield
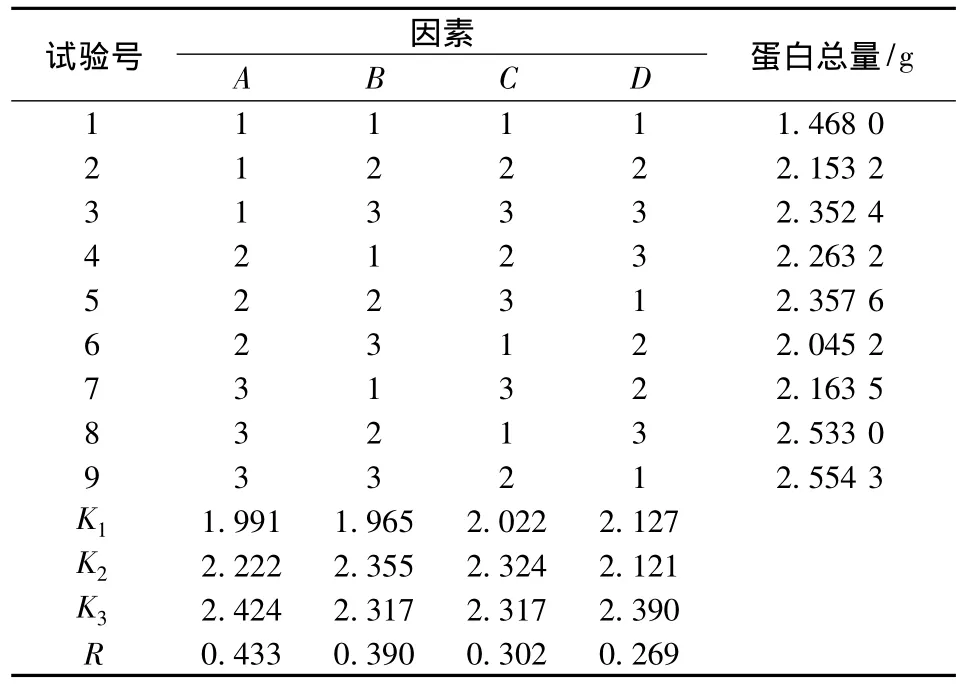
表3 正交试验表Table 3 Results of the orthogonal test
极差分析法是一种初步的分析法,不能估计试验误差的大小,也不能区分数据的波动是由因素水平变化引起的还是由试验误差引起,因此在极差分析的基础上,对数据作了进一步的方差分析,这样找到的最佳提取条件较单用正交试验分析更准确[12]。从正交试验及方差分析结果来看,两者一致显示蚌肉盐溶蛋白最佳提取工艺条件为:盐浓度0.7 mol/L、固液比1∶4,pH值7、浸提时间24 h。因试验所选取的因素水平已经过了单因素试验的优化,方差分析亦显示因素各水平间差异不显著。
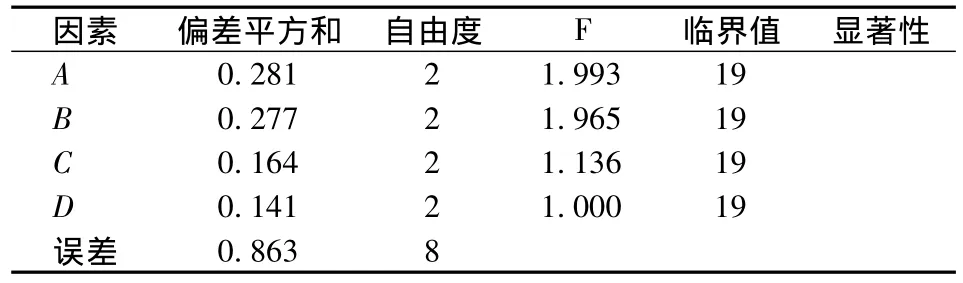
表4 正交试验方差分析表Table 4 Variety analysis of the results
虽然正交设计的试验点不一定包括了全面实验的最优实验组合,但是通过对正交试验的分析能找出试验点以外的最优处理组合。因本试验中找出的最优水平组合A3B2C2D3并未出现在正交表中,因此重新按最佳组合进行试验。测得在此最佳条件下盐溶蛋白提取量为2.925 g,大于组合A3B3C2D1,与正交表结果相符。
2.4 蚌肉盐溶性蛋白的功能特性
2.4.1 溶解性
蛋白质的溶解性是指蛋白质分子和水分子之间产生相互作用的综合结果[8]。蛋白质的一些功能特性,如增稠、起泡、乳化和凝胶等特性均与溶解性有关[3]。pH值对蚌肉盐溶蛋白溶解性的影响如图6所示。

图6 pH值对蚌肉盐溶蛋白和大豆蛋白溶解性的影响Fig.6 Effects of pH on solubility of mussel meat salt soluble protein and soybean protein
随着pH值的增加,蚌肉盐溶蛋白和大豆蛋白的溶解性均有所增加,且大豆蛋白的溶解性增加幅度大于蚌肉盐溶蛋白。可见,大豆蛋白溶解性优于蚌肉盐溶蛋白。由于肉糜和重组肉制品中的凝胶、乳化、保水性作用就是溶解了的蛋白质和肉的各种成分相互作用的结果。因此,蛋白质的溶解性在肉的加工中有特殊的重要性[13]。在肉糜制品加工配方中应充分考虑蚌肉盐溶性蛋白的溶解性,使其具有更好的功能特性。
2.4.2 持水性(WA)和持油性(FA)
蛋白质的持水性是指将一定浓度的蛋白质水溶液离心,其中残留的水分含量[9]。蛋白质的持油性是指蛋白质对游离脂肪的结合和保持能力,能改善食品的口感和风味[6]。蚌肉盐溶蛋白和大豆蛋白的持水性和持油性的比较如图7所示。蚌肉盐溶蛋白的持水性为3.0 g/g,蛋白质结合的水分子较多,说明蚌肉盐溶蛋白分子表面的亲水基团较多;其持油性为2.2 g/g,与大豆蛋白相比有更强的持油性,说明蚌肉盐溶蛋白表面的亲脂基团与脂类的结合能力更大[6]。肉糜制品加工中,水可以促进蛋白质与较强极性的风味物质结合,脂类的存在有助于羰基风味物结合能力的增加[4]。蚌肉盐溶蛋白较高的持水性和持油性特征有利于肉糜制品风味的形成。

图7 蚌肉盐溶蛋白和大豆蛋白的持水性和持油性的比较Fig.7 Comparison of WA and FA between mussel meat salt soluble protein and soybean protein
2.4.3 起泡能力(FC)及泡沫稳定性(FS)
起泡性质通常是指蛋白质在气液界面形成坚韧的薄膜,使气体进入并维持一定稳定状态的能力[14-15]。蛋白浓度对蚌肉盐溶蛋白和大豆蛋白FC和FS的影响如图8和图9所示。

图8 蛋白浓度对蚌肉盐溶蛋白和大豆蛋白起泡能力的影响Fig.8 Effect of protein concentration on FC of mussel meat salt soluble protein and soybean protein

图9 蛋白浓度对蚌肉盐溶蛋白和大豆蛋白泡沫稳定性的影响Fig.9 Effect of protein concentration on FS of mussel meat salt soluble protein and soybean protein
蚌肉盐溶蛋白质的起泡能力随蛋白浓度的变化不明显,在蛋白浓度为0.6%时最高,0.2% ~0.6%随蛋白浓度的增加起泡能力增强;而蚌肉盐溶蛋白的泡沫稳定性在0.2%~0.6%随蛋白浓度的增加而减弱。与大豆蛋白相比,蚌肉盐溶蛋白的起泡能力稍低,而泡沫稳定性更高。
2.4.4 乳化能力(EC)及乳化稳定性(ES)
影响蛋白质乳化性质的因素有很多,如pH、温度、蛋白质类型和离子强度等内在因素;制备乳液的设备情况和乳化剪切速度等外在因素[16-17]。蛋白浓度对蚌肉盐溶蛋白和大豆蛋白EC和ES的影响如图10和图11所示。蛋白浓度变化对蚌肉盐溶蛋白和大豆蛋白的乳化能力影响不大,蚌肉盐溶蛋白在浓度为0.4%时乳化能力最佳,整体而言蚌肉盐溶蛋白的乳化能力优于大豆蛋白。蚌肉盐溶蛋白和大豆蛋白在不同的蛋白浓度下都表现出良好的乳化稳定性。肉糜中蛋白质基质的形成能固定自由水,减少热处理时水分的丢失,从而稳定成品结构。蛋白质基质还能包裹固定住肉糜中的脂肪颗粒,防止其在加热时融化流失[13]。可见蚌肉盐溶性蛋白良好的乳化能力和乳化稳定性对肉制品加工极其重要。

图10 蛋白浓度对蚌肉盐溶蛋白和大豆蛋白乳化能力的影响Fig.10 Effect of protein concentration on EC of mussel meat salt soluble protein and soybean protein
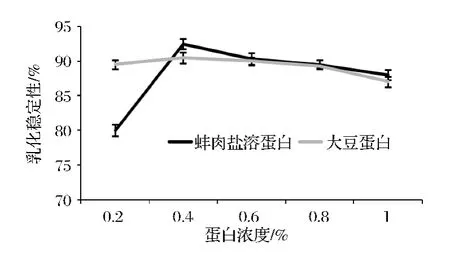
图11 蛋白浓度对蚌肉盐溶蛋白和大豆蛋白乳化稳定性的影响Fig.11 Effect of protein concentration on ES of mussel meat salt soluble protein and soybean protein
2.4.5 凝胶保水性(WHC)
蛋白浓度对蚌肉盐溶蛋白和大豆蛋白凝胶保水性的影响如图12所示。随着蛋白浓度的增加,蚌肉盐溶蛋白质和大豆蛋白质凝胶保水性均上升,但蛋白浓度低于1.0%时,蚌肉盐溶蛋白的凝胶保水性不如大豆蛋白。凝胶可以黏附肉糊制品中的肉颗粒,形成三维空间网络来稳定乳化的脂肪团粒,且能够捕获风味物质和其他成分,还可形成复杂的毛细管系统来保持水[18-19]。可见蛋白凝胶和一系列肉制品的质量特征有关[3]。因此,当蚌肉盐溶蛋白应用于肉糜制品时,应注意其使用量,也可以添加部分高凝胶强度的蛋白质或其他添加剂来保证肉制品的风味及质地。

图12 蛋白浓度对蚌肉盐溶蛋白和大豆蛋白凝胶保水性的影响Fig.12 Effect of protein concentration on WHC of mussel salt soluble protein and soybean protein
2.5 蚌肉盐溶蛋白在西式香肠中的初步应用
尝试将蚌肉盐溶蛋白替代大豆蛋白制备西式香肠,将两者进行感官评价。蚌肉盐溶蛋白西式香肠平均得分为89分,大豆蛋白西式香肠为92分,说明两者在形态色泽、香气滋味、弹性等方面均无较大差异。初步可知,蚌肉盐溶蛋白添加到西式香肠中替代大豆蛋白是可行的。
3 结论
各因素对蚌肉盐溶蛋白提取量的影响程度依次是NaCl浓度>料液比>pH>浸提时间,确定了蚌肉盐溶蛋白质提取的最佳工艺条件为NaCl浓度0.7 mol/L,提取时间 24 h,固液比 1∶4,提取液 pH值7。在此条件下,提取盐溶蛋白量最大为117 mg/g。对蚌肉盐溶蛋白功能特性的研究表明,与大豆蛋白相比,蚌肉盐溶蛋白的持水性、持油性较高,溶解性和凝胶保水性稍低,而乳化性、乳化稳定性、起泡性、泡沫稳定性相差不大。总体而言,蚌肉盐溶蛋白具有良好的功能特性。将其替代大豆蛋白制作西式香肠,在形态色泽、风味、弹性等方面均无明显差异。
[1] 张缓,姜启兴,许艳顺,等.采珠后河蚌副产物的营养成分分析及评价[J].食品工业科技,2012,33(19):346-349.
[2] 刘邻渭.食品化学[M].郑州:郑州大学出版社,2011,9.
[3] 周光宏.肉品加工学[M].北京:中国农业出版社,2008,7.
[4] 万建荣,洪玉清.鱼肉肌肉蛋白质的制备.水产食品化学分析手册[M].上海:上海科学技术出版社,1993.
[5] 蓝尉冰,毛伟杰,池岸英,等.凡纳滨对虾肌肉盐溶蛋白提取工艺研究[J].现代食品科2012,28(3):312-315.
[6] 黄光荣,沈莲清,王向阳,等.茶叶蛋白质功能性质及其在肉制品中的应用研究[J].食品工程,2008(1):42-45.
[7] 郭荣荣.甜荞蛋白质组分功能特性评价及对火腿肠质构特性的影响研究[D].武汉:华中农业大学,2007.
[8] 于巍,周坚.草鱼盐溶蛋白保水性及流变性质的研究[J].食品与发酵工业,2008,33(10):72-75.
[9] 彭增起,周光宏,徐幸莲,等.多聚磷酸盐对牛背最长肌盐溶蛋白热诱导凝胶保水性和超微结构的影响[J].食品科学,2003,24(5):68-71.
[10] 李梳杰,王继伟,赵冬梅.对磷酸盐增强肉保水性机理的探讨[J].肉类工业,1993(10):29-34.
[11] 罗永康,潘道东,沈彗星,等.蛋白质浓度、pH、离子强度对鲢鱼肌原纤维蛋白粘度的影响[J],食品与发酵工业,2004,30(7):52-54.
[12] 明道绪.生物统计附试验设计[M].北京:中国农业出版社,2007,12.
[13] 董哲,马云,王素雅,等.草鱼盐溶蛋白溶解性的研究[J].食品与机械,2011,(1):91-93.
[14] 蓝伟斌,毛伟杰,迟安英,等.凡纳滨对虾肌肉盐溶蛋白提取工艺研究[J].现代食品科学,2012,28(3):312-315.
[15] 崔莉,葛文光.核桃蛋白质功能性质的研究[J].食品科学,2000,21(1):13-16.
[16] LIU C,WANG X,MA H,et al.Functional properties of protein isolates from soybeans stored under various conditions[J].Food chemistry,2008,111(1):29-37.
[17] Denavi G A,Pérez-Mateos M,Añón M C,et al.Structural and functional properties of soy protein isolate and cod gelatin blend films[J].Food Hydrocolloids,2009,23(8):2094-2101.
[18] Ionescu A,Aprodu I,Darabǎ A,et al.The effects of transglutaminase on the functional properties of the myofibrillar protein concentrate obtained from beef heart[J].Meat science,2008,79(2):278-284.
[19] 高彦祥.食品添加剂[M].北京:中国轻工业出版社,2011,5.
