温度对“半胱氨酸-木糖”模型体系初始美拉德中间体及挥发性风味物质形成的影响*
2015-12-25曹长春石景艳谢建春孙宝国
曹长春,石景艳,谢建春,孙宝国
(食品质量与安全北京实验室,北京市食品风味化学重点实验室,北京工商大学,北京,100048)
美拉德反应又称“羰-氨”反应,是食品热加工风味形成的重要途径之一。半胱氨酸是肉香味形成的重要前体,有关半胱氨酸与还原糖发生美拉德反应产生肉香味的研究已有较多报道[1-6]。Hofmann 等[5]分析鉴定了半胱氨酸分别与葡萄糖和鼠李糖反应产生的肉香味成分;Cerny等[6]将半胱氨酸与同位素标记的核糖反应,研究了肉香味成分的形成途径。
与其他氨基酸不同,半胱氨酸因含有巯基官能团,在Maillard初级反应阶段除形成半胱氨酸Amadori重排物外,还可形成2-糖基噻唑烷-4-羧酸中间体[7-8]。初级阶段形成的该中间体往往占有很大比例,对美拉德反应有抑制作用。有报道[9-10]半胱氨酸的存在可抑制大豆蛋白酶解液、苹果汁和葡萄汁等的非酶褐变。但2-糖基噻唑烷-4-羧酸与半胱氨酸Amadori重排物存在可逆转化,在受热条件下,半胱氨酸Amadori发生降解反应,从而导致可逆平衡被打破,使形成的2-糖基噻唑烷-4-羧酸中间体不断转化成半胱氨酸Amadori。半胱氨酸Amadori的受热降解反应,涉及了经1,2-烯醇化或2,3-烯醇化及脱水、脱氨等过程形成糠醛、羟甲基糠醛、呋喃酮、二羰基化合物等降解产物。这些与还原糖相关的降解产物再与半胱氨酸降解产生的硫化氢或氨作用,可形成2-甲基-3-呋喃硫醇、2-糠硫醇、2-甲基噻吩、3-甲基吡嗪等含硫化合物或杂环化合物,从而使热反应产物出现似肉的香味[6,11-13]。
温度对美拉德反应有重要影响,不同温度下美拉德反应初始中间体Amadori的形成速率和积累量不同,产物的挥发性风味和颜色不同[14-16]。在原料组成和pH值等其他条件固定时,温度越高,Amadori的降解速率越快,促使2-糖基噻唑烷-4-羧酸中间体转化成半胱氨酸Amadori的速率也越快,从而半胱氨酸消耗得越多,利用率越高。本文以“半胱氨酸-木糖”为模型,研究了不同温度下,体系中形成的初始美拉德中间体2-木糖基噻唑烷-4-羧酸(2-xylulosylthiazolidine-4-carboxylic acid,XTCA)、半胱氨酸 Amadori的含量及半胱氨酸的含量随反应时间的变化及温度对挥发性风味物质形成的影响。
1 材料与方法
1.1 仪器与设备
15 mL耐压密封管,北京欣维尔玻璃仪器有限公司;手动固相微萃取手柄、75 μm Carboxen/PDMS萃取纤维、15 mL样品瓶及聚丙烯瓶盖、聚四氟乙烯-硅树脂隔膜,美国Supelco公司。
PHSJ-5型pH计,上海仪电科学仪器股份有限公司;OSB-200油浴型旋转蒸发仪,日本Eyela公司;DF-101型集热式恒温加热磁力搅拌器,河南巩义市予华仪器有限公司;Agilent1100高效液相色谱仪,美国Agilent公司;SEDEX75蒸发光散射检测器(ELSD),法国SEDERE公司;XWK-Ⅲ无油空气泵,天津市华生分析仪器厂;7890A/5975C型气相色谱-质谱联用仪,美国Agilent公司。
1.2 试剂与材料
L-半胱氨酸、D-(+)-木糖,生化试剂,国药集团北京化学试剂有限公司;二水合磷酸二氢钠、甲酸铵、甲酸,均为分析纯,国药集团北京化学试剂有限公司;NaOH,分析纯,天津市光复科技发展有限公司;1,2-邻二氯苯,分析纯,北京化学试剂公司;C7~C30正构烷烃、色谱纯乙腈,迪马科技有限公司;AG 50W-X4 H-型阳离子交换树脂(200~400目),美国 Bio-Rad公司。
1.3 实验方法
1.3.1 模型反应
在15 mL耐压密封管中,加入 L-半胱氨酸1 mmol(0.121 g)、D-(+)-木糖 1 mmol(0.150 g),NaH2PO4-NaOH缓冲溶液(0.2 mol/L,pH=5.5)5 mL,油浴加热。
(1)分别在温度 120、130、140、150、160 ℃下,反应90 min,并每隔10 min取样,按1.3.2进行固相萃取/高效液相色谱分析,研究温度对美拉德反应初始中间体形成及半胱氨酸利用率的影响。平行做3份样品。
(2)分别在温度 120、130、140、150、160 ℃下,反应60 min,按1.3.3固相微萃取/气-质联机分析,比较不同温度下产生的挥发性风味物质。平行做3份样品。
1.3.2 固相萃取/高效液相色谱分析
固相萃取柱,填料为阳离子交换树脂,800 mg/1.5 mL,实验室手动填装。先用6 mL 1 mol/L HCl活化,再将1.3.1(1)中所取反应液上样1 mL,10 mL水洗,6~8 mL 0.5 mol/L氨水溶液洗脱,收集氨水洗脱液,旋转蒸发浓缩至约1.5 mL,定容至2 mL,0.45 μm滤膜过滤,待高效液相色谱分析。
高效液相色谱分析条件:Waters Xbridge Amide(4.6 mm × 150 mm,3.5 μm)色谱柱;流动相:0.02 mol/L甲酸铵与乙腈(体积比=4∶6)的混合溶液,用0.02%甲酸调至pH 6;流速:0.5 mL/min;进样1 μL,共运行11 min。柱温25℃。蒸发光散射检测器检测,蒸发管温度40℃,雾化气(空气)流速3.5 bar,增益值5。
1.3.3 固相微萃取/气-质联机分析
萃取纤维按照使用说明事先老化。将1.3.1(2)制备的反应液转移到15 mL固相微萃取样品瓶中,加入1.5 μL 内标邻二氯苯(200 μg/mL,溶剂甲醇)、约1 g NaCl,混合均匀,水浴加热至60℃平衡10 min后,60℃顶空吸附30 min。
气相色谱-质谱分析:(1)色谱柱DB-WAX(30 m×0.25 mm×0.25 μm),温度40 ℃,以4 ℃/min升至230℃;(2)色谱柱HP-5MS(30 m×0.25 mm×0.25 μm),温度40℃,以3℃/min升至180℃,再以20℃/min升至280℃,保持2 min。载气为He,流速1.0 mL/min,进样口温度250℃,不分流进样,萃取纤维脱附5 min。电子轰击离子源(EI),能量70 eV,离子源温度230℃,四级杆温度150℃。
在相同条件下进样C7~C30正构烷烃,计算保留指数。
所检测化合物含量计算见公式(1):

式中:m为鉴定化合物质量,ng,A为化合物峰面积;ρ 为内标 1,2-二氯苯质量浓度,200 μg/mL;A0为内标面积,V为加入的内标 1,2-二氯苯体积,1.5 μL。
2 结果与讨论
2.1 固相萃取/高效液相色谱分析
图1为温度为140℃时模型反应20 min取样经固相萃取处理后,高效液相色谱-蒸发光散射检测器(HPLC-ELSD)分析所得谱图。

图1 140℃时“半胱氨酸-木糖”反应20 min取样的固相萃取/高效液相色谱分析谱图Fig.1 The HPLC-ELSD chromatogram in the analysis of the reaction mixture of cysteine with xylose for 20 min at 140℃after pretreated by solid phase extraction
标号1的峰为半胱氨酸的峰;标号2的峰为XTCA的峰,标号3的峰为半胱氨酸-Amadori的峰,3种物质分离较好。ELSD是20世纪90年代出现的一种通用性质量型检测器,能检测挥发性低于流动相的样品,其响应不依赖于被分析物质的理化性质,具有灵敏度高、受温度等实验条件影响小和线性范围宽等优点[17],因而本文采用ELSD检测定量研究和比较反应体系中的XTCA、半胱氨酸-Amadori及半胱氨酸的含量受温度的影响。
2.2 XTCA、半胱氨酸Amadori及半胱氨酸的含量随时间变化
在不同温度下进行模型反应实验,按10 min间隔取样,分析体系内初始中间体 XTCA、半胱氨酸Amadori及半胱氨酸的含量,分别绘制XTCA、半胱氨酸Amadori的含量(峰面积)、半胱氨酸的含量(占初始面积的百分比)随反应时间变化曲线,见图2。
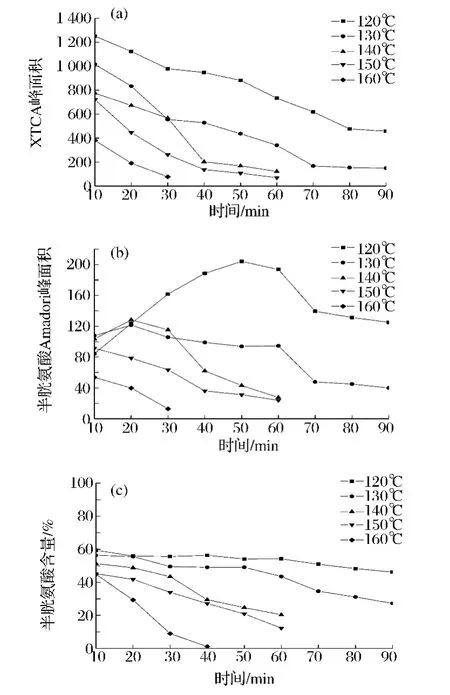
图2 不同温度下XTCA(a)、半胱氨酸-Amadori(b)及半胱氨酸(c)的含量随反应时间的变化曲线Fig.2 The change curves of the contents of XTCA,cysteine-Amadori,and cysteine,respectively,with times under different reaction temperatures
实验中发现,弱酸性条件下美拉德反应初始中间体XTCA非常易于形成,室温下即检测到可观量的XTCA。由图2可知,从120~160℃,反应开始10min时,体系内已有大量XTCA,且XTCA含量远高于半胱氨酸Amadori含量。随着反应时间的进行,XTCA仍在生成,但因不断转化成半胱氨酸Amadori,因此在各温度下其含量均呈下降趋势,且温度越高下降得越快。而半胱氨酸Amadori的积累量在各温度下呈现的变化趋势不同:120、130、140℃呈现钟形曲线,分别在50、20、20 min达到极值,然后慢慢下降,其中130℃反应90 min时和140℃反应60 min时已很少,但120℃反应90 min时仍有较多剩余;150、160℃半胱氨酸Amadori的含量则一直呈陡峭的下降趋势,分别在60,30 min时已很少。
相比之下,温度越低半胱氨酸Amadori的降解速率越慢,体系内XTCA及半胱氨酸Amadori的积累量就越多,表现为相同时间下120℃时检测到的XTCA及半胱氨酸Amadori的含量在各温度中均最高,且含量的下降趋势最平缓。由于半胱氨酸Amadori的含量是XTCA的转化(使其增加)及半胱氨酸Amadori降解(使其减少)两方面综合作用后的结果,因而在较低温度时(120,130,140℃)半胱氨酸 Amadori出现极值,在较高温度时(150,160℃)因降解速率大于生成速率一直呈现下降趋势。
此外,由图2半胱氨酸的含量下降趋势曲线还可以看出,温度越高,反应越快,半胱氨酸消耗越快。在160℃下反应40 min半胱氨酸几乎消耗完,140℃下反应60 min剩余20.3%,而在温度120℃反应90 min时半胱氨酸仍有较多剩余,为46.2%。
2.3 不同温度下所得反应产物的颜色、气味及挥发性成分比较
相同时间下,反应温度不同,体系内XTCA、Amadori的积累量及半胱氨酸的消耗量不同,产生的挥发性化合物种类及含量不同。在 120、130、140、150、160℃下分别反应60 min,所得反应产物的颜色、气味及检测到的挥发性化合物的峰个数和含量结果见表1。
由表1可知,温度越高,反应液的颜色越深,褐变程度越高。120℃时为葱、蒜香,高于120℃则出现焦糊味,160℃时出现刺激性气味。比较不同温度下所得反应产物的挥发性成分峰个数和总量,温度高(140,150,160℃)时产生的挥发性化合物峰个数多且总量高,140℃时均为最大。对肉香味贡献较大的为含硫化合物,温度较低时(120,130℃)产生的含硫挥发性成分的峰个数和含量较少,温度高(140,150,160℃)时二者均显著增多,160℃时峰个数最多,但140℃时含硫化合物的含量最多。这可能因为温度较低时(120,130℃)反应速率慢,半胱氨酸Amadori降解慢,产生的挥发性成分的峰个数和含量均较少;而温度较高时(150,160℃)半胱氨酸Amadori降解快,反应复杂,一些含硫化合物的缩合、聚合反应较为强烈,例如2-甲基-3-呋喃硫醇转化成其二聚体双(2-甲基-3-呋喃基)二硫醚,从而造成检测到的峰个数增加,但有些化合物聚合后挥发度降低会使检测到的总含量减少。综合考虑半胱氨酸利用率、香味特征、及含硫风味物质的峰个数和含量等因素,认为140℃反应60 min为采用“半胱氨酸-木糖”模型反应研究肉香风味物质形成的较适宜条件。

表1 不同温度条件下所得反应产物的颜色、气味及检测的挥发性化合物的量Table 1 The colors,smells and the amount of volatile compounds analyzed from the reaction products prepared in different reaction temperatures by solid phase micro-extraction(SPME)and GC-MS
2.4 140℃下反应产物检测的挥发性风味物质
“半胱氨酸-还原糖”美拉德反应是产生肉香味的重要反应。对肉香味有贡献的主要是含硫化合物及含O或N杂环化合物。为了确保鉴定结果的准确性,实验中采用极性、弱极性双柱定性,通过NIST11标准质谱库检索及核对保留指数对检测到的含硫化合物和杂环化合物进行鉴定。
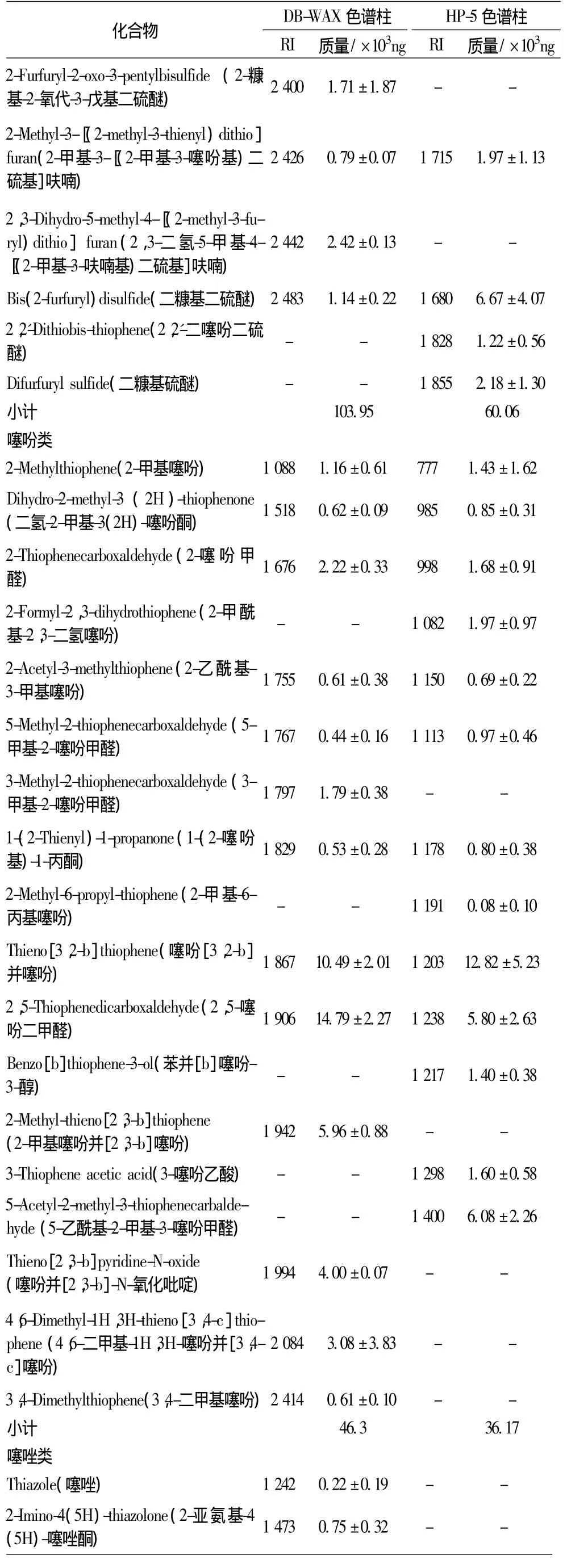
由表2可知,从140℃条件下的热反应产物中共鉴定出53种成分,包括含硫类(40种),含氮杂环类(5种),含氧杂环类(8种)。无论是弱极性柱还是极性柱,含量最高的均为含硫化合物,其次为含氧杂环,含氮杂环相对较少。含硫化合物包括硫醇及硫醚类(18种),噻吩类(18种),噻唑类(4种);含量最高的为硫醇及硫醚类,噻吩类其次,噻唑类含量最少。硫醇、噻吩、噻唑均为“半胱氨酸-还原糖”反应常出现的挥发性香味成分,硫醇进一步发生缩合或聚合反应可形成硫醚。硫醇类一般具有大蒜味、烤香味、H2S样味等;噻吩类具有洋葱味、焦味、咖啡香味、橡皮味等;噻唑类具有烤肉味、坚果味。
2-甲基-3-呋喃硫醇,2-糠硫醇、2-噻吩硫醇、2-甲基噻吩并[2,3-b]噻吩、2,5-噻吩二甲醛、二糠基二硫醚、双(2-甲基-3-呋喃基)二硫醚、糠醛等为检测到的主要成分。2-甲基-3-呋喃硫醇气味阈值为0.002 5 ng/L,具有葱香、蒜香和硫化物气味;2-糠硫醇气味阈值为0.005 ng/L,具有烤香、咖啡香、肉香,它们都是构成煮牛肉、猪肉的主要香味成分[18];双(2-甲基-3-呋喃基)二硫醚和二糠基二硫醚分别为2-甲基-3-呋喃硫醇、2-糠硫醇的二聚体,也是煮肉汤味的重要化合物[19]。

表2 140℃反应60 min产物中检测出的主要挥发性风味物质Table 2 The main volatile flavor compounds identified by SPME/GC-MS from the reaction products prepared at 140℃for 60 min
续表2

续表2
3 结论
(1)在 pH 5.5 及温度120,130,140,150,160 ℃的条件下,“半胱氨酸-木糖”反应形成的美拉德初始中间体2-木糖基噻唑烷-4-羧酸与半胱氨酸Amadori的含量存在正相关,温度越高,半胱氨酸Amadori随反应时间的降解越快,二者在体系内的积累量越低,造成半胱氨酸的利用率越高,反应产物的气味越浓,但同时夹杂的焦糊气味也越重。
(2)综合考虑半胱氨酸的利用率、反应产物的肉香特征、及产生的挥发性化合物总量及含硫化合物的量,得出140℃反应60 min为较适宜条件。采用双柱定性、保留指数比对、标准质谱库检索,从140℃反应60 min的产物中鉴定出53种化合物,包括2-甲基-3-呋喃硫醇、2-糠硫醇等在内的重要含硫肉香物质40种,含氮杂环5种,含氧杂环8种。
[1] Katsumi U,Hagi Y,Nakahara K,et al.Volatile chemicals formed in the head-space of a heated D-glucose/L-cysteine maillard model system[J].Journal of Agricultural and Food Chemistry,1995,43(8):2 212-2 218.
[2] Mottram D S,Nobrega I C C.Formation of sulfur aroma compounds in reaction mixtures containing cysteine and three different forms of ribose[J].Journal of Agricultural and Food Chemistry,2002,50(14):4 080-4 086.
[3] Hofmann T,Schieberle P.Evaluation of the key odorants in a thermally treated solution of ribose and cysteine by aroma extract dilution techniques[J].Journal of Agricultural and Food Chemistry ,1995,43(8):2 187-2 194.
[4] Cerny C,Guntz-Dubini R.Formation of cysteine-S-conjugates in the Maillard reaction of cysteine and xylose[J].Food Chemistry,2013,141(2):1 078-1 086.
[5] Hofmann T,Schieberle P.Identification of potent aroma compounds in thermally treated mixtures of glucose/cysteine and rhamnose/cysteine using aroma extract dilution techniques[J].Journal of Agricultural and Food Chemistry,1997,45(3):898-906.
[6] Cerny C,Davidek T.Formation of aroma compounds from ribose and cysteine during the Maillard reaction[J].Journal of Agricultural and Food Chemistry ,2003,51(9):2 714-2 721.
[7] De Roos K B.In Flavor Precursors[M](ACS Symposium Series).Washington(DC):American Chemical Society,1992:203-216.
[8] De Roos K B,Wolswinkel K,Sipma G.In Process and Reaction Flavors[M](ACS Symposium Series).Washington(DC):American Chemical Society,2005:117-129.
[9] HUANG M G,ZHANG X M,Eric K,et al.Inhibiting the color formation by gradient temperature-elevating Maillard reaction of soybean peptide-xylose system based on interaction of L-cysteine and Amadori compounds[J].Journal of Peptide Science,2012,18:342-349.
[10] Molnar-Perlt I,Friedman M.Inhibition of browning by sulfur amino acids.2.fruit juices and protein-containing foods[J].Journal of Agricultural and Food Chemistry ,1990,38(8):1 648-1 651.
[11] Parker J K.The kinetics of thermal generation of flavour[J].Journal of Agricultural and Food Chemistry ,2013,93(2):197-208.
[12] TANG W P,JIANG D S,YUAN P,et al.Flavor chemistry of 2-methyl-3-furanthiol,an intense meaty aroma compound[J].Journal of Sulfur Chemistry,2013,34(1):38-47.
[13] 吕玉,宋焕禄.不同模型体系产肉香味化合物的对比[J].食品与发酵工业,2010,36(1):61-63.
[14] 吴少雄,van Boeke M A J S,Martins S I F S.温度对美拉德反应的研究[J].食品科学,2005,26(7):63-66.
[15] Ames J M,Guy R C E,Kipping G J.Effect of pH and temperature on the formation of volatile compounds in cysteine/reducing sugar/starch mixtures during extrusion cooking[J].Journal of Agricultural and Food Chemistry,2001,49(4):1 885-1 894.
[16] 张莎莎,景浩.不同温度对木糖-甘氨酸美拉德反应特征性颜色的影响[J].食品科技,2014,39(1):250-254.
[17] 魏泱,丁明玉.蒸发光散射检测技术[J].色谱,2000,18(5):398-401.
[18] Kerscher R,Grosch W.Quantification of 2-methyl-3-furanthiol,2-furfurylthiol,3-mercapto-2-pentanone,and 2-mercapto-3-pentanone in Heated Meat[J].Journal of Agricultural and Food Chemistry ,1998,46(5):1 954-1 958.
[19] Mottram D S,Madruga M S.Some novel meat like aroma compounds from the reactions of alkanediones with hydrogen sulfide and furanthiols[J].Journal of Agricultural and Food Chemistry ,1995,43(1):189-193.
