纤维素酶法制备马铃薯渣可溶性膳食纤维的理化及功能性质*
2015-12-25程力张献梅顾正彪洪雁李兆丰李才明
程力,张献梅,顾正彪,3,洪雁,3,李兆丰,3,李才明
1(江南大学 食品学院,江苏无锡,214122)
2(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
3(食品安全与营养协同创新中心,江苏无锡,214122)
膳食纤维被称为是继水、蛋白质、脂肪、碳水化合物、矿物质、维生素之外的“第七大营养素”,是指在人体小肠内不能被消化吸收,而在人体大肠能部分或全部发酵的植物性成分、非淀粉类碳水化合物,包括多糖、寡糖、木质素以及相关的植物物质[1]。根据膳食纤维溶解性的不同,可将其分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)两大类[2]。研究证实,IDF 主要作用在于使肠道产生机械蠕动,加速肠道排空,生理活性较弱,没有明显的保健作用;而SDF则更多的是发挥新陈代谢的功能,比如参与和影响碳水化合物和脂类代谢[3]。
马铃薯渣含有淀粉、纤维素、果胶及少量蛋白质等可利用组分,是一种富含膳食纤维的马铃薯淀粉加工副产物,且其中的SDF含量较高,具有很高的开发应用价值。传统的酶法制备的马铃薯渣膳食纤维(potato pulp dietary fiber,PDF)中淀粉残存量高,影响了PDF的品质,限制了其应用范围,而利用马铃薯渣直接制备SDF并对其理化功能性质的研究极为有限。
研究团队的前期工作表明,马铃薯渣中的纤维素易被纤维素酶降解,且淀粉由于纤维素组分的包裹和阻隔较难被酶水解利用。因此,本研究通过采用纤维素酶改性马铃薯渣,提高SDF含量,解除其对淀粉的包裹作用,再利用酶法去除淀粉制备了可溶性膳食纤维(C-SDF)。在此基础上,对C-SDF的理化及功能性质进行表征,并与市售的可溶性膳食纤维(S-SDF)和传统酶法制备PDF进行对比分析。
1 材料与方法
1.1 材料与仪器
湿马铃薯渣,内蒙古奈伦集团股份有限公司提供;α-高温淀粉酶(酶活力2 000 U/mL)、葡萄糖苷淀粉酶(酶活力100 000 U/mL)、纤维素酶(酶活力70 U/mL),购于 Sigma-Aldrich集团;胰脂肪酶(酶活3 000 U/g),购于上海沃凯药业有限公司;葡萄糖试剂盒,购于北京利德曼生化股份有限公司;其他试剂均为分析纯,购于国药集团化学试剂有限公司。
SHZ-B水浴恒温振荡器,上海博泰实验设备有限公司;Nicolet iS10傅立叶变换红外光谱仪,美国Thermo Scientific公司;AR-G2型流变仪,美国TA公司;ICS-5000型高效阴离子交换色谱,美国Dionex公司;Waters 1525型高效液相色谱仪,美国Waters公司。
1.2 实验方法
1.2.1 纤维素酶制取马铃薯渣可溶性膳食纤维的工艺

[4]的方法,并综合考虑SDF的得率和质量,调整传统制备工艺,以湿马铃薯渣为原料,首先采用纤维素酶对马铃薯渣进行改性,一定程度的破坏纤维素的网状结构,降低其对淀粉溶出糊化的阻碍,然后再去除淀粉。传统制备工艺首先去除淀粉,再用纤维素酶、木聚糖酶改性,根据马铃薯渣组分酶解特性的研究结果,未经处理的马铃薯渣淀粉酶法降解率低,残存量大,在经纤维素酶、木聚糖酶处理后被束缚的未降解的淀粉会进一步溶出糊化,经后续醇沉工序将混到SDF中,影响SDF的品质。因此,调整传统制备工艺,旨在既有利于淀粉的去除又避免了传统工艺后续流程中淀粉的进一步溶出,影响SDF的品质。具体工艺及条件如下:
称量一定量的湿马铃薯渣,按薯渣∶水=1∶5混匀,1 mol/L HCl调节pH至4.5,纤维素酶酶添加量为20 U/g、温度50℃,酶解时间4 h,反应结束后沸水浴中灭酶10 min;1 mol/L NaOH调节pH至5.0,加入α-高温淀粉酶,95℃反应1 h;1 mol/L盐酸调节pH至5.0,加入葡萄糖苷淀粉酶,60℃反应30 min,沸水浴中灭酶10 min;真空抽滤后得到的滤液,用旋转蒸发仪浓缩;浓缩后的滤液,加4倍体积沉淀SDF,室温下放置过夜;4 500 r/min离心5 min分离,95%乙醇洗涤3次;置于电热鼓风干燥箱中50℃干燥12 h,即得 SDF。采用此条件制得的 C-SDF得率达31.94%(质量分数),占总膳食纤维(total dietary fiber,TDF)含量的62.93%(质量分数)。
1.2.2 单糖及半乳糖醛酸的测定
分别称取样品C-SDF和S-SDF各(100±10)mg于2支试管中,每支试管加入(1.00±0.10)mL 72%的H2SO4,搅拌1 min,在30℃水浴中水浴(60±5)min,每隔5~10 min搅拌1次,使其充分水解;然后加入(28.00±0.04)mL去离子水,使H2SO4稀释到4%,混合均匀,密封好后置于压力锅中,于121℃反应60 min,反应结束后冷却至室温;然后取100 μl的水解液于小试管中,加去离子水稀释,最后定容到10 mL采用ICS-5000离子色谱仪测定[5]。色谱柱:CarboPac PA20;检测器:脉冲安培检测器,流速 0.5 mL/min。
1.2.3 红外光谱测定
取适量的KBr和样品,研磨充分,压片法制备薄片,使用傅立叶红外光谱仪测试。条件如下:以空气为参比,扫描波数范围为4 000~500 cm-1,扫描次数为32次,通过Omnic8.0软件分析结果[5]。
1.2.4 分子质量分布测定
分别准确称取0.100 0 g C-SDF和S-SDF,溶于去离子水中并定容至25 mL,过0.45 μm尼龙微孔膜,滤液采用Waters 1525高效液相色谱仪测定。色谱柱:UltrahydrogelTMLinear 300 mm×7.8 mmin×2;流动相:0.1 mol/L NaNO3;流速:0.9 mL/min;柱温45℃。
1.2.5 黏度测定
样品制备方法:使用去离子水溶解C-SDF和SSDF样品,质量分数为5%(以干基计),搅拌均匀使其充分溶解。
取上述方法制成的样品溶液置于流变仪上,测试条件如下:2.0 cm平板,间隙1 mm,温度设为25℃,测定样品在剪切速率(γ)为0~100 s-1内黏度及剪切应力的变化[6]。
1.2.6 葡萄糖透析延迟指数的测定
测定方法参考 Cheickna Daou[7]和黄清霞等[8]的方法,分别在30、60、90 min时测定透析液中葡萄糖含量。葡萄糖透析延迟指数(GDRI)的计算[公式(1)]:

1.2.7 α-淀粉酶活力抑制力的测定
测定方法参照文献[9],淀粉酶活力抑制力以还原糖减少量的百分比计,计算公式(2):

式中:A—空白样中未添加样品时反应所测得的还原糖的含量,g/100g;A1—添加样品反应后所测得的还原糖的含量,g/100g。
1.2.8 胆酸钠的体外吸附测定
测定方法参照文献[10]。
1.2.9 胰脂肪酶活力抑制力的测定
测定方法参照文献[9],脂肪酶活力的抑制力定义为自由脂肪酸产生量与对照相比降低的百分率;计算公式(3):
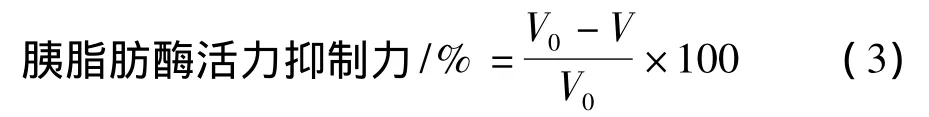
式中:V0—不加样品时,所消耗的NaOH体积,做为对照,mL;V—滴定所消耗的NaOH溶液的体积,mL。
1.2.10 数据处理
实验数据采用Origin 8.5进行图形处理;采用SPSS 19.0进行数据统计分析,显著性分析采用Ducan’多重检验(P<0.05);数值均以(均值±标准差)表示,实验中所涉及数据平行测定至少3次。
2 结果与讨论
2.1 C-SDF的理化性质研究
2.1.1 单糖组成分析
由表1可知,C-SDF中半乳糖醛酸含量最高,葡萄糖和半乳糖次之,其次是阿拉伯糖和鼠李糖,木糖含量极低,初步分析C-SDF中主要成分为果胶和聚葡萄糖;S-SDF中仅含有葡萄糖和半乳糖,且葡萄糖含量高达83.43%,初步分析S-SDF属于聚葡萄糖类可溶性膳食纤维[10]。
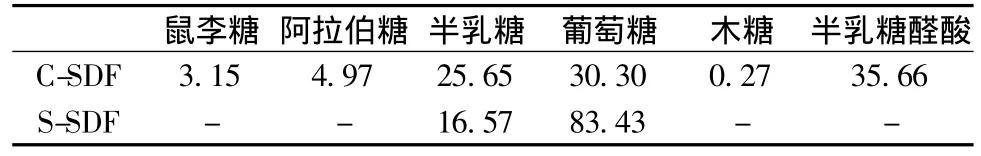
表1 C-SDF和S-SDF的单糖组成及半乳糖醛酸含量Table 1 The neutral monosaccharide content ratio and Gal A of SDF
2.1.2 红外光谱扫描分析
由图1可知,C-SDF、S-SDF和PDF都具有糖的特征吸收峰。1 600~1 800 cm-1处的吸收峰是C=O的吸收峰,说明样品中都存在糖醛酸;1 739 cm-1处为半纤维素羰基(C=O)的伸缩振动,说明在C-SDF中存在可溶性的半纤维素成分,但吸收峰很弱说明可溶性的半纤维素含量极少,PDF中此处吸收峰很强,说明半纤维素含量相对较高;895~899 cm-1处的吸收峰是由β-吡喃糖C-H变角振动引起的,说明SDF中存在 β-吡喃糖[11]。

图1 马铃薯渣中各组分傅里叶红外光谱图Fig.1 FTIR spectra of potato pulp’s composition
2.1.3 分子质量分布分析
由表2可知,C-SDF的重均分子质量(Mw)分布集中在266~137 687 Da,其中最大Mw为137 687 Da,与果胶的Mw 125 111 ~146 841 Da基本相符[12-13],进一步证明C-SDF中含有果胶,可能还含有可溶性的纤维素或半纤维素片段;而S-SDF的Mw分布集中在445 Da和1 695 Da,其中 Mw为445 Da的部分所占比例为52.87%,Mw为1 695的部分占47.13%。

表2 C-SDF和S-SDF相对分子质量分布Table 2 Relative molecular weight distribution of C-SDF and S-SDF
2.1.4 黏度分析
SDF的黏度对其生理功能有重要影响,相对较大的黏度有利于延缓和降低消化道中其他食物成分的消化吸收,有利于SDF发挥其降血糖和降血脂作用,有研究表明只有高黏度的SDF才对预防或治疗高胆固醇病有预防作用[14]。C-SDF和S-SDF的静态流变曲线如图2所示。

图2 C-SDF和S-SDF的黏度Fig.2 The viscosity of C-SDF and S-SDF
采用Herschel–Bulkley方程对曲线进行拟合,结果如表3所示。由表中拟合参数可知,C-SDF的屈服应力σ0和稠度系数K值均大于S-SDF的σ0和K。这主要是由SDF分子质量大小导致的,C-SDF相对较高的黏度性质,将赋予其较好的降血糖、降血脂的功能性质。

表3 C-SDF和S-SDF的Herschel–Bulkley拟合参数Table 3 Rheological parameters of C-SDF and S-SDF
2.2 C-SDF的功能性质研究
2.2.1 葡萄糖透析延迟指数分析
葡萄糖透析延迟指数(GDRI)可以有效反映葡萄糖在胃肠道被延迟吸收的情况,通过测定糖透析延迟指数可以评价膳食纤维降低餐后血糖的能力[15]。
从图3可以看出C-SDF的葡萄糖延迟扩散能力均显著高于S-SDF和PDF(P<0.05),这可能是经纤维素酶作用得到的SDF中由于酶对细胞壁的部分降解作用,使得部分纤维素可溶的同时纤维结构变得较疏松,比表面积增大,暴露出来的功能基团增多,CSDF与葡萄糖分子间的相互作用增强,并且C-SDF较好的溶解性使它与葡萄糖之间的接触吸附更加充分;PDF结构致密,错综复杂的纤维结构阻碍了功能基团与酶的接触,无法发挥作用;Adiotomre等[16]报道多糖黏度对葡萄糖在肠道吸收的延迟程度具有很大影响,S-SDF则由于黏度较小及功能成分的不同,葡萄糖延迟扩散能力低于C-SDF。

图3 C-SDF、S-SDF和PDF的葡萄糖透析延迟指数Fig.3 GDRI of C-SDF,S-SDF and PDF
2.2.2 α-淀粉酶活力抑制力
膳食纤维对α-淀粉酶活力的抑制作用是其降血糖功能的另一作用机理。淀粉酶活力受到抑制后淀粉的酶解受到限制,被水解成小分子糖的量变小,使得血糖水平降低。综合分析C-SDF对α-淀粉酶活力的抑制作用和它的葡萄糖延迟扩散能力有助于进一步从机理上解释其降血糖原因。
由图4可知,C-SDF对α-淀粉酶活力的抑制力高于PDF和S-SDF,但三者之间无显著差异(P≥0.05)。研究报道显示膳食纤维对淀粉酶活力抑制作用的机理包括:膳食纤维对淀粉酶或淀粉的束缚作用阻碍了底物对酶的可及性,以及膳食纤维的表面基团对淀粉酶活力的抑制作用[17]。PDF表现出了较大的α-淀粉酶活力抑制力,可能是其中复杂的纤维素和半纤维素结构,对淀粉或淀粉酶的束缚作用大于C-SDF增加的活性基团对淀粉酶活力的抑制作用;S-SDF的组成结构简单黏度较小,具有最小的淀粉酶活力抑制力[18]。
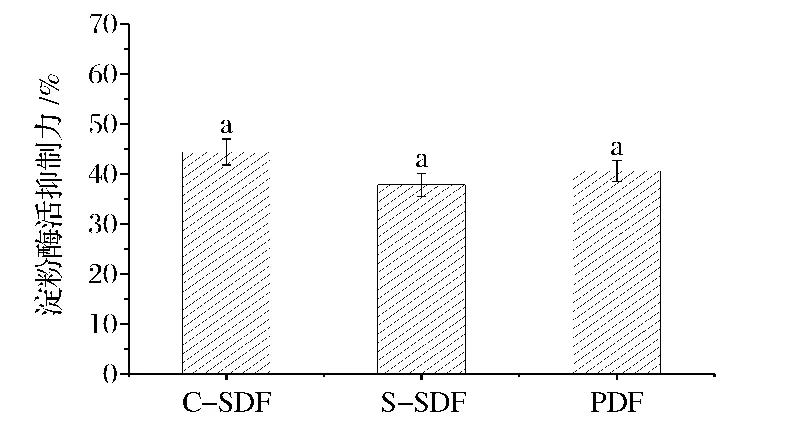
图4 C-SDF、S-SDF和PDF的淀粉酶活力抑制力Fig.4 α-Amylase inhibitory activity of C-SDF,S-SDF and PDF
2.2.3 胆酸钠的体外吸附分析
膳食纤维对胆酸钠的吸附能力可以用来衡量其降血脂的功能特性,膳食纤维通过在小肠中束缚胆酸盐及促进胆酸盐的排出来降低胆固醇,间接发挥降血脂功效[19]。膳食纤维可以通过疏水相互作用、范德华力和氢键等与胆酸盐发生相互作用,或以其中一种作用力为主,实现对胆酸盐的吸附、促进胆酸盐的排出,发挥降血脂的作用[20]。
由图5可知,溶液中胆酸钠浓度随时间的推移而不断减小,说明溶液中的膳食纤维持续的发挥着吸附胆酸钠的作用。C-SDF在最开始的30 min内,胆酸钠浓度变化较为显著,30~45 min时略微减慢,而后则趋于平缓;S-SDF在最开始的15 min内,胆酸钠浓度变化较为显著,15~60 min变化缓慢,之后区域平缓;PDF在最开始的15 min内,胆酸钠浓度变化较为显著,15~30 min内略微减慢,而后则趋于平缓。CSDF趋于平缓的极限值低且趋于平缓所用时间长,说明C-SDF可以较长时间发挥吸附胆酸钠的作用且吸附能力较强。

图5 C-SDF、S-SDF和PDF的胆酸钠吸附力Fig.5 The bile sodium adsorbility of C-SDF,S-SDF and PDF
2.2.4 胰脂肪酶活力抑制力分析
膳食纤维对胰脂酶活力的抑制作用可作为它降血脂的另一表征。由膳食纤维引起的脂肪水解率的降低是非常有利的,脂肪水解率降低会延长餐后饱腹感的时间并且减轻脂肪消化系统的负担[21]。
由图6可知,C-SDF的胰脂肪酶活力抑制力显著高于S-SDF和PDF。推测其原因C-SDF中因酶的作用纤维片段变小,比表面积增大,功能集团更多地暴露出来,使其对油或酶的包囊作用增大,限制了油对酶的可及性,从而降低了胰脂酶的活力。而PDF因结构致密,大部分功能集团被束缚在纤维结构内部,阻碍了其与油或酶的接触,限制了其对胰脂肪酶活力的抑制作用[22]。
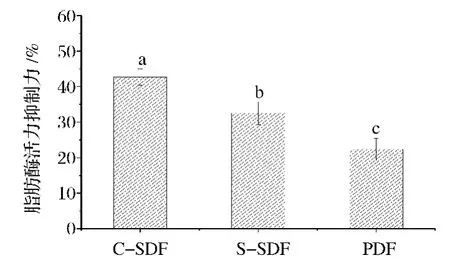
图6 C-SDF、S-SDF和PDF的胰脂酶活力抑制力Fig.6 Pancreatic lipase inhibitory activity of C-SDF,S-SDF and PDF
3 结论
C-SDF的单糖组成中半乳糖醛酸含量最高,其次是葡萄糖和半乳糖,红外光谱显示它属于多糖类物质且有明显的糖醛酸类物质吸收峰,分子质量分布显示其最高Mw与果胶的分子质量分布基本一致,C-SDF的主要成分为果胶和β-葡聚糖;C-SDF因含有果胶,分子质量和黏度值均高于S-SDF;C-SDF的葡萄糖延迟扩散能力、α-淀粉酶活力抑制力、胆酸钠的吸附能力和胰脂肪酶活力抑制力均高于PDF和S-SDF,在降血糖、降血脂方面将具有广泛的用途。
参考文献
[1] Seidner D L,Lashner B A,Brzezinski A,et al.An oral supplement enriched with fish oil,soluble fiber,and antioxidants for corticosteroid sparing in ulcerative colitis:a randomized,controlled trial[J].Clinical Gastroenterology and Hepatology,2005,3(4):358-369.
[2] 郑建仙.低能量食品[M].北京:中国轻工业出版社,2001.
[3] Shiiba K,Yamada H,Hara H,et al.Preparation and effect of cell-wall hydrolysate from wheat bran on mixing properties of dough[J].Cereal Chemistry,1994,71(3):279-281.
[4] 陶颜娟.小麦麸皮膳食纤维的改性及应用研究[D].无锡:江南大学,2008.
[5] 曹媛媛.甘薯膳食纤维的制备及其物化特性的研究[D].乌鲁木齐:新疆农业大学,2007.
[6] 吴银琴.不同直链淀粉含量的甘薯淀粉及其与瓜尔胶复配体系性质的研究[D].无锡:江南大学,2014.
[7] Daou C,ZHANG H.Study on functional properties of physically modified dietary fibres derived from defatted rice bran[J].Journal of Agricultural Science,2012,4(9):85.
[8] 黄清霞,雷激,李华鑫,等.高生物活性柠檬膳食纤维的功能特性研究[J].食品工业科技,2012,33(5):226-229.
[9] 陈菊红.湿法超微粉碎对马铃薯渣的改性及其功能特性和应用研究[D].无锡:江南大学,2008.
[10] 徐苗均.小麦麸皮可溶性膳食纤维的制备及其性质研究[D].合肥:合肥工业大学,2012.
[11] 钱海峰,黄冬云,苑华宁,等.纤维素酶对米糠可溶性膳食纤维含量及抗氧化性的影响[J].食品工业科技,2014,35(15):112-115.
[12] 万建华.马铃薯渣果胶的提取及其性质的研究[D].无锡:江南大学,2008.
[13] Khodaei N,Karboune S.Extraction and structural characterisation of rhamnogalacturonan I-type pectic polysaccharides from potato cell wall[J].Food Chemistry,2013,139(1):617-623.
[14] Slavin J.Position of the American Dietetic Association:health implications of dietary fiber[J].J Am Diet Assoc,2008,108(10):1 716-1 731.
[15] 胡叶碧.改性玉米皮膳食纤维的酶法制备及其降血脂机理研究[D].无锡:江南大学,2008.
[16] Adiotomre J,Eastwood M A,Edwards C,et al.Dietary fiber:in vitro methods that anticipate nutrition and metabolic activity in humans[J].American Journal of Clinical Nutrition,1990,52(1):128-134.
[17] OU S,Kwok K-C,LI Y,et al.In vitro study of possible role of dietary fiber in lowering postprandial serum glucose[J].J Agric Food Chem,2001,49(2):1 026-1 029.
[18] Alvani K,Tester R F,Lin C-L,et al.Amylolysis of native and annealed potato starches following progressive gelatinisation[J].Food Hydrocolloids,2014,36(2):273-277.
[19] Mcdougall G J,Morrison I M,Stewart D,et al.Plant cell walls as dietary fibre:range,structure,processing and function[J].J Sci Food Agric,1996,70(2):133-150.
[20] 温福星,李彩芳.超分子化学[J].魅力中国,2010(24):220-221.
[21] Solomons N W.Modern nutrition in health and disease[J].American Journal of Clinical Nutrition,1994,60(4):643-644.
[22] Slavin J L.Dietary fiber and body weight[J].Nutrition,2005,21(3):411-418.
