多囊卵巢综合征患者血清25-(OH)D3与肥胖、胰岛素抵抗的相关性
2015-12-25王海燕西安交通大学医学院第一附属医院生殖医学科西安7006西安市第四人民医院妇产科通讯作者mailseaggulsinacom
王海燕,王 秀(西安交通大学医学院第一附属医院生殖医学科,西安 7006;西安市第四人民医院妇产科;通讯作者,E-mail:seaggul@sina.com)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)主要表现为稀发或无排卵、卵巢多囊样改变及高雄激素血症,常伴有胰岛素抵抗(insulin resistance,IR)及脂代谢异常等内分泌紊乱,在育龄期妇女中发病率高达5%-10%[1]。目前其病因和发病机制尚不完全清楚,临床表现呈明显异质性。胰岛素抵抗在PCOS患者中占到20%-65%,伴有胰岛素抵抗和肥胖的PCOS往往提示预后更差[2]。在动物模型和人体试验中均已证实维生素D缺乏与糖代谢和胰岛素分泌密切相关[3,4]。近期文献报道,血清维生素D浓度与胰岛素分泌水平正相关,高水平的25-(OH)D3可以明显降低心血管系统疾病、糖尿病等的发病率[5]。本研究旨在探讨PCOS患者中是否存在维生素D缺乏,以及维生素D水平与PCOS患者内分泌紊乱、肥胖、胰岛素抵抗之间的关系。
1 资料和方法
1.1 一般资料
选取2013-03~2013-11在我院就诊的PCOS患者83例。PCOS诊断按2003年鹿特丹标准,即符合以下三条中的两条:①临床表现为持续无排卵或偶发排卵;②临床或生化指标提示存在高雄激素血症;③卵巢呈多囊样改变并排除甲状腺疾病、黑棘皮病、糖尿病、泌乳素瘤和皮质醇增多症等。由于25-(OH)D3主要在肝脏代谢生成,因此入选的研究对象要求肝、肾功能均正常。另选36例同期健康体检的育龄期妇女为对照组。所有参与研究者均签署知情同意书并满足至少就诊前3月内未服用任何影响体内性激素、糖脂代谢、维生素D代谢的药物。
1.2 研究方法
测定PCOS组和对照组每个对象身高和体重,计算BMI(BMI=体重/身高2),PCOS患者根据BMI≥25 kg/m2界值,分为肥胖(Ob-PCOS)组和非肥胖(Nob-PCOS)组。所有研究对象均在月经周期的第3-5天清晨空腹静脉采血,测定血清中雌二醇(estradiol,E2)、总睾酮(testosterone,T)、卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、25-(OH)D3、空 腹 血 糖(FGS)和空腹胰岛素(FINS)水平,所有项目均应用全自动电化学发光免疫分析仪检测(cobas e601,罗氏,瑞士),试剂盒由罗氏公司提供。计算胰岛素抵抗指数(the homeostasis model assessment of insulin resistance,HOMA-IR)评估 IR 水平,HOMA-IR=FGS×FIN/22.5,HOMA-IR指数是目前国际公认的评估IR程度的较好指标,本研究中所有PCOS患者以HOMA-IR≥1.66 为界值[6],分为胰岛素抵抗(IR-PCOS)组和非胰岛素抵抗(NIR-PCOS)组。
1.3 统计学分析
PCOS患者不同分组和对照组的内分泌及代谢指标、血清25-(OH)D3浓度用±s表示并采用ANOVA检验分析,Bartlett检测用于方差齐性的检验,方差不齐者用Games-Howell检验,方差齐者用Fisher’s LSD 检验。BMI、E2、T、LH/FSH 值、FGS、FIN、HOMA-IR指数与血清25-(OH)D3的关系采用Pearson相关分析。应用SPSS15.0软件处理数据,P<0.05为差异有统计学意义。
2 结果
2.1 内分泌、代谢指标及血清25-(OH)D3浓度在肥胖及非肥胖PCOS组及对照组中的比较
83例 PCOS患者中,BMI≥25 kg/m2的肥胖PCOS(Ob-PCOS)者57例,非肥胖(Nob-PCOS)者26例,肥胖及非肥胖PCOS患者分别与对照组相比,年龄、E2水平没有差异(P>0.05)。肥胖和非肥胖PCOS患者间LH/FSH和T比较没有差异;但两组与对照组相比,差异均有显著性(P<0.05);肥胖PCOS患者BMI、FGS、FIN和HOMA-IR均显著高于非肥胖PCOS患者(P<0.01),而25-(OH)D3浓度则显著低于非肥胖PCOS患者(P<0.01),两组分别与对照组相比,上述指标也具有显著性差异(P<0.01,见表1)。
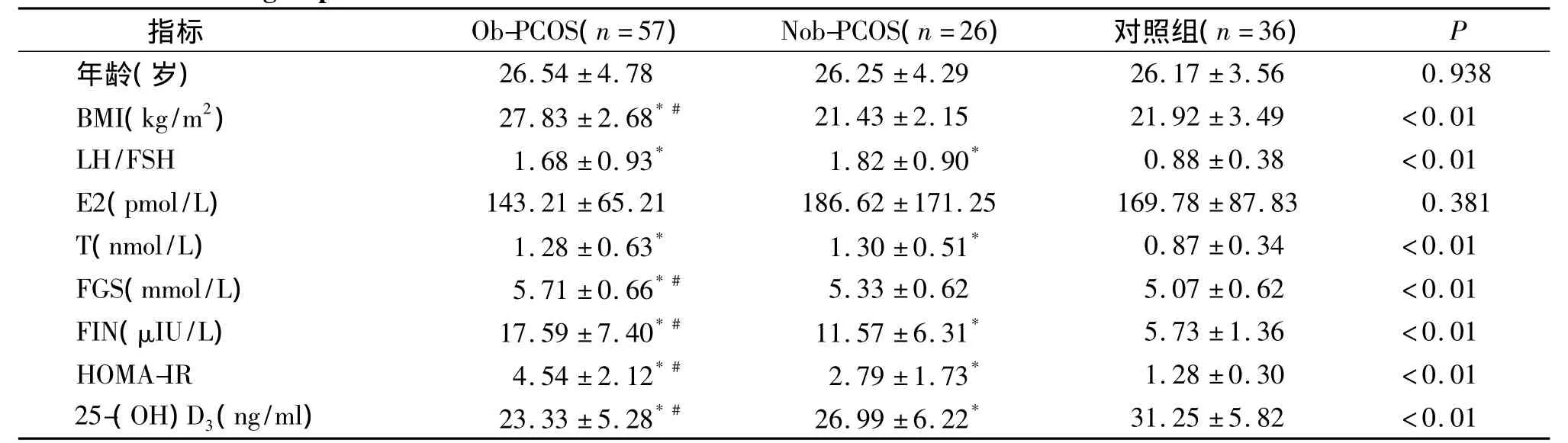
表1 相关因素及血清25-(OH)D3浓度在肥胖及非肥胖PCOS患者及对照组中的比较Table 1 Comparison of related factors and 25-(OH)D3levels beteen obese PCOS group,non-obese PCOS groups and control group
2.2 各组间内分泌、代谢指标及血清25-(OH)D3浓度的比较
83例PCOS患者中,HOMA-IR≥1.66的胰岛素抵抗PCOS(IR-PCOS)组68例,非胰岛素抵抗(NIRPCOS)组15例,两组与对照组相比,年龄、BMI水平没有差异(P>0.05)。E2因为方差不齐,三组间经Gams-howell法比较,差异并无显著性;胰岛素抵抗和非胰岛素抵抗PCOS患者之间LH/FSH、T和25-(OH)D3浓度比较没有差异,但与对照组相比,两组均有显著性差异(P<0.05);胰岛素抵抗PCOS患者FGS、FIN、和HOMA-IR水平显著高于非胰岛素抵抗 PCOS患者(P <0.01)和对照组(P <0.01),而非胰岛素抵抗PCOS患者与对照组相比上述指标未见明显差异(P >0.05,见表2)。
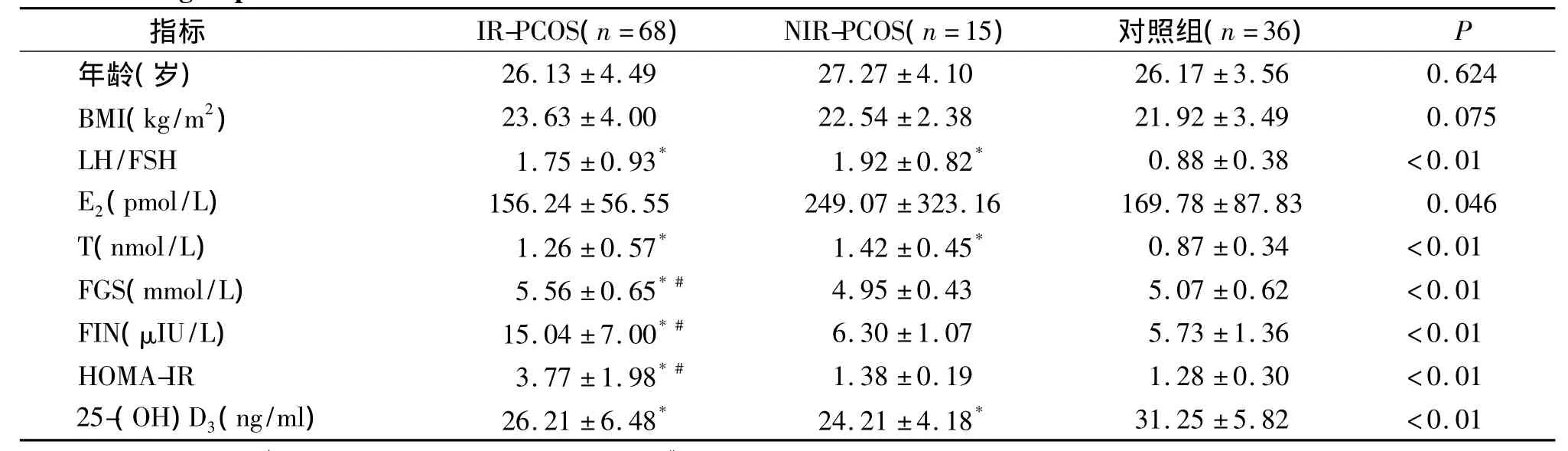
表2 相关因素及血清25-(OH)D3浓度在胰岛素抵抗及非胰岛素抵抗PCOS患者及对照组中的比较Table 2 Comparison of related factors and 25-(OH)D3levels beteen IR-PCOS group,NIR-PCOS group and control group
2.3 内分泌、代谢指标与血清25-(OH)D3浓度相关性分析
经Pearson相关分析,血清25-(OH)D3浓度与BMI、FIN 和 T 呈明显负相关(P <0.05),与 E2、LH/FSH、FGS和 HOMA-IR相关性不明显(P >0.05,见表3)。
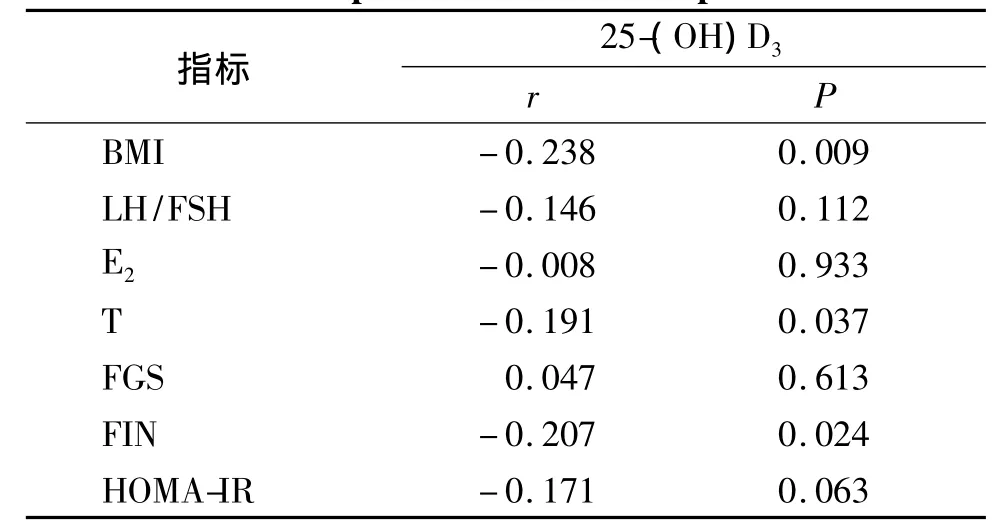
表3 相关因素与血清25-(OH)D3浓度相关性分析Table 3 Correlation between 25-(OH)D3levels and correlative parameters in PCOS patients
3 讨论
PCOS是一种临床表现异质性的复杂综合征,以下丘脑-垂体-卵巢轴紊乱为主要特征,主要表现为B超下卵巢呈现多囊样改变,患者多伴有高雄激素血症、胰岛素抵抗及糖、脂类代谢紊乱。PCOS不仅影响患者的生殖系统功能,而且与代谢综合征、心血管系统疾病的发生密切相关。近年来研究发现维生素D缺乏可能是导致代谢紊乱的因素之一,血清维生素D浓度与代谢综合征的发病呈负相关,升高维生素D的水平可以改善代谢指标,明显降低代谢综合征的发病率[7,8]。内源性维生素D可以在肝脏作用下合成25-(OH)D3,25-(OH)D3大量存在于人体血液循环中,是评价维生素D水平的重要指标。但是维生素D的影响因素较多,户外活动多少、个体的饮食偏好和维生素D的新陈代谢机制的差异都可以引起维生素D的降低[9]。多元回归分析表明25-(OH)D3浓度由肥胖程度决定[10]。原因可能是脂溶性的维生素D可以滞留在肥胖者脂肪组织中,而脂肪组织可以减少维生素D释放入血的量,造成肥胖者维生素D的生物利用率降低。以往研究显示PCOS患者的血清25-(OH)D3水平与BMI呈负相关,肥胖者比非肥胖者的维生素D水平要低27%-56%[11,12]。有研究指出对肥胖的 PCOS患者采取生活方式干预,发现药物治疗升高25-(OH)D3水平,肥胖PCOS患者腰臀比、血压及血胆固醇浓度显著下降[9,13]。本研究中发现,肥胖PCOS患者FIN、HOMA-IR和25-(OH)D3水平明显低于非肥胖PCOS患者(P<0.05),同时不论是否存在肥胖,PCOS患者 FIN、HOMA-IR和25-(OH)D3水平均明显低于对照组(P<0.05),说明25-(OH)D3水平的减低可能不仅与肥胖有关,而是与胰岛素抵抗的存在有相似之处,即与PCOS患者本身的代谢紊乱有关。
现有的研究结果普遍认为高胰岛素血症及胰岛素抵抗在多囊卵巢综合征的发生发展中起重要作用。虽然部分PCOS消瘦人群中也会有胰岛素敏感性的减低,但10%-25%的PCOS肥胖人群表现为胰岛素抵抗。所以肥胖可能是PCOS患者胰岛素抵抗的重要原因,高胰岛素血症和肥胖在PCOS发生中发挥了协同作用[14]。以往研究发现2型糖尿病患者合并维生素D缺乏多见,补充维生素D后患者胰岛素的敏感性增强;同时动物实验发现摄入1,25-(OH)D3可以预防2型糖尿病的发生,维生素D在IR和糖尿病的发病过程中扮演的重要作用显而易见[15]。既往有研究通过检测PCOS患者和正常对照者的血25-(OH)D3浓度、胰岛素敏感性校对指数(QUICKI)等代谢指标,发现25-(OH)D3浓度与QUICKI呈正相关(P=0.035)[16],尽管具体机制尚不非常清楚,但是研究者认为 PCOS患者的25-(OH)D3水平降低与IR有关,推测其机制可能是维生素D可以增强胰岛素的合成和分泌,提高胰岛素受体的应答;同时可以抑制介导IR的促炎因子,增强胰岛素的作用有关[15]。本研究发现无论有无胰岛素抵抗,PCOS患者血清25-(OH)D3水平与对照组相比均有显著下降(P<0.05),但是在胰岛素抵抗组间没有差异(P>0.05),而在肥胖者和非肥胖者之间存在显著差异,说明PCOS患者血清25-(OH)D3水平与肥胖关系更为密切。本研究发现PCOS患者血清25-(OH)D3水平与BMI、空腹胰岛素、睾酮呈明显负相关(P<0.05),但是与胰岛素抵抗指数的相关性不足(P=0.063),从而间接证实25-(OH)D3可能参与PCOS患者肥胖及内分泌紊乱方面的发生发展,当然这个结论可能与PCOS患者病例数较少,不存在胰岛素抵抗的PCOS患者数更少(仅有15例)有关,所以要发现血清25-(OH)D3水平与PCOS并胰岛素抵抗的确切联系,尚有待于扩大样本量的进一步研究。
PCOS作为一种与代谢紊乱密切相关的内分泌疾病,维生素D缺乏可能在PCOS发病中占有一席之地。尽管以往研究已经证实PCOS患者内分泌、代谢紊乱与维生素D水平的关系,但两者之间的因果关系尚不能确定。PCOS患者血清25-(OH)D3水平与肥胖、高雄激素血症、高胰岛素血症甚至胰岛素抵抗之间的关系还有待于进一步发掘。一些小规模的非对照干预试验发现维生素D治疗对肥胖PCOS患者的IR和胰岛素分泌有改善作用[13],检测血清维生素D浓度,进而提高血清25-(OH)D3浓度仍然可能是早期预防和治疗PCOS的重要方法,但是需要更多大规模的随机对照试验进一步明确维生素D在PCOS发生发展中的作用以及维生素D对PCOS患者的治疗效果。
[1]Setji TL,Brown AJ.Polycystic ovary syndrome:Diagnosis and treatment[J].Am J Med,2007,120(2):128-132.
[2]Dale PO,Tanbo T,Vaaler S,et al.Body weight,hyperinsulinemia,and gonadotropin levels in the polycystic ovarian syndrome:Evidence of two distinct populations[J].Fertil Steril,1992,58(3):487-491.
[3]Ortlepp JR,Metrikat J,Albrecht M,et al.The vitamin d receptor gene variant and physical activity predicts fasting glucose levels in healthy young men[J].Diabet Med,2003,20(6):451-454.
[4]Bourlon PM,Billaudel B,Faure-Dussert A.Influence of vitamin d3 deficiency and 1,25 dihydroxyvitamin d3 on de novo insulin biosynthesis in the islets of the rat endocrine pancreas[J].J Endocrinol,1999,160(1):87-95.
[5]von Hurst PR,Stonehouse W,Coad J.Vitamin D supplementation reduces insulin resistance in south asian women living in new zealand who are insulin resistant and vitamin D deficient-a randomised,placebo-controlled trial[J].Br J Nutr,2010,103(4):549-555.
[6]李昕,林金芳.肥胖型多囊卵巢综合征患者临床及内分泌代谢特征的研究[J].中华医学杂志,2005,85(46):3266-3271.
[7]Pal L,Berry A,Coraluzzi L,et al.Therapeutic implications of vitamin d and calcium in overweight women with polycystic ovary syndrome[J].Gynecol Endocrinol,2012,28(2):965- 968.
[8]Velija-Asimi Z.Evaluation of the association of vitamin d deficiency with gonadotropins and sex hormone in obese and non-obese women with polycystic ovary syndrome[J].Med Glas,2014,11(1):170-176.
[9]Thomson RL,Spedding S,Brinkworth GD,et al.Seasonal effects on vitamin d status influence outcomes of lifestyle intervention in overweight and obese women with polycystic ovary syndrome[J].Fertil Steril,2013,99(6):1779-1785.
[10]Muscogiuri G,Policola C,Prioletta A,et al.Low levels of 25(oh)d and insulin-resistance:2 unrelated features or a cause-effect in pcos[J].Clin Nutr,2012,31(4):476-480.
[11]Hahn S,Haselhorst U,Tan S,et al.Low serum 25-hydroxyvitamin D concentrations are associated with insulin resistance and obesity in women with polycystic ovary syndrome[J].Exp Clin Endocrinol Diabetes,2006,114(10):577-583.
[12]Yildizhan R,Kurdoglu M,Adali E,et al.Serum 25-hydroxyvitamin d concentrations in obese and non-obese women with polycystic ovary syndrome[J].Arch Gynecol Obstet,2009,280(4):559-563.
[13]Raja-Khan N,Shah J,Stetter CM,et al.High-dose vitamin d supplementation and measures of insulin sensitivity in polycystic ovary syndrome:A randomized,controlled pilot trial[J].Fertil Steril,2014,101(6):1740-1746.
[14]Ferrannini E,Natali A,Bell P,et al.Insulin resistance and hypersecretion in obesity.European group for the study of insulin resistance(egir)[J].J Clin Invest,1997,100(5):1166-1173.
[15]Teegarden D,Donkin SS.Vitamin D:Emerging new roles in insulin sensitivity[J].Nutr Res Rev,2009,22(1):82- 92.
[16]Li H,Brereton R,Anderson R,et al.Vitamin D deficiency is common and associated with metabolic risk factors in patients with polycystic ovary syndrome[J].Metab Clin Exp,2011,60(10):1475-1481.
