内质网相关降解蛋白Derlin-1对宫颈癌HeLa细胞生长的影响
2015-12-25张春梅郭冬丽王赞宏山西医科大学附属山西大医院妇产科太原03000山西医学科学院山西大医院妇产科通讯作者mailwangzanhongcom
吕 娟,李 婧,张春梅,郭冬丽,王赞宏(山西医科大学附属山西大医院妇产科,太原 03000;山西医学科学院,山西大医院妇产科;通讯作者,E-mail:wangzanhong@6.com)
内质网是真核细胞重要的细胞器,是新合成的跨膜型蛋白和分泌型蛋白折叠与修饰的加工厂。当内质网内环境稳态破坏时,蛋白质就无法在内质网中正确折叠,从而使未折叠蛋白或错误折叠蛋白在内质网腔积聚,导致内质网应激,激发未折叠蛋白反应(unfolded protein response,UPR)。UPR 是一种保守的细胞自我保护性措施,其可以通过减少蛋白质合成,上调内质网分子伴侣表达,加强内质网相关性蛋白降解以及自噬作用的增强等综合性反应,促进内质网对蓄积在网腔内的错误折叠或未折叠蛋白质的处理,使细胞恢复正常功能[1]。其中内质网相关性降解(endoplasmic reticulum associated degradation,ERAD)途径是重要的蛋白降解过程[2,3],在这一过程中错误折叠或未折叠蛋白质被内质网膜上的跨膜蛋白复合体识别,通过跨膜蛋白复合体进入胞液,在泛素-蛋白酶体系中被降解。
内质网相关降解蛋白Derlin-1是内质网膜上的跨膜蛋白,在内质网相关性降解信号通路中发挥重要作用,参与错误折叠蛋白的逆向转运,其表达异常与肿瘤等多种疾病有关[4-6]。Derlin-1作为候选的致癌基因,在多种恶性肿瘤,如乳腺癌[7-10]、非小细胞肺癌[11,12]、结肠癌[13]等中呈高表达,并与肿瘤的发生发展密切相关。本研究通过RNAi技术抑制HeLa细胞Derlin-1基因的表达,观察其对Derlin-1 mRNA及蛋白表达的影响,以及对转染细胞生长、凋亡的影响。
1 材料和方法
1.1 细胞株及主要试剂
4 种宫颈癌细胞株 C33a、Caski、Hela、SiHa 均购自美国典型物种保藏中心(American Type Culture Collection,ATCC),由本实验室保种;胎牛血清为浙江天杭生物科技股份有限公司四季青产品;PSUPER质粒载体购自美国 Oligoengine公司,G418、lipofectamine2000购自美国Invivogen公司,BglⅡ、EcoRⅠ、HindⅢ、T4 DNA连接酶、Taq DNA聚合酶、DNA Marker均为日本 TaKaRa公司产品,RNA抽提及RT-PCR试剂盒购自美国Fermentas公司。细胞组织裂解液RIPA及蛋白酶抑制剂PMSF购自上海申能博彩公司,BCA蛋白定量试剂盒为美国PIERCE公司产品。兔抗人Derlin-1多克隆抗体Derlin-1(产品编号sc-46913)、生物素化二抗(SPN-9001)为美国Santa Cruz公司产品,Caspase-3多克隆抗体为美国NeoMarkers公司产品。所有DNA序列均由上海生工生物工程技术服务有限公司合成。
1.2 细胞培养
4种宫颈癌细胞株培养于含10%胎牛血清、100 μ/ml青霉素和 100 μg/ml链霉素的 Dulbecco’s Modified Eagle Medium(DMEM)(Gibco Invitrogen美国)培养液中(C33a、SiHa、HeLa细胞)或 RPMI 1640培养液中(Caski细胞),于37℃,5%CO2,饱和湿度的培养箱中培养,实验时选用对数生长期细胞。
1.3 逆转录聚合酶链反应(RT-PCR)
RT-PCR检测不同宫颈癌细胞株中Derlin-1 mRNA的表达。Trizol试剂提取细胞总RNA,用MMLV逆转录酶进行逆转录获得cDNA,PCR扩增以cDNA为模板,以GAPDH作为内参照。参照文献[7]设计引物,Derlin-1上游引物为:5'-ATGTCGGACATCGGAGACTG-3',下游引物为:5'-CTGGTCTCCAAGTCGAAAG-3';内参照基因GAPDH上游引物为:5'-GAGTCAACGGATTTGGTCGT-3',下游引物为:5'-GATCTCGCTCCTGGAAGATG-3'。扩增条件:94℃预变性 3 min,94℃ 30 s,55℃30 s,72℃延伸30 s,共45个循环,末次延伸 10 min。另以GAPDH为内对照,扩增结束后,取20 μl扩增产物在含0.5 μg/ml溴乙锭的1.5%琼脂糖凝胶上进行电泳,凝胶成像后并做灰度分析。
1.4 重组载体的构建及筛选鉴定
本实验以PSUPER质粒为载体,该质粒有Bgl和Hind两个酶切位点,双酶切后与设计好的干扰Derlin-1基因的寡核苷酸链进行连接,形成重组质粒,再利用酶切鉴定是否连接成功,筛选出稳定表达的重组质粒,即PSUPER-siDerlin-1(siRNA-Derlin-1)。
1.5 转染HeLa细胞
将宫颈癌HeLa细胞接种于6孔板,每孔5×105个细胞,分别取PSUPER-siRNA-Derlin-1、空质粒转染HeLa细胞,转染方法参照lipofectamine 2000操作说明书进行,转染24 h后用G418筛选(浓度为600 μg/ml),3周后挑取阳性克隆细胞株扩大培养。细胞转染率为荧光显微镜10个200倍视野下有荧光的细胞占全部细胞的百分比,未做任何处理的HeLa细胞设为空白对照组。
1.6 RT-PCR测定细胞中Derlin-1 mRNA及caspase-3 mRNA的表达水平
按Trizol试剂盒分别提取HeLa细胞系空白对照组,siRNA-Derlin-1细胞组及空质粒组的总RNA,后具体方法同1.3。caspase-3上游引物为:5'-ATGTCGGACATCGGAGACTG-3',下游引物:5'-CTGGTCTCCAAGTCGAAAG-3'。
1.7 Western blot检测Derlin-1及caspase-3蛋白表达水平
用预冷的PBS洗涤细胞两次,6孔板每孔细胞加入100 μl RIPA 和1 μl PMSF,收集细胞,冰上放置30 min,离心,上清液即为总蛋白粗提液。应用BCA法测定蛋白含量,取50 μg总蛋白上样进行SDS-PAGE电泳,通过半干电转移法将蛋白从聚丙烯酰胺凝胶转移至PVDF膜上,PVDF膜用5%脱脂奶粉封闭1 h,加入Derlin-1多克隆抗体(1∶4 000)4℃冰箱振荡过夜,用含0.1%Tween20的TBST洗3次,加入辣根过氧化物酶标记的IgG二抗(1∶1 000),室温孵育1 h,TBST洗3次,TBS洗膜1次,在PVDF膜上均匀地涂抹化学发光底物,暗室内X光片曝光显影,在凝胶成像分析系统中成像并测量特异性条带的表达强度。将同次电泳所得的Derlin-1和actin条带灰度值相比,得到各样本组Derlin-1/actin的灰度比值。三组细胞各重复检测 3次。Western blot检测caspase-3蛋白表达水平时一抗为人抗兔caspase-3单克隆抗体(1∶500),二抗为辣根过氧化物酶结合的羊抗兔 IgG(1∶1 000)。
1.8 细胞生长曲线的测定
采用MTT法,转染前HeLa细胞按1×105/孔种植在 96 孔板,转染后24,48,72,96,120 h,每孔加入20 μl 5g/L MTT,继续温育 4 h,加入 100 μl DMSO,震摇15 min,酶联检测仪上测波长490 nm光的吸光度(A490)值。每组设5个复孔,取平均值。
1.9 ELISA法检测各组HeLa细胞凋亡情况
分别收集相同时间点(培养72 h)细胞系HeLa的空白对照组、siRNA-Derlin-1组及空质粒组细胞,分别用胰蛋白酶消化,PBS缓冲液洗涤,1 500 r/min离心5 min,取沉淀并稀释成细胞悬液,取含1×104个细胞的细胞悬液,1 500 r/min离心5 min,弃上清液,向沉淀中加入200 μl细胞裂解液,在室温(15-25℃)孵育30 min后,13 000 r/min离心10 min,取上清为样品。在ELISA反应板内,每孔加入20 μl待测样品和80 μl新鲜配制的免疫反应混合物(含抗组蛋白抗体和抗DNA抗体),以300 r/min振荡1.5 h,再用缓冲液洗涤3 次,加100 μl底物溶液,以200 r/min振荡5 min。用酶标仪在405 nm处对样品进行检测,空白对照在490 nm处进行检测。
1.10 统计学分析
2 结果
2.1 不同宫颈癌细胞株中Derlin-1的表达
Derlin-1 在 C33A、CaSki、HeLa、SiHa 细胞中表达的RT-PCR结果见图1。Derlin-1在C33A细胞中表达较低,而在CaSki、HeLa、SiHa细胞中表达较高,我们选取Derlin-1表达最高的HeLa细胞为研究对象。

图1 宫颈癌细胞株Derlin-1表达的鉴定Figure 1 Expression of Derlin-1 in cervical cancer cell lines
2.2 重组质粒对Derlin-1 mRNA和caspase-3 mRNA表达的影响
RT-PCR检测结果表明,siRNA-Derlin-1组、空质粒组及空白对照组Hela细胞中Derlin-1 mRNA的相对表达量分别为 0.193 ±0.034、0.498 ±0.025和0.535 ±0.021,按 α =0.05 水准,siRNA-Derlin-1组较空质粒组和空白对照组Derlin-1 mRNA表达量显著下调(P=0.00<0.05),差异具有统计学意义;同时,未受干扰的空质粒组与空白对照组相比,Derlin-1 mRNA表达量无明显差异(P>0.05)。结果可以得出:Derlin-1基因经RNA干扰后,Derlin-1 mRNA的表达明显抑制。
RT-PCR检测结果表明,siRNA-Derlin-1组、空质粒组及空白对照组HeLa细胞中caspase-3 mRNA的相对表达量分别为 0.539 ±0.012,0.235 ±0.021和0.197 ±0.035,按 α =0.05 水准,siRNA-Derlin-1组较空质粒组和空白对照组caspase-3 mRNA表达量显著升高,差异具有统计学意义(P=0.00<0.05);同时,空质粒组与空白对照组相比,caspase-3 mRNA表达量无明显差异(P>0.05)。
2.3 重组质粒对Derlin-1蛋白和caspase-3蛋白表达的影响
Derlin-1蛋白表达的Western blot结果见图2。siRNA-Derlin-1组、空质粒组及空白对照组细胞的Derlin-1/actin的灰度比值分别为 0.332 ±0.081,0.583 ±0.120,0.651 ±0.213。方差分析显示,空白对照组与空质粒组间蛋白表达差异无统计学意义(P >0.05),siRNA-Derlin-1组与空质粒组、空白对照组相比,Derlin-1蛋白表达明显下降(P<0.05)。

图2 各实验组细胞Derlin-1和caspase-3表达的Western blot结果Figure 2 Expression of Derlin-1 and caspase-3 in each group by Western blot
caspase-3蛋白表达Western blot结果见图2。siRNA-Derlin-1组、空质粒组及空白对照组3组细胞的Derlin-1/Actin的灰度比值分别为0.752±0.195,0.534 ±0.142,0.412 ±0.053。方差分析显示,空质粒组与空白对照组蛋白表达差异无统计学意义(P>0.05),siRNA-Derlin-1组与空质粒组、空白对照组相比,Derlin-1蛋白表达增多(P<0.05)。
2.4 重组质粒对细胞增殖的影响
以时间为横轴,A490为纵轴,绘制细胞生长曲线。MTT检测结果表明,siRNA-Derlin-1组较空质粒组和空白对照组细胞增殖能力明显降低(P<0.05)。Derlin-1 siRNA的导入使细胞的体外增殖能力减弱(见表1、图3)。

表1 各组细胞不同时间点MTT吸光度值(A490 nm)比较Table 1 Absorbance value of the cells at different time points in each group
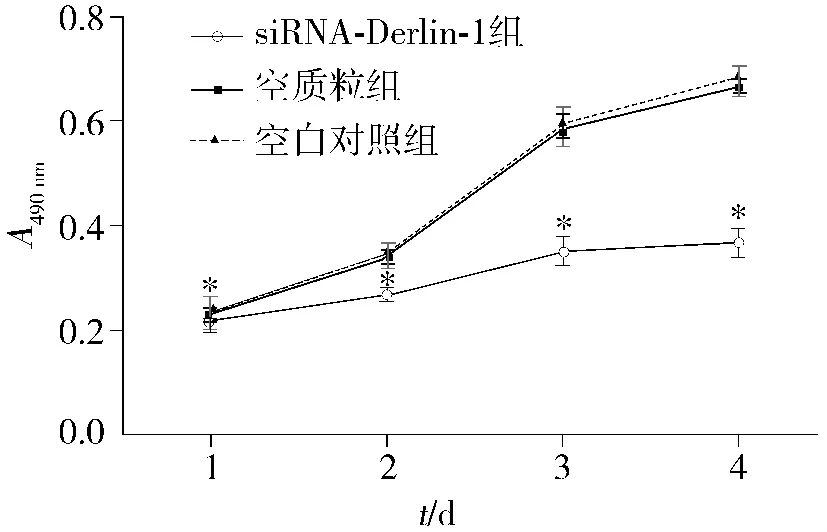
图3 PSUPER-siRNA-Derlin-1转染HeLa细胞后的生长曲线Figure 3 Growth curve of HeLa cells after PSUPER-siRNA-Derlin-1 transfection
2.5 重组质粒对细胞凋亡的影响
用Cell Death Detection ELISA PLUS检测试剂盒检测不同组HeLa细胞凋亡程度,从本实验可以看出相对于空白对照组(0.490±0.0267)和空质粒组(0.554 ±0.016),干扰组(0.708 ±0.023)明显诱导了HeLa细胞的凋亡(P<0.05,见图4)。
3 讨论
内质网是真核细胞中蛋白质合成、折叠与分泌的重要细胞器,也是细胞内钙离子的贮存库。内质网内环境的稳定是实现内质网功能的基本条件,在很多应激情况下,如缺血再灌注损伤、氧化应激、钙代谢紊乱等均可引发内质网应激。此未折叠蛋白或错误折叠蛋白在内质网腔积聚,激发未折叠蛋白反应,从而通过减少蛋白质合成,加强内质网相关性蛋白降解以及自噬作用的增强等综合性反应,促进内质网对蓄积在网腔内蛋白质的处理,使细胞恢复正常功能[1]。其中ERAD途径是重要的蛋白降解过程[2,3],在这一过程中错误折叠或未折叠蛋白质被内质网膜上的跨膜蛋白复合体识别,通过跨膜蛋白复合体进入胞液,在泛素-蛋白酶体系中被降解。

图4 重组质粒对细胞凋亡的影响Figure 4 Effect of siRNA-Derlin-1 on apoptosis of HeLa cells
Derlin-1是新近鉴定的跨膜蛋白复合体的重要成分,调节底物蛋白从内质网跨膜逆向转运至胞质的过程,在蛋白的跨膜转运中发挥重要作用,其突变、缺失或表达不足均可影响错误折叠蛋白的转运,导致内质网腔内蛋白质的堆积、内质网超微结构的破坏,进而引起内环境的异常和功能紊乱。Derlin-1基因定位于8号染色体的8q24.13区段,多肽链由251个氨基酸组成,约为22 kD,镶嵌于内质网双分子层中,由四个跨膜蛋白组成,形成跨膜小孔,其C末端和N末端均暴露在细胞质中,可与多种蛋白分子发生相互作用[5]。近来研究表明Derlin-1在多种恶性肿瘤,如乳腺癌[7-10]、非小细胞肺癌[11,12]、结肠癌[13]等中呈高表达,并与肿瘤的发生发展密切相关,是候选的致癌基因,但是关于Derlin-1在宫颈癌中的研究尚未有相关报道。
本研究首先通过RT-PCR检测Derlin-1在4种宫颈癌细胞株中的表达,结果表明其在3种宫颈癌细胞株中都呈高表达,并在Hela细胞中表达量最高;随后我们选取HeLa细胞株作为研究对象,并合成针对Derlin-1的干扰载体,通过脂质体转染细胞后发现其可以有效地抑制HeLa细胞中Derlin-1基因的表达,并从mRNA和蛋白两个水平得到验证;最后我们采用MTT法检测了三组细胞的增殖情况,发现干扰组HeLa细胞的体外增殖能力明显降低,与此同时该组细胞的凋亡率增加,凋亡核心蛋白caspase-3表达增加。综上所述,本研究结果提示Derlin-1基因沉默可有效抑制宫颈HeLa细胞的增殖,促进细胞的凋亡,内质网相关降解蛋白Derlin-1可作为候选基因靶向治疗基因。
[1]Zhao L,Ackerman SL.Endoplasmic reticulum stress in health and disease[J].Curr Opin Cell Biol,2006,18(4):444-452.
[2]Lemus L,Goder V.Regulation of endoplasmic reticulum-associated protein degradation(ERAD)by ubiquitin[J].Cells,2014,3(3):824-847.
[3]Jarosch E,Lenk U,Sommer T.Endoplasmic reticulum-associated protein degradation[J].Int Rev Cytol,2003,223:39-81.
[4]Lilley BN,Pioegh HL.A membrane protein required for dislocation of misfolded proteins from the ER[J].Nature,2004,429(6994):834-840.
[5]Ye Y,Shibata Y,Yunt C,et al.A membrane protein complex mediatesretro-translacation from the ER lumen into the cytosol[J].Nature,2004,429(6994):841-847.
[6]Ran Y,Hu H,Hu D,et al.Derlin-1 is overexpressed on the tumor cell Surface and enables antibody-mediated tumor targeting therapy[J].Clin Cancer Res,2008,14(20):6538-6545.
[7]Wang J,Hua H,Ran Y,et al.Derlin-1 is overexpressed in human breast carcinoma and protects cancer cells from endoplasmic reticulum stress-induced apoptosis[J].Breast Cancer Res,2008,10(1):R7.
[8]Klopfleisch R,Gruber AD.Derlin-1 and stanniocalcin-1 are differentially regulated in metastasizing canine mammary adenocarcinomas[J].J Comp Pathol,2009,141(2-3):113-120.
[9]Klopfleisch R,Schütze M,Linzmann H,et al.Increased Derlin-1 expression in metastases of canine mammary adenocarcinomas[J].J Comp Pathol,2010,142(1):79-83.
[10]Klopfleisch R,Klose P,Gruber AD.The combined expression pattern of BMP2,LTBP4,and DERL1 discriminates malignant from benign canine mammary tumors[J].Vet Pathol,2010,47(3):446-454.
[11]Dong QZ,Wang Y,Tang ZP,et al.Derlin-1 is overexpressed in non-small cell lung cancer and promotes cancer cell invasion via EGFR-ERK-mediated up-regulation of MMP-2 and MMP-9[J].Am J Pathol,2013,182(3):954-964.
[12]Xu L,Wang ZH,Xu D,et al.Expression of Derlin-1 and its effect on expression of autophagy marker genes under endoplasmic reticulum stress in lung cancer cells[J].Cancer Cell Int,2014,14:50.
[13]Tan X,He X,Jiang Z,et al.Derlin-1 is overexpressed in human colon cancer and promotes cancer cell proliferation[J].Mol Cell Biochem,2015:Epub ahead of print.
[14]Wang WA,Groenendyk J,Michalak M.Endoplasmic reticulum stress associated responses in cancers[J].Biochim Biophys Acta,2014,1843(10):2143-2149.
[15]Hu D,Ran YL,Zhong X,et al.Overexpressed Derlin-1 inhibits ER expansion in the endothelial cells derived from human hepatic cavernous hemangioma[J].J Biochem Mol Biol,2006,39(6):677-685.
