植酸酶对黄金鲫钙磷代谢的影响
2015-12-25王桂芹
李 萌,王桂芹
(吉林农业大学动物科学技术学院,吉林长春130118)
植酸酶是催化植酸及其盐类水解为肌醇与磷酸盐的一类酶的总称,属磷酸单酯水解酶。植酸酶具有特殊的空间结构,能够分离植酸分子中的磷,将植酸盐降解为肌醇和无机磷,同时释放出与植酸盐结合的其他营养物质(施安辉等,2005)。植酸酶可以促进植酸盐的水解,磷酸根可以被鱼类吸收利用,对促进鱼类生长具有较好的效果(陈立侨等,1994)。因此,在饲料中添加植酸酶,即降低了饲料成本,又减轻了养殖水体的负担 (文华等,2008)。本试验在全植物蛋白源的黄金鲫饲料中添加植酸酶研究对其钙磷代谢的影响,以期为植酸酶在以植物蛋白源为主的鱼饲料中的广泛应用提供理论依据和实践指导。
1 材料与方法
1.1 材料 试验用黄金鲫幼鱼,购自二八一四渔场。试验用植酸酶,购自上海生物工程有限公司(酶活力为5000 U/kg)。试验共6组,对照组添加磷酸二氢钙,试验1~5组分别添加植酸酶0、300、600、900、1200 U/kg。
植酸酶以次粉为载体进行稀释 (Jackson等,1996)。采用105℃恒温烘干法测定水分;采用凯氏定氮法测定粗蛋白质;采用550℃灼烧法测定粗灰分;采用索氏抽提法测定粗脂肪;弹式热量计测定能量;采用乙二胺四乙酸二钠络合滴定法测定钙;采用钼黄分光光度法测定总磷。饲料有效磷的含量用饲料中总磷、植酸磷含量和植酸酶活性计算参考方热军等(2006)中的方法。试验饲料组成及营养水平见表1。

表1 试验饲料组成及营养水平
1.2 方法
1.2.1 饲养管理 试验鱼先暂养15 d,期间投喂相同基础饲料,待试验鱼适应饲养环境后开始正式试验。试验共6组,每组3个重复,分别饲养在240 L水族箱中,每个水族箱放养30尾初始体重为(10.71 ±0.16)g的黄金鲫幼鱼。 每天 8∶00、16∶00投喂两次,24 h充气,试验饲养时间60 d,期间水温为20~24℃,溶解氧>6 mg/L。
1.2.2 样品的采集 60 d饲养结束后,停食1 d,从每个水族箱中随机取10尾鱼,测定其体重、体长等,取血浆,然后在冰盘上解剖,取肝胰脏、前肠(第一个会折处以前为前肠)和背白肌等,置于-20℃冰箱中保存备用。
1.3 测定指标
1.3.1 消化性能指标 蛋白酶活力的测定:将存放于-20℃冰箱中的肝胰脏和肠组织样品解冻、剪碎,按1 g组织加入9 mL生理盐水的比例在玻璃匀浆器中匀浆,粗酶液于4℃、5000 r/min离心10 min,取上清液备用,用考马斯亮兰法测定组织匀浆中蛋白质的含量,福林-酚法测定蛋白酶活力,以蛋白酶比活力表示。
蛋白酶活性定义为在30℃、pH 7.0的条件下,1 g食糜组织中蛋白酶1 min水解酪蛋白产生1 μg酪氨酸的酶量定为一个酶活力单位(U)。
钙磷表观消化率的测定:待试验进行到第7天后,从第8天开始,分别在上午、下午投食含有0.5%Cr2O3的饲料,2 h后用虹吸法收粪便于筛网中,选择新鲜、有完整包膜的粪便于清洁烘箱中,65℃干燥、粉碎后装瓶备用,连续收集粪便10 d。
钙的测定采用乙二胺四乙酸二钠络合滴定法;磷的测定采用钼黄分光光度法。其计算公式为:
表观消化率(ADC)=[1-(C1/C2)(N2/N1)]×100;
式中:C1为饲料中Cr2O3的质量分数;C2为粪便中Cr2O3的质量分数,N1为饲料中某元素的质量分数;N2为粪便中某元素的质量分数。
1.3.2 脊柱骨钙、磷指标的测定 将剔除内脏及两侧肌肉的鱼体微波煮熟5 min,去掉鱼头骨及肋骨,将脊椎骨剥离干净,于65℃烘箱内烘24 h,室内放置24 h制备成风干样,分析鱼体和椎骨主要成分。钙、磷测定方法同1.3.1。
1.3.3 血液生化指标的测定 血浆的制备:每组随机取10尾鱼于冰盘内取血,迅速转移至抗凝管中,与抗凝剂充分混合,放入离心机中3000 r/min离心5 min,取上清保存于-20℃冰箱中。
血浆钙、磷、碱性磷酸酶活力的测定采用南京建成生物工程研究所生产的试剂盒测定,测定步骤严格按照说明书进行。
1.3.4 氮、磷排泄的测定 试验第10天开始,每天10∶00和18∶00两次测定水中氨氮和磷酸盐的含量,连续测量7 d。
水中氨氮和磷酸盐的测定采用陆恒生物工程研究所生产的试剂盒测定,测定步骤严格按照说明书进行。
排泄率(U)=V×[(ρ2-ρ20)-(ρ1-ρ10)]/(t×m);
式中:U 表示排泄率,mg/kg·h;V 为代谢缸中水的总体积,L;ρ1、ρ2为初始水样与终末水样的氨氮浓度,mg/L;ρ10、ρ20为初始与终末时空白对照缸中水样氨氮浓度,mg/L;m为试验鱼体质量,kg;t为初始水样与终末水样间隔的时间,h。
1.4 数据处理 采用SPSS 17.0软件进行单因素方差分析,用Duncan’s多重比较分析组间差异显著性程度。试验数据均以“平均值±标准差”表示。
2 结果
2.1 植酸酶对黄金鲫消化的影响 由表2可知,随着各试验组黄金鲫饲料中植酸酶添加量的逐渐升高,肠道蛋白酶活力有升高的趋势,在试验添加到900 U/kg时,肠道蛋白酶比活力较试验1组提高15.78%(P<0.05);且与对照组差异不显著(P>0.05),随着植酸酶添加剂量的继续增加,肠道蛋白酶比活力不再显著升高;肝胰脏蛋白酶比活力受饲料中植酸酶水平的影响不显著。
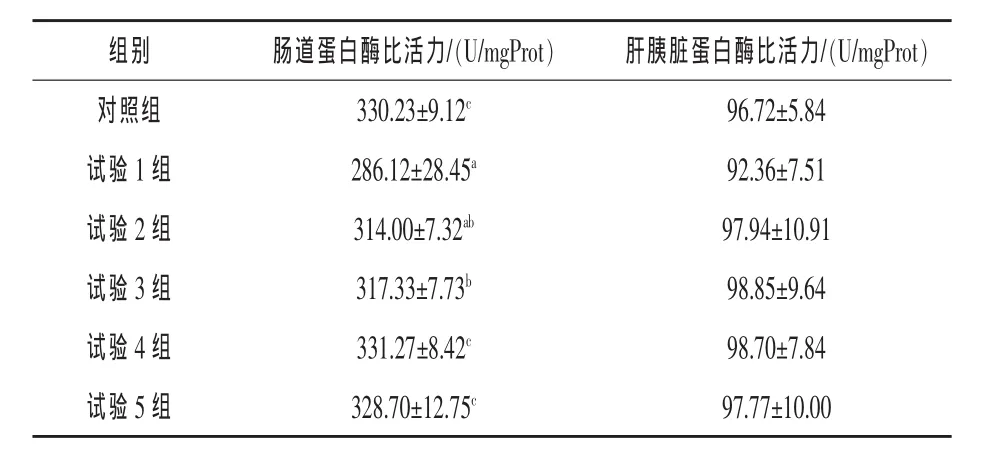
表2 饲料植酸酶水平对黄金鲫蛋白酶比活力的影响
由表3可知,随着各试验组黄金鲫饲料中植酸酶添加量的逐渐升高,钙、磷表观消化率也有升高的趋势,当植酸酶含量添加到900 U/kg时,钙、磷表观消化率较试验1组分别提高6.48%和14.17%(P<0.05),且与对照组差异不显著 (P>0.05),随着植酸酶添加剂量的继续增加,钙、磷表观消化率不再显著升高。

表3 饲料植酸酶水平对黄金鲫钙、磷表观消化率的影响
2.2 植酸酶对黄金鲫钙、磷沉积,血液生化指标和氮、磷排泄的影响 由表4可知,随着各试验组黄金鲫饲料中植酸酶添加量的逐渐升高,骨钙和骨磷有升高的趋势,在试验添加到900 U/kg时,骨钙和骨磷分别较试验1组提高13.23%和4.93%(P<0.05),且与对照组差异不显著 (P>0.05),随着植酸酶添加剂量的继续增加,骨钙和骨磷不再显著升高。

表4 饲料植酸酶水平对黄金鲫脊椎骨钙、磷的影响 %
由表5可知,随着各试验组黄金鲫饲料中植酸酶添加量的逐渐升高,血钙有升高的趋势,在试验添加到600 U/kg时,血钙较试验1组高61.61%(P<0.05),且与对照组差异不显著 (P>0.05),随着植酸酶添加剂量的继续增加,血钙不再显著升高;随着各试验组黄金鲫饲料中植酸酶添加量的逐渐升高,血磷有升高趋势,在试验添加到900 U/kg时,血磷与对照组差异不显著 (P>0.05),随着植酸酶添加剂量的继续增加,血磷显著升高;各试验组黄金鲫血中碱性磷酸酶差异不显著。

表5 饲料植酸酶水平对黄金鲫血钙、血磷和血中碱性磷酸酶的影响
由表6可知,随着各试验组黄金鲫饲料中植酸酶添加量的逐渐升高,氨氮和磷酸盐有降低的趋势,在试验添加到900 U/kg时,氨氮和磷酸盐分别较试验 1组降低 19.68%和 13.47%(P<0.05),且与对照组差异不显著(P > 0.05),随着植酸酶添加剂量的继续增加,氨氮和磷酸盐不再显著降低。
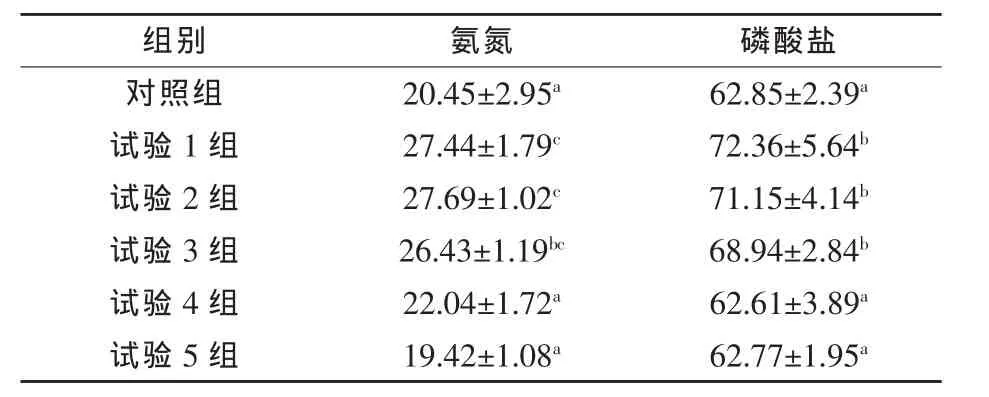
表6 饲料植酸酶水平对黄金鲫氮、磷排泄的影响 mg/kg·h
3 讨论
3.1 植酸酶对黄金鲫消化的影响 水生动物对营养物质的消化通常以化学消化为主,即需要酶的参与。肠道酶活力的高低也代表水生动物消化能力的强弱,特别是在无胃鱼中,肠道酶活力更是重要的评定指标。肠道蛋白酶是鱼类消化酶中最重要的酶。胰腺是水生动物重要的消化腺,主要分泌蛋白酶原,其发育状况直接体现酶原分泌状况。Biswas等(2007)在对红鲷的研究表明,当试验鱼肝胰脏的重量和肝体比显著增加时,试验鱼的生长状况良好。Liebert和Portz(2005)在对尼罗罗非鱼的试验研究也发现,胰蛋白酶是唯一一种能够显著影响试验鱼特定生长率以及饲料利用率的消化酶。本试验在黄金鲫饲料中添加900 U/kg植酸酶显著提高了肠道蛋白酶活性。这与张璐等(2009)对大黄鱼的胃和肠道蛋白酶活性变化的研究一致。这表明在黄金鲫饲料中添加900 U/kg时,能提高黄金鲫的消化能力。
植酸可与磷形成不可溶二价或多价阳离子盐,与铜、钴、锌、锰、镁和铁形成复合物,与蛋白质和氨基酸络合,从而使这些营养物质不能被鱼体利用。加入植酸酶可消除植酸的抗营养作用,提高鱼体对饲料中各营养物质的消化率(姚瑞清等,2008)。本试验在黄金鲫饲料中添加600 U/kg植酸酶显著提高了钙、磷表观消化率。这与程宗佳(2004)在虹鳟的豆粕型饲料中添加不同水平的植酸酶,显著提高了虹鳟的表观消化率的结论相一致。
3.2 植酸酶对黄金鲫钙磷代谢、排泄和沉积的影响 测量植酸酶对血浆中矿物质元素含量的影响是衡量植酸酶改善鱼类矿物质元素吸收利用率最可靠、最敏感的方法之一。低血钙可以引起鱼体骨钙的迅速释放,然而低血磷就不易使鱼体中的骨磷释放出来。因此,对鱼类来讲低血磷就意味着缺磷,会引起骨营养不良,表现为骨灰分占骨总重量的百分比下降。本试验在黄金鲫饲料中添加600 U/kg(钙磷比为1∶1)植酸酶显著提高了黄金鲫血钙含量,但血磷含量变化差异不显著。试验证明饲料中添加植酸酶对试验鱼血浆中钙、磷含量有影响,但差异不显著。血浆碱性磷酸酶(AKP)的活性受血磷浓度影响。血磷浓度降低时,破骨细胞活动增强,使骨盐降解并释放入血,同时也使肾脏对磷的重吸收增强,致使鱼体血液中游离的钙和磷浓度均提高。而血钙升高则引起降钙素分泌,使成骨细胞活动增强,AKP释放量增加,破坏骨组织附近Ca2+和PO43-的过饱和状态,使之沉积。因此,血浆AKP活性升高,说明动物处于缺磷状态。本试验在黄金鲫饲料中添加植酸酶并未显著影响黄金鲫血中碱性磷酸酶的含量,但随着植酸酶的添加量升高,血浆AKP的数值略有下降,表明黄金鲫饲料中添加植酸酶可缓解鱼体缺磷的状态。Sugiura等(1999)用不同含磷量的饲料饲养虹鳟的试验结果也表明,不管是在血浆中还是在肠道中,碱性磷酸酶活性与饲料含磷量多少无关,这与本试验研究的结果基本一致。
氮和磷是造成养殖水体的重要污染物之一。氨氮(NH3-N)和磷酸盐(PO43-)是鱼类排泄磷的主要形式,因此氨氮和磷酸盐的排泄也就常作为对鱼类排泄评价的指标。本试验在黄金鲫饲料中添加900 U/kg植酸酶显著提高了黄金鲫脊椎骨钙、磷含量。主要由于植酸酶降解饲料中植酸时,降低植酸与饲料中蛋白质的络合作用,同时提高鱼体内源性蛋白酶的活性,使蛋白质的消化吸收率提高,从而降低氮的排泄率(刘晓侠,2009)。这一结论与杨雨虹等(2009)对金鳟的研究结果一致。但周秋白(2001)在对大黄鱼和鲈鱼饲料中添加植酸酶的研究得知,植酸酶可以降低试验鱼磷的排泄率,其主要原因可能是鱼体所吸收的磷已超过其需求量,随饲料中磷的不断增加,磷的排泄率也就会有所增加。
脊椎骨钙、磷沉积的测定是评价植酸酶改善鱼体矿物质元素吸收利用的重要指标之一。杨雨虹等(2009)采用喷涂法将植酸酶添加到饲料中,显著提高金鳟的椎骨钙、磷含量同时也促进肌肉中钙、磷的沉积。Jackson等(1996)发现,在斑点叉尾鮰饲料中添加植酸酶能够提高磷在试验鱼骨骼中的沉积,同时排泄物中磷的含量随植酸酶的添加而减少。本试验在黄金鲫饲料中添加900 U/kg植酸酶显著提高了黄金鲫脊椎骨钙含量。这与Fortes(2011)对欧洲鲈的试验结果一致。Nwanna等(2007)对鲤鱼试验研究也表明,随饲料中植酸酶添加量升高,脊椎骨钙沉积量逐渐增加。
4 结论
本试验结果表明,黄金鲫全植物蛋白源饲料中添加适宜植酸酶可提高黄金鲫对磷的利用率,达到对照组(适宜的钙磷比)钙磷代谢的水平。在本试验条件下,植酸酶在黄金鲫全植物蛋白源饲料中的适宜添加量为600~900 U/kg。
[1]陈立侨,堵南山,赖伟,等.水体和配合饲料中钙、磷含量对河蟹生长的影响[J].淡水渔业,1994,24(1):13 ~ 15.
[2]程宗佳.植酸酶在大豆产品型虹鳟鱼饲料中的添加量对干物质和营养成分表观消化率的影响 [J].饲料广角,2004,16:32~34.
[3]方热军,王康宁,印遇龙,等.生长猪植物性饲料可消化磷预测模型的研究[J].动物营养学报,2006,18(2):74 ~ 79.
[4]刘晓侠.植酸酶对鲫鱼生长、营养及磷排放的试验[J].饲料研究,2009,5(3):55 ~ 57.
[5]施安辉,王光玉,李桂杰,等.目前国内外植酸酶研究进展[J].中国酿造,2005,5(3):5 ~ 10.
[6]文华,严安生,高强,等.史氏鲟幼鱼对饲料中磷的需要量[J].水产学报,2008,32(2):242 ~ 248.
[7]杨雨虹,王枫,韩志忠,等.植酸酶对金鳟体成分及金鳟椎骨中钙、磷含量的影响[J].淡水渔业,2009,39:45 ~ 49.
[8]姚瑞清,刘波,吴婷婷,等.植酸酶对奥尼罗非鱼生长磷表观消化率与消化酶活性的影响[J].中国饲料,2008,17:30 ~ 32.
[9]张璐,艾庆辉,麦康森,等.植酸酶和非淀粉多糖酶对鲈鱼生长和消化酶活性的影响[J].水生生物学报,2009,33(1):82 ~ 88.
[10]周秋白.浅谈降低水产养殖饲料的氮、磷污染[J].江西水产科技,2001,9(1):11 ~ 13.
[11]Biswas A K,Kaku H,Ji S C,et al.Use of soybean meal and phytase for partial replacement of fish meal in the diet of red sea bream,Pagrus major[J].Aquaculture,2007,267:284 ~ 291.
[12]Fortes S R.Effects of pretreating a plant-based diet with phytase on diet selection and nutrientutilization in European seabass[J].Aquaculture,2011,319:417 ~ 422.
[13]Jackson L S,Li M H,Robinson E H,et al.Use of microbial phytase in Channel catfish Ictalurus punctatus diets to improve utilization of phytase phosphorus[J].Journal of World Aquacult ure Society,1996,27:309 ~ 313.
[14]Liebert F,Portz L.Nutrient utilization of Nile tilapia fed plant based low phosphorus diets supple mented with graded levels of different sources of microbial phytase[J].Aquaculture,2005,248(1/4):111 ~ 119.
[15]Nwanna L C,Eisenreich R,Schwarz F J,et al.Effect of wet incubation of dietary plant feedstuffs with phytases on growth and mineral digestibility by common carp(Cyprinus carpio L)[J].Aquaculture,2007,271:461 ~ 468.
[16]Sugiura S H,Raboy V,Yong K A,et al.Availability of phosphorus and trace elements in low phytase varieties of barely and corn for rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1999,170(34):285 ~ 296.
