高脂饮食对大鼠骨骼肌脂质中间代谢产物的影响及机制
2015-12-25张雪梅,任路平,宋光耀等
高脂饮食对大鼠骨骼肌脂质中间代谢产物的影响及机制
张雪梅任路平1宋光耀1甘可欣1王超2孔德贤聂倩
(河北省人民医院风湿免疫科,河北石家庄050000)
摘要〔〕目的观察高脂饮食对大鼠骨骼肌脂质中间代谢产物的沉积及脂肪酸代谢中CD36及CPT1的影响。方法雄性SD大鼠随机分为正常对照组、高脂饮食组,分别喂养12 w,分别测定大鼠血糖(BG)及胰岛素(INS)水平;透射电镜观察大鼠骨骼肌线粒体形态变化;GPO-PAP法检测骨骼肌甘油三酯(TG),ELISA试剂盒检测骨骼肌甘油二酯(DAG)、神经酰胺(CER)、长链脂酰辅酶A(LCCoAs)的变化;用RT-PCR和Western 印迹的方法分析大鼠骨骼肌CD36及CPT1的mRNA和蛋白的表达。结果与对照组相比,高脂组大鼠BG及INS水平均明显升高,GIR明显降低(P<0.01);同时骨骼肌组织中TG、DAG、CER及LCCoAs含量明显升高(P<0.01)。与对照组相比高脂组骨骼肌细胞内可见大量大小不等的脂滴分布,线粒体肿胀,内外膜部分融合,线粒体嵴变少变短,部分或全部消失,甚至出现空泡化。与对照组相比,高脂组CD36的mRNA及蛋白的表达明显升高,CPT1的表达明显降低(P<0.05)。结论高脂饮食可引起大鼠胰岛素抵抗及骨骼肌组织中脂质中间代谢产物的堆积,肌内脂质堆积与脂肪酸代谢中关键酶CD36、CPT1表达的变化有关。
关键词〔〕胰岛素抵抗;骨骼肌;神经酰胺;甘油二酯;长链脂酰辅酶A
中图分类号〔〕R587〔
基金项目:国家自然科学基金(30971391)
通讯作者:宋光耀 (1958-),男,博士,主任医师,教授,博士生导师,主要从事内分泌系统及相关疾病研究。
1河北省人民医院内分泌科2河北省人民医院临研中心
第一作者:张雪梅 (1986- ),女,硕士,主要从事内分泌系统及相关疾病研究。
近年来研究认为,骨骼肌组织内脂代谢中间产物如甘油二酯(DAG)、神经酰胺(CER)、长链脂酰辅酶A(LCCoAS)的沉积增加是诱导骨骼肌胰岛素抵抗(IR)的主要原因〔1〕。脂肪酸是人及哺乳动物的主要能源物质,脂肪酸的摄入超出其氧化能力是骨骼肌内脂肪堆积的主要原因〔2〕。脂肪酸转位酶CD36是促进骨骼肌细胞摄取脂肪酸的重要膜蛋白〔3〕。进入细胞中的脂肪酸必须进入线粒体内才能进行代谢。而肉碱脂酰转移酶CPT1在脂肪酸由胞液向线粒体基质的转运中起关键作用〔4〕。本研究探讨高脂饮食对脂代谢相关蛋白基因表达的影响。
1材料与方法
1.1模型建立6周龄雄性SD大鼠30只,体重100~120 g,按随机数字表随机分为对照组及高脂组各15只。对照组进食普通饲料(配方:碳水化合物65.5%、蛋白质24.2%、脂肪10.3%),高脂组进食高脂饲料(配方:碳水化合物20.1%、蛋白质20.1%、脂肪59.8%),分别喂养12 w后行相关指标的测定,之后腹主动脉取血处死大鼠,留取骨骼肌组织。
1.2观察指标及检测方法
1.2.1高胰岛素正葡萄糖钳夹试验2组大鼠喂养12 w后,从每组随机选取大鼠6只,清醒状态下进行正常葡萄糖高胰岛素钳夹实验。在实验前清晨,给予大鼠 3%戊巴比妥钠麻醉,右侧颈动脉和颈静脉插管,管腔内注入肝素抗凝,末端由实芯不锈钢针封闭,由皮下延伸到颈后并固定。经 4~5 d的术后恢复,使动物在清醒、自由活动下进行钳夹试验。术中胰岛素输注速度为4 mU·kg-1·min-1,葡萄糖浓度为30%,具体步骤参见文献〔5〕。计算GIR=稳态时葡萄糖输注速率×葡萄糖浓度×1 000/体重(kg)/60,作为评价大鼠胰岛素敏感性的指标。
1.2.2血清指标的测定2组大鼠喂养12 w,空腹12 h后,腹主动脉取血5 ml,测定空腹血糖(BG,美国 Roche 公司血糖仪)、空腹胰岛素 (INS,ELISA方法,试剂盒由BLUE GENE公司提供)。
1.2.3透射电镜观察肌细胞线粒体形态的变化顺肌丝方向迅速剪取大鼠比目鱼肌放入事先预冷的4%戊二醛中,做好标记,迅速切成1 mm×1 mm×1 mm组织块固定,经1%锇酸后固定,常规清洗、脱水、浸透,Epon812包埋,超薄切片,钳铀染色,日立H-7500型透射电子显微镜观察、照相。
1.2.4骨骼肌组织脂质沉积指标的测定取骨骼肌组织30 mg经氯仿/甲醇抽提甘油三酯(TG)后,加入0.6%NaCl分离水相和有机相,吸取有机相待干燥后溶于100%乙醇500 μl,应用过氧化物耦联 (GPO-PAP)试剂盒测定TG含量 (Roche,USA)。骨骼肌组织中DAG、CER及LCCoAs由相应的ELASIA试剂盒进行测定(试剂盒由BLUE GENE公司提供)。
1.2.5骨骼肌组织CPT1及CD36 mRNA的检测应用实时荧光定量RT-PCR进行检测。采用总RNA抽提试剂(Trizol)提取组织总RNA,用EasyScript First-strand cDNA synthesis SuperMix试剂盒(北京全式金生物技术有限公司提供)逆转录成cDNA,ABI PRISM 7300实时荧光定量PCR仪(Applied Biosystems, USA)进行聚合酶链反应检测骨骼肌CPT1 mRNA及CD36 mRNA的含量。PCR体系20 μl,Syber Green Ⅰ GoTAq®qPCR MAster Mix(PromegA, USA)10 μl,引物2 μl,cDNA 8 μl。反应条件:95 ℃预变性5 min,然后95 ℃变性15 s,58 ℃退火20 s,72 ℃延伸30 s,进行40个循环。数据处理采用7300 Systerm SDS Software 进行数据处理。引物序列,GAPDH正义:TGAACGGGAAGCTCACTG,反义GCTTCACCACCTTCTTGATG;CPT1正义:CCAGGCAAAGAGACAGACTTG;反义GCCAAACC TTAGAGAAGCGAC;CD36正义:AATGAGACTGGGACCATCG;反义CTCCAACACCAAGTAAGACCAT。
1.2.6Western 印迹检测骨骼肌组织CPT1、CD3650 mg骨骼肌组织放入冰水浴中1.5 ml EP管内,每管加入0.5 ml裂解液〔100 mmol/L Tris-HCl, pH8.0, 1 mmol/L乙二醇乙二醚二胺四乙酸(EGTA),1 mmol/L乙二胺四乙酸 (EDTA),1 mmol/L苯甲基磺酰氯 (PMSF),1 mg/L亮抑酶肽,1 mg/L抑肽酶,50 mg/L胰蛋白酶〕,匀浆后分离上清,用考马斯亮蓝试剂盒进行蛋白定量。取50 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿法电转移至硝酸纤维素膜上, 5%脱脂奶粉室温封闭4 h后,分别加入CPT1 、CD36和GAPDH多克隆抗体(Santa Cruz, Europe提供), 4℃ 过夜,充分洗膜后加入HRP标记的二抗室温孵育2 h, 最后用增强化学发光法 (ECL)检测,膜与化学发光底物孵育,经 X胶片曝光显影。用IMAGEJ软件分析 ,以目的蛋白的灰度值除以内参GADPH的灰度值以校正误差 ,所得结果代表某样品的目的蛋白相对含量。每组随机选 6例样本进行蛋白表达分析 ,测定骨骼肌CPT1及CD36的蛋白表达量。
2结果
2.112 w后2组大鼠生化指标比较高脂组血糖及胰岛素水平较对照组明显升高(P<0.01),葡萄糖输注率(GIR)明显低于对照组(P<0.01)。见表1。
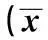

组别BG(mmol/L)INS(mU/L)GIR(mg·kg-1·min-1)对照组5.6±0.5285±3.229.8±2.3高脂组7.5±0.41)41.6±3.61)17.2±2.41)
与对照组比较:1)P<0.01;下表同
2.2骨骼肌组织脂质沉积情况与对照组相比,大鼠骨骼肌组织中TG、DAG、CER及LCCoAs含量均明显增加(P<0.01)。见表2。
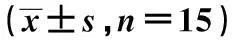

组别TG(μmol/g)DAG(nmol/g)CER(nmol/g)LCCoAs(nmol/g)对照组9.5±0.8210.5±3066.2±11.22.1±0.3高脂组27.8±1.71)568.0±45.31)132.3±8.31)6.2±0.71)
2.3骨骼肌细胞线粒体形态改变与对照组相比高脂组骨骼肌细胞内可见大量大小不等的脂滴分布,线粒体肿胀,内外膜部分融合,线粒体嵴变少变短,部分或全部消失,甚至出现空泡化(图1)。
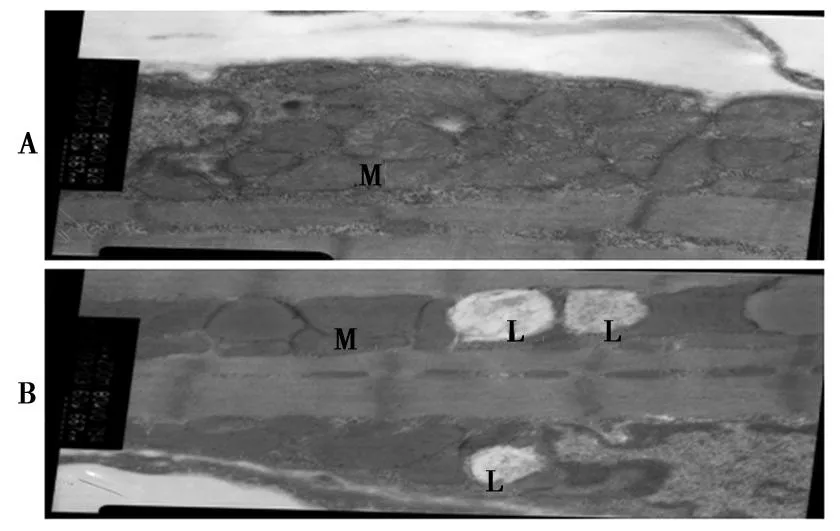
A:对照组,B:高脂组,M:线粒体,L:脂滴 图1 骨骼肌线粒体电镜结果(×15 000)
2.4骨骼肌组织CPT1及CD36的表达高脂喂养8 w后与正常对照组(0.832±0.102、0.448±0.069)相比,高脂组骨骼肌组织中CD36(1.173±0.162,0.763±0.070)在mRNA,蛋白水平的表达均明显升高(P<0.01),CPT1在mRNA(对照组vs高脂组:1.002±0.120 vs 0.285±0.058)及蛋白(对照组vs高脂组:0.989±0.076 vs 0.569±0.069)水平的表达均明显降低(P<0.05)。
3讨论
高脂饮食喂养可以导致大鼠血糖及胰岛素水平明显升高,葡萄糖输注率明显下降,诱导大鼠产生胰岛素抵抗。同时伴随着骨骼肌组织线粒体形态的变化及骨骼肌组织中脂质及其中间代谢产物的累积。而在脂肪酸转运及代谢过程中的关键酶CD36的表达明显升高,CPT1的表达明显下降。
近年来,有学者提出2型糖尿病中糖代谢紊乱的根源为脂代谢的异常,脂毒性与胰岛素抵抗有明确的相关性,以往研究认为大量脂肪在肌肉、肝脏和β细胞等组织的积聚为2型糖尿病发病的重要因素。骨骼肌是机体利用葡萄糖的主要场所。在胰岛素的刺激下,骨骼肌吸收了机体葡萄糖总摄取量的 75%以上。因此骨骼肌对葡萄糖的摄取、利用障碍是机体发生胰岛素抵抗的重要发病机制。近期研究表明,活性的脂代谢中间产物如:LCCoAs、DAG、CER等的含量与肌细胞对胰岛素的敏感性成负相关,是诱导骨骼肌 IR 的主要原因〔1〕。
胰岛素刺激组织摄取利用葡萄糖是通过胰岛素受体-胰岛素受体底物1-磷脂酰激醇-3激酶-蛋白激酶(PK)B等一系列信号传导过程完成的,最终使葡萄糖转运蛋白(GLUT)4转移到细胞膜,大量GLUT4的膜转移可加速葡萄糖摄入到细胞内。胰岛素信号转导通路中任一步骤的异常都可能最终阻碍骨骼肌转运葡萄糖,从而引起IR〔6〕。LCCoAs是细胞内脂肪酸存在的活性形式,它可转化成DAG及神经酰胺,DAG可以通过激活PKC抑制胰岛素受体和胰岛素受体底物酪氨酸激酶的活性进而干扰胰岛素信号传导系统,导致IR形成〔7〕。而CER主要通过抑制胰岛素受体底物-1信号传导通路的下游PKB/AKT的磷酸化来发挥作用〔8〕。近期研究显示,CER抑制剂或者催化CER代谢为葡萄糖神经酰胺的物质能够改善IR〔9〕。对Zucker糖尿病肥胖大鼠进行二甲双胍和运动锻炼的干预时发现,胰岛素敏感性改善的同时伴随着肌肉组织中DAG和CER含量的减少〔3〕。
脂肪酸的摄入超出其氧化能力通常被认为是骨骼肌内脂肪堆积的主要原因。高脂饮食喂养可以导致大鼠血液中脂肪酸含量增加,短链及中链脂肪酸可直接通过被动转运进入细胞膜,长链脂肪酸(LCFA)的摄入需要膜上蛋白质的介导。脂肪酸转位酶CD36是促进骨骼肌细胞摄取长链脂肪酸的重要膜蛋白。长链脂肪酸在细胞内转变为活性形式LCCoAs后在关键酶肉碱脂酰转移酶(CPT)-1的作用下进入线粒体最终被骨骼肌氧化利用。
而线粒体是三大营养物质代谢的最终场所,线粒体功能的损害被认为是胰岛素抵抗发病机制的关键因子。除了功能的改变外,线粒体形态在胰岛素抵抗状态下也发生了改变。人类 2型糖尿病患者或者肥胖个体骨骼肌线粒体体型较小 ,而且呈现较大空泡〔10〕。WBN /Kob糖尿病大鼠表现为线粒体肿胀、线粒体嵴空化〔11〕。
在本次研究中,我们观察到高脂喂养12 w后,MFN2表达量明显下降的同时伴随着CPT1表达的下降,从而造成已转移进入骨骼肌细胞内的脂质及其中间代谢产物不能被进一步转移进入线粒体进行β氧化,进而积聚在胞液中,损害了胰岛素信号通路的一个或多个环节,干扰了葡萄糖的转运,造成血糖升高,胰岛素抵抗。同时我们发现高脂饮食诱导大鼠发生胰岛素抵抗的同时伴随着线粒体超微结构的损伤,线粒体形态的变化与功能的改变密切相关。线粒体的损伤会进一步加重骨骼肌组织脂质代谢的紊乱,脂质及其中间代谢产物在骨骼肌组织中堆积又加重胰岛素抵抗,形成恶性循环。
4参考文献
1Bergman BC,Perreault L,Hunerdosse DM,etal. Increased intramuscular lipid synthesis and low saturation relate to insulin sensitivity in endurance-trained athletes〔J〕. J Appl Physiol,2010;108(5):1134-41.
2Abumrad N,Harmon C,Ibrahimi A. Membrane transport of long-chain fatty acids: evidence for a facilitated process〔J〕. J Lipid Res,1998;39(12):2309-18.
3Smith AC,Mullen KL,Junkin KAetal. Metformin and exercise reduce muscle FAT/CD36 and lipid accumulation and blunt the progression of high-fat diet-induced hyperglycemia〔J〕.J Physiol Endocrinol Metab,2007;293(1):E172-81.
4Sebastian D,Herrero L,Serra D,etal. CPT I overexpression protects L6E9 muscle cells from fatty acid-induced insulin resistance〔J〕. Am J Physiol Endocrinol Metab,2007;292(3):E677-86.
5Kraegen EW,James DE,Bennett SP,etal. In vivo insulin sensitivity in the ratdetermined by euglycemic-clamp〔J〕.Am J Physiol,1983;245(1):E1-7.
6Mohammad A,Sharma V,McNeill JH. Vanadium increases GLUT4 in diabetic rat skeletal muscle〔J〕. Mol Cell Biochem,2002;233(1-2):139-43.
7Turban S,Hajduch E. Protein kinase C isoforms: mediators of reactive lipid metabolites in the development of insulin resistance〔J〕. FEBS Lett,2011;585(2): 269-74.
8Penkov DN,Egorov AD,Mozgovaya MN. Insulin resistance and adipogenesis: role of transcription and secreted factors〔J〕. Biochemistry,2013;78(1):8-18.
9Holland WL,Brozinick JT,Wang LPetal. Inhibition of ceramide synthesis ameliorates glucocorticoid-,saturated-fat-,and obesity-induced insulin resistance〔J〕. Cell Metab,2007;5(3):167-79.
10Kelley DE,He J,Menshikova EV,etal. Dysfuncti on of mitochondria in human skeletal muscle in type 2 diabetes〔J〕. Diabetes,2002;51(10): 2944-50.
11Bach D,Pich S,Soriano FX,etal. Mitofusin2 determines mitochondrial net work architecture and mitochondrial metabolism: a novel regulatorymechanism altered in obesity〔J〕. J Biol Chem,2003;278(19): 17190-7.
〔2012-11-17修回〕
(编辑曲莉)
