经济林下种植示范牛大力的总黄酮含量跟踪分析
2015-12-25钟益宁吴诗云覃凤梅谭佩珍刘华青黄泽金
钟益宁,柳 欢,吴诗云,张 焱,覃凤梅,谭佩珍,刘华青,黄泽金
(1.广西中医药大学,广西南宁 530299;2.防城港市万景林业有限公司,广西防城港 538021)
经济林下种植示范牛大力的总黄酮含量跟踪分析
钟益宁1,柳 欢1,吴诗云1,张 焱1,覃凤梅1,谭佩珍1,刘华青2,黄泽金2
(1.广西中医药大学,广西南宁 530299;2.防城港市万景林业有限公司,广西防城港 538021)
摘要[目的]建立经济林下示范种植牛大力药材的总黄酮含量跟踪测定的比色方法。[方法]以芦丁为对照品,利用盐酸镁粉显色法对3批次采集的牛大力药材总黄酮的含量进行测定,跟踪分析其总黄酮含量的变化。[结果]在最大吸收533 nm波长下进行测定,芦丁在浓度0.5~1.8 mg/ml范围内呈现良好的线性关系,平均加样回收率为91.30%~93.12%,RSD为0.92%~1.27%;3批次总黄酮含量分别为1.97(第Ⅰ批)、2.11(第Ⅱ批)和2.25 mg/g(第Ⅲ批);随着生长时间延长,牛大力药材总黄酮含量有较大增加。[结论]盐酸镁粉显色测定操作简便快速,显色稳定,具有较好的精密度、重现性,测定牛大力总黄酮含量结果准确、可靠,但也存在灵敏度低、对照品浓度高的缺点。
关键词牛大力;总黄酮;盐酸镁粉法;跟踪分析;经济林
牛大力,别名山莲藕、大力薯等,为豆科崖豆藤属植物美丽崖豆藤(Millettia specisoaChamp.)的根,具有舒筋活络、润肺滋肾、清热止咳等功效[1],用于治疗腰肌劳损、肺热肺虚咳嗽、肺结核、慢性支气管炎、肝炎等,主要分布在福建、广西、广东等地。牛大力作为一种药食同源的植物,需求与日俱增,广泛被药企加工成众多中成药,并不断开发新产品,提高其保健作用与产品附加值[2]。牛大力根中含多种黄酮化合物,已经报道分离鉴定了13个黄酮类化合物,如异甘草素(4,2′,4′-三羟基查耳酮)、芒柄花素(7-羟基-3-(4-甲氧基苯基)色酮)、3,4,2′,4′-四羟基查尔酮、4′-羟基-7-甲氧基二氢黄酮、3′,7-二羟基-2′,4′-二甲氧基异黄酮等[3-7]。鉴于牛大力含有多种黄酮化合物会对其药理、药效作用产生重大影响,很有必要对其提取分离纯化、含量测定以及相关的药理作用和机制进行深入研究[8-9]。目前,黄酮含量测定方法主要有分光光度法、高效液相色谱法、毛细电泳法、超临界流体色谱法以及薄层扫描法等[10-12],分光光度法作为测量黄酮的经典方法,操作简单易行、结果准确可靠,在黄酮的研究中得到了广泛的应用。文献调研发现,目前仅王呈文等[8]报道了采用分光光度法及硝酸铝盐显色测定牛大力的黄酮含量,笔者在此进行了一定改进,采用盐酸镁粉显色法对处于生长期中的3批次采集于经济林下种植的牛大力药材的总黄酮含量进行测定,跟踪分析其总黄酮含量的变化,为进一步完善牛大力药材的质量评价指标、推广林下种植牛大力等药材提供理论参考依据。
1材料与方法
1.1材料
1.1.1药材。鲜牛大力药材种植在防城港地区“经济林下种植药材牛大力、巴戟天和黑老虎示范基地”,2012年秋冬种植,于2014年10月(第Ⅰ批)、2015年2月(第Ⅱ批)和6月(第Ⅲ批)分3批采摘,经广西中医药大学滕建北教授鉴定为美丽崖豆藤(Millettia specisoaChamp.)的根。
1.1.2主要仪器。电子分析天平(北京赛多利斯科学仪器有限公司);8453紫外可见分光光度计(美国安捷伦);RE-52系列旋转蒸发仪(上海亚荣生化仪器厂);TGL-16G离心机(上海安亭科学仪器厂);KQ5200B超声波清洗仪(昆山市超声仪器有限公司);KQ-B玻璃仪器气流烘干器(巩义市予华仪器有限责任公司);HH-S恒温水浴锅(巩义市英峪予华仪器有限责任公司);DHG-9023A电热恒温鼓风干燥箱(上海精宏试验设备有限公司)。
1.1.3主要试剂。芦丁对照品(购于上海如吉生物科技);95%乙醇、亚硝酸钠、硝酸铝、氢氧化钠、镁粉等均为分析纯,水为蒸馏水。
1.2方法
1.2.1对照品溶液的制备。精密称取芦丁标准品10mg,75%的乙醇超声溶解,定容至 10ml量瓶中即得浓度为1.0mg/ml,备用。
1.2.2供试品溶液的制备。取2014年10月、2015年2月、6月采集的3批次新鲜、干净牛大力1.0kg,切片,烘箱80 ℃烘干,恒重称量分别得到493.5、499.0、503.5g,分别粉碎成粗粉,精密称取质量各150g,按照m(牛大力,g)∶V(EtOH,ml)=1∶5,75%乙醇回流提取3次,第1次2h、第2次1.5h、第3次1h,滤过,合并滤液定容100ml即得,备用。
1.2.3最大吸收波长的确定。精密吸取对照品溶液3.0ml和样品溶液 3.0ml,分别置于加有镁粉300mg的具塞试管中,将试管置冷水浴(约15 ℃)中,缓慢滴加浓盐酸3.0ml并不时振摇试管,加75%乙醇补足至10ml,摇匀,置沸水浴中加热60min,取出,迅速冷却至室温,以相应试剂为空白,以吸光度为纵坐标、吸收波长(nm)为横坐标,于400~700nm进行紫外扫描,得到样品溶液与对照品溶液的紫外吸收光谱,确定最大吸收波长。
1.2.4方法学考察。
1.2.4.1标准曲线的绘制。精密吸取芦丁1.0mg/ml对照品溶液0.5、0.7、0.9、1.1、1.3、1.5ml分别置于有镁粉的具塞刻度管中,按步骤“1.2.3”的方法显色,以试剂空白为参比溶液,在确定的最大吸收波长处测定其吸光度。以芦丁取样量为横坐标、吸光度为纵坐标,绘制标准曲线。
1.2.4.2稳定性试验。取样品溶液3.0ml置于有镁粉的具塞刻度管中,按步骤“1.2.3”的方法显色,每隔10min测定一次吸光度,共测7次,计算RSD值。
1.2.4.3精密度试验。精密吸取芦丁标准液1.0mg/ml5份,每份3.0ml,置于有镁粉的具塞刻度管中,按“1.2.3”的方法显色,测定吸光度,计算RSD值。
1.2.4.4重复性试验。取样品溶液5份,每份3.0ml置于有镁粉的具塞刻度管中,按步骤“1.2.3”的方法显色,测定吸光度,计算RSD值。
1.2.4.5加样回收试验。分别取3批样品溶液各3.0ml,每批3份,置于有镁粉的具塞刻度管中,分别加入稀释为0.5mg/ml的芦丁标准品溶液0.5、1.0、1.5ml,按步骤“1.2.3”的方法显色,测定吸光度,并计算RSD值。

2结果与分析
2.1最大吸收波长的确定由图1可见,样品和芦丁对照品在533nm处有吸收,两者的吸收波长较为接近,且峰形较为一致,使用此法测定牛大力总黄酮的含量较为理想。
2.2方法学考察
2.2.1标准曲线的绘制。按“1.2.4.1”方法操作,测得的吸光度分别是0.306 8、0.423 2、0.518 5、0.623 1、0.730 9、0.836 6。以芦丁标准液浓度为横坐标、吸光度为纵坐标绘制标准曲线如图2所示,计算得线性回归方程为y=0.525 2x +0.047 9(R2=0.999 6),表明芦丁标准液在0.5~1.8mg/ml浓度范围内呈现良好的线性关系。
2.2.2稳定性试验。按“1.2.4.2”方法操作,结果表明(表1),样品溶液用盐酸镁粉显色在测定时间1h内比较稳定,所以在试验操作过程中应严格控制时间,应在1h内完成测定。
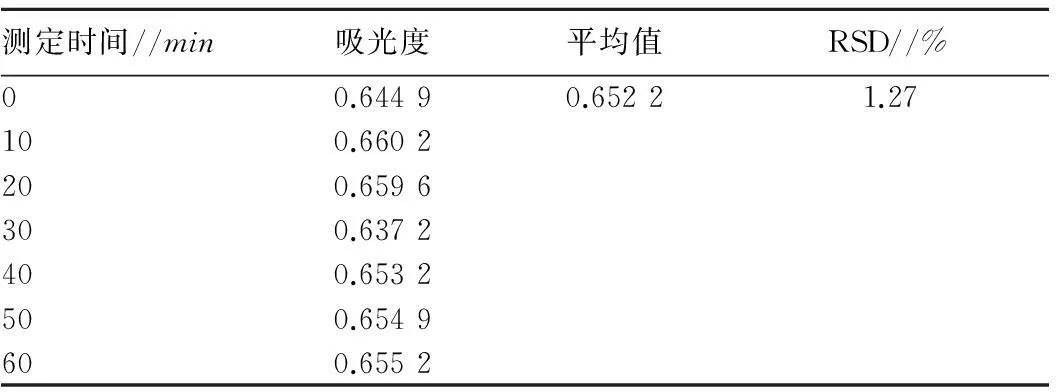
表1 盐酸镁粉法稳定性试验结果
2.2.3精密度试验。按“1.2.4.3”方法操作,结果表明(表2),5次测定的吸光度平均值为0.205 5,RSD值为1.02%,小于2%,可见此法精密度良好。

表2 盐酸镁粉法精密度试验结果
2.2.4重复性试验。按“1.2.4.4”方法操作,结果表明(表3),5次测定的吸光度平均值为0.649 6,RSD为1.48%,可见样品溶液用此显色方法测定重复性均良好。

表3 盐酸镁粉法重复性试验结果
2.2.5加样回收试验。加样回收试验测得吸光度分别是0.527 2、0.637 7、0.767 7(第Ⅰ批),0.534 3、0.647 4、0.777 9(第Ⅱ批),0.532 3、0.648 7、0.789 5(第Ⅲ批),3批的平均回收率分别为91.30%、92.69%、93.12%,RSD分别为1.02%、0.92%、1.27%(表4)。按照相关资料总黄酮的回收率应在80%~120%,上述数据表明试验回收率符合要求,表明该方法准确、可靠,可用于牛大力药材中总黄酮的含量测定;但标准品使用的浓度比较大,比较浪费标准品。

表4 盐酸镁粉法加标回收试验结果
2.3样品含量测定由表5可见,不同的采摘时间,牛大力黄酮含量不同,且随着生长时间延长,黄酮含量有所增加,幅度还比较大,这可能是药材生长时间越长植物体内积聚的黄酮类也越多的原因。

表5 盐酸镁粉显色法测定黄酮含量(n = 2)
3结论与讨论
该研究以芦丁为对照品,采用盐酸镁粉比色法跟踪测定3批次采集于林下种植示范基地处于生长期的牛大力黄酮含量,评价牛大力的质量指标,为进一步推广林下种植牛大力、巴戟天等药材提供理论参考依据。该试验结果表明,在最大吸收533nm波长下进行测定,芦丁在浓度0.5~1.8mg/ml范围内呈现良好的线性关系,平均加样回收率在91.30%~93.12%,RSD在0.92%~1.27%;3批次总黄酮含量分别为1.97(第Ⅰ批)、2.11(第Ⅱ批)和2.25mg/g(第Ⅲ批);对鲜牛大力药材进行干燥后,随着牛大力药材的生长时间延长,得到的干药材质量增加,消除试验误差后,这可能与植物生长的时间有关,时间越长,植物越老,成数也越高;盐酸镁粉比色法能够快捷、简便、准确地测定牛大力的总黄酮含量,可作为牛大力黄酮指标含量的常用测定方法,但芦丁标准品使用的浓度比较大,比较浪费标准品,这是该法不足的地方。
前期对硝酸铝盐显色法进行了探索,发现该法存在对照品与样品最大吸收峰形和波长不一致的问题,可能会影响测定的结果。所以该研究进行了改进,采用了盐酸镁粉比色法进行牛大力黄酮含量测定,效果良好。
参考文献
[1]江苏新医学院.中药大辞典[S].上海:上海科学技术出版社,1986:194.
[2]中华人民共和国卫生部.中华人民共和国卫生部药品标准中药成方制剂:1~20 分册[S].北京:首都师范大学出版社,1998.
[3]YINT,LIANGH,WANGB,etal.ANewflavonolglycosidefromMillettia speciosa[J].Fitoterapia,2010,81:274-275.
[4]王春华,王英,王国才,等.牛大力的化学成分研究[J].中草药,2008,39(7):972-975.
[5]宗鑫凯,赖富丽,王祝年,等.牛大力化学成分研究[J].中药材,2009,32(4):520-521.
[6]王呈文,陈光英,宋小平,等.牛大力的化学成分研究[J].中药材,2009,45(11):1515-1520.
[7]王茂媛,赖富丽,王建荣,等.牛大力茎的化学成分研究[J].天然产物研究与开发,2013,25(1):53-55,91.
[8]王呈文,纪明慧,舒火明,等.牛大力总黄酮提取工艺及不同萃取物的抗氧化活性研究[J].化学研究与应用,2013,25(5):713-717.
[9]郑元升.牛大力多糖的提取及其药理活性研究[D].广州:暨南大学,2009.
[10]党晓芳,曹飒丽,祁娟娟,等.鬼箭羽总黄酮含量测定方法的建立[J].中国实验方剂学杂志,2014,20(9):96-98.
[11]林乐维.不同生长期高良姜中总黄酮含量测定[J].亚太传统医药,2014,10(7):17-18.
[12]刘嘉琪,杨晶,周辉,等.不同产地土茯苓中总黄酮含量定量分析[J].辽宁中医药大学学报,2014,16(4):57-58.
中图分类号S567
文献标识码A
文章编号0517-6611(2015)30-044-03
基金项目广西科技攻关计划项目(桂科重1298001-2-7);广西高校科技创新能力提升工程专项项目(70-ZJGX201401004);2014年博士研究生教育发展项目(050140002);校级重大课题(ZDA2012003)。
作者简介钟益宁(1967-),男,广西钟山人,副教授,博士,从事中药药效物质基础研究。
收稿日期2015-09-16
TrackandAnalyseontheFlavonoidsContentfromMillettia specisoaChamp.PlantedinEconomicalWoodlands
ZHONGYi-ning,LIUHuan,WUShi-yunetal(GuangxiUniversityofTraditionalChineseMedicine,Nanning,Guangxi530299)
Abstract[Objective]The flavonoids content of Millettia speciosa Champ. was determined to analyze the content changed that planted in economical woodlands.[Method]Using rutin as the standard sample,three batch growing vigorously Millettia speciosa Champ herbs were collected and analyzed the change of flavonoids content with HCl-Mg colorimetry method.[Result]Under the maximum 533 nm absorption wavelength, rutin had a liner relationship with absorbance in the range of 0.5-1.8 mg/ml,the average recovery was 91.3%-93.12% with RSD of 0.92%-1.27%.The flavonoids content of Millettia speciosa Champ.were 1.97(Ⅰ batch), 2.11(Ⅱ batch),2.25 mg/g (Ⅲbatch).The flavonoids content increased considerably with growth period prolonged.[Conclusion] HCl-Mg colorimetry method was simple and easy, color stability, high sensitivity and little interference.The determination results of flavonoids content from Millettia speciosa Champ.were accurate and reliable.However, there were two faults of low sensitivity and higher reference substance concentration.
Key wordsMillettia specisoa Champ.;Flavonoids;HCl-Mg colorimetry method;Track and analyse;Economical woodlands
