酒糟提取物菲汀制备植酸的工艺化研究
2016-01-07田小海崔洪艳
田小海,崔洪艳
(长春医学高等专科学校,吉林长春 130031)
酒糟提取物菲汀制备植酸的工艺化研究
田小海,崔洪艳
(长春医学高等专科学校,吉林长春 130031)
摘要[目的]优化从酒糟提取物菲汀制备植酸的工艺条件。[方法] 通过732#阳离子交换树脂及717#阴离子交换树脂吸附制备稀植酸。采用活性炭脱色,真空减压浓缩的方法制备精品植酸。[结果] 制备植酸工艺条件:732#阳离子交换树脂的最佳流速为375 ml/h,最大进样量为0.5 ml;717#阴离子交换树脂的最佳流速为250 ml/h,最大进样量为0.5 ml。活性炭脱色的最佳条件为:0.5 ml/min,温度为60 ℃。真空减压浓缩的温度为50 ℃。[结论]研究确定了通过离子交换树脂法由酒糟提取物菲汀制备植酸的最佳工艺条件,可为工业化生产制备大量植酸提供重要的依据。
关键词酒糟;菲汀;植酸;制备工艺
植酸的化学名称为肌醇六磷酸酯,即环己六醇六磷酸酯[1],鳞的含量可达50%~80%[2],是肌醇二、三、四、五和六磷酸酯的混合物。植酸用途十分广泛[3],可用作食品工业的保鲜剂[4]、防腐剂[5]、抗氧化剂[6]、稳定剂和发酵促进剂,也可用在水处理上。正因用途广泛,植酸的生产越来越受到国内外研究者及一些企业的关注[7]。笔者旨在通过研究酒糟提取物菲汀利用离子交换树脂法制备植酸的工艺条件,从而对酒糟的利用找到突破途径。
1材料与方法
1.1材料
1.1.1主要仪器。多循环水式真空泵、干燥箱、恒温磁力搅拌器、TDL-5离心机、751分光光度计和PHS-3型酸度计、732#离子交换树脂、D301R(717)阴离子交换树脂、布氏漏斗、抽滤瓶、比色管、天平。
1.1.2主要试剂。盐酸、EDTA、硫氰酸氨、酚酞、二甲酚橙、钼酸铵、磷酸二氢钾、抗坏血酸、硝酸银、氯化铵、硫代硫酸钠、铬黑T、重铬酸钾指示剂、淀粉指示剂、植酸标准品,均为分析纯药品,sigma公司。
1.2方法
1.2.1试验原理和工艺流程。植酸制备原理:C6H8O24P6Mg4Ca2+12H+→C6H20O24P6+4Mg2++2Ca2+。菲汀在酸性条件下水解,金属离子(镁离子等)游离,而植酸会大部分溶解在稀酸中,通过氢型阳离子交换树脂与碱作用生成水。
通过717#阴离子交换树脂使阴离子(SO42-等)与离子交换树脂中的氯发生完全交换生成水,即可得到粗品植酸,经脱色、干燥等过程可制备成高纯度植酸。
1.2.2粗品植酸制备方法。静态法测定732#氢型阳离子交换树脂交换容量:RH+NaOH→RNa+H2O。精确称取事先处理好并抽干的732#氢型阳离子交换树脂2 g,105 ℃烘干至恒重,测量含水量:
w%=(m1-m2)×100/m1
式中,m1为烘前树脂重量,m2为烘后树脂重量。
式中,m为湿树脂质量(g),w为树脂含水量(%),c1为NaOH标准溶液的浓度(mol/L),c2为HCl标准溶液的浓度(mol/L),V2为0.1 mol/L HCl标准溶液的用量(ml)。
动态法测定717#阴离子交换树脂交换容量:RN(CH3)3OH+HCl→RN(CH3)3Cl+H2O。精确称取事先处理好并抽干的717#阴离子交换树脂2 g,105 ℃烘干至恒重,测量含水量:
w%=(m1-m2)×100/m1
式中,m1为烘前树脂重量,m2为烘后树脂重量。
总交换容量(mol/g)=10VC/m(1-w)
式中,V为0.1 mol/L的AgNO3的用量(ml),C为AgNO3的浓度(mol/L),m为湿树脂重量(g),w为湿树脂含水量(%)。
1.2.3精品植酸制备方法。脱色:将活性炭装入玻璃柱中,并保证无气泡产生。对稀植酸溶液加热到60 ℃后过活性炭柱,控制流速0.5 ml/min,收集稀植酸溶液得到白色溶液,即完成脱色。
真空蒸发浓缩:将植酸溶液装入真空减压浓缩瓶蒸发浓缩至膏状物,60 ℃烘箱中干燥即可得纯品。
1.2.4植酸质量的检测方法。
1.2.4.1蛋白质检测。氨态氮的测定[8](1141-1145):植酸含氮不利于蛋白质含量的测定,影响中和剂的使用,不利于其溶解。用浓H2SO4消化时,含氮有机化合物分解出氨,氨与H2SO4化合生成硫酸铵。用标准酸溶液进行滴定,准确测定氨量,从而计算出含氮量。
Bradford法测蛋白质的含量[9](255-257): 蛋白质很容易使目的产物变质,在提取菲汀的过程中确定最佳的酸浸pH,防止酸性蛋白质溶解在菲汀溶液中。该方法采用考马斯亮蓝G250(Coomassile brilliant blue G250,简称CBB-G250)作为染色物质测定蛋白质的含量。
标准曲线的制作:取6支试管,按照表1操作。
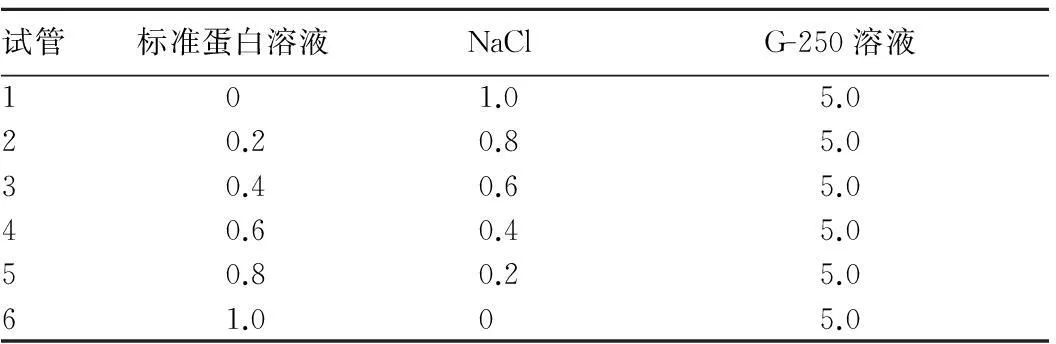
表1 蛋白质标准曲线 ml
配制1 mg/ml的牛血清白蛋白溶液,将得到的植酸产品配制成1 mg/ml的溶液。混匀,放置2 min,于595 nm处比色,记录光密度值(OD值)。以蛋白质含量C为横坐标,光密度值A(OD值)为纵坐标,绘制标准曲线,得到线性方程A=0.004 6C+0.001 2(r=0.999)。
1.2.4.2硫酸根离子检测。准确称取样品0.5 g于比色管中,加水至17.0 ml,以20%的氨水调pH至7,在另一支比色管中加入0.5 ml标准液。于样品管和标准管中各加入2.0 mol/L的硫酸溶液2.5 ml,0.1 mol/L的BaCl溶液5.0 ml,静置10 min后比浊,从而测定出硫酸根的含量。
1.2.4.3钙离子检测。精确称取0.5 g样品于比色管中,加水至17.0 ml,以20%的氨水调pH至7,在另一支比色管中加入0.5 ml钙标准液。在样品管和标准管中各加入1.0 ml冰醋酸溶液,5.0 ml草酸铵溶液,加水至刻度,放置10 min后进行比浊,从而测定出植酸中钙的含量。
1.2.4.4铁离子检测。准确称取样品0.5 g于比色管中,加水至17.0 ml,以20%的氨水调pH至7,在另一支比色管中加入0.5 ml标准液。于样品管和标准管中各加入0.1 mol/L的NaOH溶液3.0 ml,静置10 min后比浊,从而测定出铁离子的含量。
1.2.4.5氯离子检测。准确称取样品0.5 g于比色管中,加水至17.0 ml,以20%的氨水调pH至7,在另一支比色管中加入0.5 ml标准液。于样品管和标准管中各加入2.0 mol/L的硝酸溶液2.5 ml,0.1 mol/L的AgNO3溶液5.0 ml,静置10 min后比浊,从而测定出氯化物的含量。
1.2.4.6磷检测[10]。采用EDTA标准溶液滴定的方法检测植酸中磷的含量。
P2O5(%)=[(V空-V样)×C×0.152 1×100]/(50m/250)
植酸(mmol/g)=[(V空-V样)×C×5/14]/(50m/250)
式中,V空为空白试验时消耗EDTA标准溶液的体积(ml);V样为样品消耗EDTA标准溶液的体积(ml);C为EDTA标准溶液的浓度(mol/L);m为样品质量(g);0.152 1为1 mol/L三氯化铁相当于0.152 1 g P2O5(1 g植酸相当于0.645 5的P2O5);5/14为植酸与三氯化铁络合的摩尔比。
1.2.4.7水分检测。精确称取1.0 g植酸(w1),放入100 ℃(≤105 ℃)烘箱中烘干恒重,于干燥器中冷却到室温,在天平上称重(w2)。水分含量(%)=[(w1-w2)/ w1]×100。
1.2.4.8外观检测。采用目测法。
1.2.4.9植酸的色谱分析。用Omnipac pax-100 column分离植酸;洗脱剂:200 mol/L的NaOH,水(18 mΩ)-异丙醇的体积比为1∶1;检测:自动检索系统控制化学传导率。
2结果与分析
2.1粗品植酸制备静态法测定732#氢型阳离子交换树脂交换容量:测得含水量为37.00%,交换量为1.73×10-3mol/g。此方法提取菲汀的分子量为850 g/mol。确定了最佳流速为375 ml/h,最大进样量为0.5 ml。
动态法测定717#阴离子交换树脂交换容量:测得含水量为37.67%,交换量为1.123×10-3mol/g。将经过732#阳离子柱的菲汀溶液过717#阴离子柱。确定了最佳流速为250 ml/h,最大进样量为0.5 ml。
2.2精品植酸制备结果按照“1.2.3”的制备方法得出精品植酸,菲汀水解为植酸转化率 1.2%。
2.3植酸质量检测
2.3.1蛋白质检测。植酸中蛋白质浓度测定见图1。
氨态氮的测定[8](1141-1145):无颜色变化,表明消化液中并未产生氨。植酸是一种不含氮的环状六元醇,植酸中不含有氮有利于植酸中蛋白质含量的测定,不影响中和剂的使用和植酸的溶解。
Bradford法测蛋白质的含量[9](255-257):测得植酸溶液的OD值为0,表明在植酸溶液中不含有蛋白质。未检测到蛋白质,符合药典标准不含蛋白质。
蛋白质是一种很容易变性和变质的生物大分子,在分离提取其他物质的过程中一定要除去混在其中的蛋白质,否则很容易使目的产物变质。在提取菲汀的过程中确定最佳的酸浸pH,防止酸性蛋白质溶解在菲汀溶液中。
2.3.2硫酸根离子检测。硫酸根含量为0.003%,一次摄入硫酸根的含量过高时会迅速结合重金属,在人体内形成沉积,长时间的重金属盐的沉积将会使人发生慢性中毒的现象,该试验测定结果符合药典标准硫酸含量0.006%以下。
2.3.3钙离子检测。试验测得植酸中含钙量为23%。该试验中钙的含量适中,符合药典中规定钙的含量≥12%。
2.3.4铁离子检测。试验测得铁离子的含量为0.000 3%,符合药典中规定的0.000 5%以下。铁离子含量过高时会造成铁中毒,该试验中铁的含量适中,长期给药后并未对小鼠造成毒害作用。
2.3.5氯离子检测。试验测得氯化物的含量为0.002%,符合药典中规定氯化物的含量0.005%以下。氯离子本身是一种消毒剂,含量过高时,会破坏人体内的正常菌群,严重的会造成菌群失衡,使正常菌群成为条件致病菌而造成内源性的感染。
2.3.6磷检测。试验测得植酸中磷的含量为34%,符合药典中规定磷含量≥31%,磷的含量适中,小鼠未出现高磷病。
2.3.7水分检测。试验测得水分含量为12%,符合植酸中水分含量在药典中要求低于18%。水分是很多微生物作用的介质环境,水分过高会导致植酸容易变质。
2.3.8外观检测。经观察植酸为白色粉末,符合药典中规定的植酸的颜色标准。
2.3.9植酸的色谱分析。酒糟中提取的是植酸的二磷酸结构,与样品中的峰形和峰值相通。从酒糟中提取的植酸中还有其他的峰存在,表明了还有另外一种结构,相关资料表明是植酸的六磷酸结构。
3讨论
采用离子交换树脂法制备植酸既可除去菲汀中的阳离子(Ca2+等)也可除去菲汀中的阴离子(Cl-等)。菲汀经过离子交换后即为粗植酸溶液。粗植酸中还含有大量的杂质(色素等)可通过活性炭进行脱色。通过观察确定温度在60 ℃条件下脱色效果最好。水浴搅拌进一步缩短脱色的时间,并要严格控制温度和流速。
浓缩应在减压下进行,因为植酸与二价以上金属离子有极强的螯合力,浓缩时采用玻璃仪器,不能使用金属反应罐,否则金属离子会超标。对于植酸指标检测可采用国家药典中的检测方法检测,并确定了植酸的各种检测指标都在药典允许的范围之内。
参考文献
[1] 刘巧如.由菲汀制取植酸钠及植酸的生产工艺研究[J].河南师范大学学报(自然科学版),2004,32(4):130-132.
[2] DE BOLAND A R,GAMER G B,O’DEEL B L.Identification and properties of “phytate” in cereal grains and oilseed producrs[J].J Agric Food Chem,1975,23:1186.
[3] 戴传波,李建桥,李健秀.植酸制取的研究进展[J].食品工业科技,2007,28(2):239-242.
[4] 赵玉生,于然.植酸的食品保鲜机理及应用[J].中国食品添加剂,2007(1):147-151.
[5] 王强,时维振,罗根祥.植酸对16锰钢缓蚀性能的研究[J].化工文摘,2006(1):36-39.
[6] 刘延奇,杨留枝,李素云,等.植酸淀粉酯的制备工艺研究[J].食品工艺,2007,28(1):100-103.
[7] 施安辉,王光玉,李桂杰,等.目前国内外植酸酶研究进展[J].中国酿造,2005,146(5):5-11.
[8] TAKASU N,KOMIYA T,ASAWA T,et al.Streprozocin-and-allxon-induced H2O2generating and DNA fragmentation in pancreatic islets [J].Diabetes,1991,40:1141-1145.
[9] 何学令.四氧嘧啶剂量给药途径对制作大鼠糖尿病模型的影响[J].四川动物,2003,22(4):255-257.
[10] 邓近平,范志勇,贺建华.植酸酶磷当量的研究[J].饲料工业,2007,28(6):18-23.
中图分类号S509.9
文献标识码A
文章编号0517-6611(2015)30-230-03
作者简介田小海(1980-),男,吉林乾安人,讲师,硕士,从事微生物发酵、生物化学、生命教育的研究和教学。
收稿日期2015-09-11
Study on the Process of Preparing Phytic Acid with Lees Extracts Phytin
TIAN Xiao-hai, CUI Hong-yan(Changchun Medical College, Changchun, Jilin 130031)
Abstract[Objective] Optimization of process conditions for preparation of phytic acid from lees extract phytin. [Method] Through the 732# cation exchange resin and 717# anion exchange resin adsorption for preparing dilute phytic acid, using active carbon for decoloring, method of vacuum pressure reduction, high quality phytic acid was prepared. [Result] Phytic acid preparation conditions: The optimal velocity of 732# cation exchange resin is 375 ml/h, the maximum amount of sample is 0.5 ml. The best velocity of 717# anion exchange resin for 250 ml/h, the maximum amount of sample is 0.5 ml. The optimum conditions for activated carbon decolorization: 0.5 ml/min, the temperature is60 ℃. Vacuum concentration temperature is 50 ℃. [Conclusion] The experiment determined the optimum conditions of phytic acid were prepared by exchanging lees extract phytin system resin by ion, provides an important basis for the industrial production of preparing a lot of phytic acid.
Key wordsLees; Phytin; Phytic acid; Preparation process
