新型可膨胀聚甲基丙烯酸甲酯骨水泥理化性质及生物相容性分析
2015-12-24谭权昌,雷伟,刘宁等
·基础研究·
新型可膨胀聚甲基丙烯酸甲酯骨水泥理化性质及生物相容性分析
谭权昌,雷伟,刘宁,臧渊,王法琪,张扬,赵雄,严亚波,吴子祥
作者单位:710032陕西, 第四军医大学西京医院骨科
通信作者:吴子祥wuzixiang@fmmu.edu.cn
【摘要】目的评价一种新型可膨胀聚甲基丙烯酸甲酯(poly methyl methacrylate,PMMA)骨水泥的理化性质、生物力学特征及其生物相容性。方法以聚丙烯酸(ploy acrylic acid, PAA)改性PMMA研发一种新型具有膨胀特性的骨水泥(expandable bone cement, EBC)以改善PMMA骨水泥(PMMA bone cement, PBC)聚合体积收缩现象。通过测定EBC的膨胀倍率、聚合温度、面团时间、凝固时间评价EBC的理化性质;压缩实验测定EBC的压缩强度及弹性模量等生物力学的特征。用含有EBC及PBC浸提液的培养基培养成骨细胞,CCK-8测定EBC的细胞毒性作用,评价EBC的生物相容性。结果EBC吸模拟体液24 h平衡后体积膨胀约8.80%。同时EBC的聚合温度为(51.73±3.64)℃,显著低于PBC,差异具有统计学意义(P<0.05),且适宜注射的面团时间为(5.06±0.46) min,较PBC显著延长,差异具有统计学意义(P<0.05),两者的凝固时间差异无统计学意义(P>0.05)。EBC的压缩强度为(36.15±11.19) MPa,明显高于正常椎体松质骨;但弹性模量为(849.26±324.47) MPa,显著低于PBC (2 148.89±176.13) MPa,差异具有统计学意义(P<0.05)。细胞毒性实验显示EBC与PBC相对吸光度分别为1.30±0.11、1.31±0.08,两者之间差异无统计学意义(P>0.05)。可见与PBC相似,EBC具有较好的生物相容性。结论EBC具有良好的膨胀性能,可有效克服PBC聚合体积收缩的缺陷。EBC聚合温度较低、面团时间较长,弹性模量较低可降低成形术后邻近椎体再骨折风险,且生物相容性较好,有望应用于椎体成形术及关节置换术。
【关键词】聚甲基丙烯酸类; 生物相容性材料; 生物力学; 材料试验
基金项目:国家自然科学基金(81301535;31170913)
作者简介:谭权昌 (1986—),硕士在读,医师
【中图分类号】R 318.08【文献标志码】 A
DOI【】
收稿日期:(2014-11-14)
Physicochemical and biocompatible study on novel expandable bone cementTANQuan-chang,LEIWei,LIUNing,ZANGYuan,WANGFa-qi,ZHANGYang,ZHAOXiong,YANYa-bo,WUZi-xiang.DepartmentofOrthopaedics,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,Shaanxi,China
Abstract【】ObjectiveTo evaluate the physicochemical, biomechanical properties and biocompatibility of a novel expandable bone cement. MethodsA novel poly methyl methacrylate (PMMA) based expandable bone cement (EBC) modified with ploy acrylic acid (PAA) was developed to improve the volumetric shrinkage of PMMA bone cement (PBC) because of polymerization. Expansive rate, polymerization temperature, dough time and setting time were investigated versus PBC to evaluate physicochemical properties of EBC. Compressive test was carried out to determine the mechanical property of EBC. Biocompatibility was accessed by evaluating the cytotoxicity of EBC and PBC to the osteoblast which was cultured with medium containing EBC and PBC extraction. ResultsPAA modified EBC achieved approximate 8.80% volumetric expansion after soaked in simulated body fluid (SBF) for 24 h. The polymerization temperature of EBC was (51.73±3.64) ℃, which was significantly lower than PBC (P<0.05). The dough time of EBC was (5.06±0.46) min, and it was longer than PBC (P<0.05), there was no difference of setting time between EBC and PBC (P>0.05). The compressive strength of EBC was (36.15±11.19) Mpa, which was higher than the normal cancellous bone (4.77±0.72) MPa. But the elastic modulus of EBC was significant lower than PBC (849.26±324.47) MPa vs. (2 148.89±176.13) MPa (P<0.05). The relative absorbance of CCK-8 test of PBC and EBC were 1.30±0.11 and 1.31±0.08 respectively, indicated that there was no difference of biocompatibility between EBC and PBC (P>0.05). ConclusionThe novel EBC can overcome the volumetric shrinkage of PBC effectively by volumetric expansion. EBC with lower polymerization temperature and longer dough time than PBC. In addition, the lower elastic modulus of EBC enable it to reduce the risk of adjacent vertebral failure after vertebroplasty, and the good biocompatibility make it an ideal bone substitute material in future vertebroplasty and joint replacement.
【Key words】Polymethacrylic acids; Biocompatible materials; Biomechanics; Materials testing
J Spinal Surg, 2015,13(3):176-181
聚甲基丙烯酸甲酯(poly methyl methacrylate,PMMA)骨水泥因具备良好的生物相容性和生物力学性能而被广泛应用于关节置换及椎体成形术中[1-2]。然而有研究发现,PMMA由小分子的甲基丙烯酸甲酯(methyl methacrylate,MMA)单体聚合为高分子PMMA过程中会产生3.82%~7.08%的体积收缩[3]。骨水泥体积收缩过程中产生的残余应力会导致骨水泥界面产生微裂隙,进而影响假体的长期稳定性[4-5]。同时,现有PMMA骨水泥(PMMA bone cement, PBC)在临床应用中也存在着弹性模量过高、聚合过程急剧放热,这些缺陷也被认为是导致椎体邻近节段再骨折[6],神经灼伤[7]甚至骨坏死[8]的主要原因。
本研究将吸水树脂聚丙烯酸(ploy acrylic acid, PAA)与PBC进行固态共混改性,获得一种具有自膨胀、较低弹性模量、无急剧放热过程的新型骨水泥材料,并评估其理化性质、生物力学特性及生物相容性。
1材料与方法
1.1材料制备
1.1.1PAA合成
丙烯酸(Acrylic acid,AA,化学纯,天津福晨化学试剂厂),氢氧化钠(NaOH,分析纯,天津永城精细化工公司),N,N-亚甲基双丙烯酰胺 (N,N-Methylene bisacrylamide,MBA,化学纯,天津科密欧化工公司),过硫酸钾(K2S2O8, 分析纯,天津津北精细化工公司)。将NaOH、AA、交联剂MBA、引发剂K2S2O8依次加入水溶液中,磁力搅拌器混合均匀成透明溶液后注入1 mm微量泵延长管中,75℃条件下聚合反应为直径1 mm圆柱状纤维,烘干后制备成2 mm×1 mm的PAA纤维颗粒干燥保存备用。
1.1.2膨胀骨水泥制备及实验分组
实验分为PBC组和膨胀骨水泥(expandable bone cement, EBC)组。PBC组即临床用PMMA骨水泥(Mendec®Spine, 意大利TECRES S.p.A公司),由粉末及药液组成,每10 g PMMA粉末配比5 mL MMA液体。EBC组含固、液2种组分。其中固体组分将PMMA粉末与PAA颗粒按质量比10∶1制备,每10 g固体组分中含9.09 g PMMA粉末及0.91 g PAA颗粒,液体组分由MMA药液及3% 羧甲基纤维素(caboxy methyl cellulose, CMC)溶液组成,其中MMA药液仍为EBC固体中PMMA粉末重量/体积比2∶1(即4.55 mL),3% CMC体积为1/2 PMMA药液体积(即2.27 mL)。使用时两者同时加入EBC固体组分中均匀混合。
1.2理化性质测定
1.2.1膨胀倍率
排水法测定PBC及EBC的体积变化。PBC组,电子天平精确称取1.0 g PMMA粉剂,按照固∶液=2∶1充分混合至面团期后投入100 mL模拟体液(simulated body fluid,SBF)中;EBC组,同上法称取1.0 g PMMA粉剂后,按上述实验分组中骨水泥配制比例制备膨胀骨水泥,混合均匀后完全浸入SBF中。间隔30 min,以无水乙醇的体积变化测定PBC组及EBC组的体积变化。膨胀倍率=(吸SBF恒定后体积-初始体积)/初始体积×100%。
1.2.2面团时间
分别将等量的PBC及EBC固、液成分相互混合,当固液剂相互接触时启动计时器计时,充分搅拌混合2 min后,戴无粉橡胶手套的手指每间隔15 s重复接触骨水泥表面,观察接触骨水泥后手套表面是否有粘丝状的纤维形成。每次接触完毕后,完全去除粘附在手套上的骨水泥。记录无粉橡胶手套与骨水泥表面清晰分离的时间,此时间即为骨水泥的面团时间[9]。
1.2.3凝固时间及聚合温度
将PBC组PMMA粉剂15 g,药液7.5 mL充分搅拌混合均匀4 min后,将骨水泥填入聚四氟乙烯模具中,K型热电偶温度计(TASI-8620,特安斯,苏州特安斯电子有限公司)观察凝固温度的变化,固液成分开始接触混合的同时开始计时,直到温度达峰并开始下降时停止观察温度变化情况。EBC组,固体成分总重量为15 g,按10∶1配比PMMA粉末和AA后,按照比例加入EBC液体组分,同上方法观察EBC的凝固温度变化趋势。记录测试每个样本时的环境温度及样本凝固的最高温度。
按ISO5833-2002标准[10],定义凝固时间为tset,作时间-温度曲线,Curveexpert软件拟合后求出Tset后根据曲线计算出tset。Tset=(Tmax+Tamb)/2。
1.3生物力学测试
按照ISO5833-2002标准,将EBC及PBC混合均匀至面团期时填入不锈钢模具中固化1 h后脱模,分别制备成6 mm×12 mm的两底面相互平行的8个圆柱体标本。将制备成的EBC及PBC标本样品浸泡在SBF中37℃恒温24 h后进行压缩实验。
制备松质骨力学测试标本:将新鲜人椎体标本(男性3具,女性5具,平均年龄52岁)室温解冻后,剥离肌肉与结缔组织,正侧位X线排除畸形、骨折、肿瘤等疾病。分离成单个椎体后,用内径约6 mm的取样钻从椎体上表面垂直钻入约20 mm后退出取样钻,脱出取样钻孔内圆柱体标本制备成6 mm×12 mm上下两底面相互平行的圆柱体松质骨(cacellous bone, CB)标本。将松质骨标本置于SBF中37℃恒温24 h后进行压缩实验。
将上述EBC、PBC、CB圆柱体标本置于力学测试机(SANS-CMT4304, 美国MTS系统公司)的测试台上,以22 mm/min恒定速率作形变-负载曲线,MTS系统制动记录力-位移曲线。当材料产生形变或已超过最大屈服点时停止压缩实验。将力-位移曲线转换为应力-应变曲线,用Origin软件(Origin 7.5,美国OriginLab公司)求得应力-应变曲线直线部分的斜率即为EBC、PBC及CB的弹性模量。
1.4生物相容性
1.4.1成骨细胞培养与鉴定
分离新生SD乳鼠颅骨,制备成2 mm×2 mm的骨片,0.25% Trypsin-EDTA (Hyclone, 美国Thermo公司)消化15 min后血清终止消化。将骨片以间隔5 mm的距离贴附于培养瓶底,5% CO2,37℃培养箱中培养,待细胞铺满骨片周围重叠生长时Trypsin-EDTA消化收集细胞传代,碱性磷酸酶染色试剂盒(ALP strain kit,上海碧云天公司)鉴定成骨细胞。
1.4.2细胞毒性实验
细胞活性测定分为EBC组、PBC组、对照组及空白组。将1.4.1项下获取的成骨细胞消化重悬后按5×103每100 μL接种于96孔板的EBC组、PBC组、对照组的孔内,5%CO2,37℃培养箱中孵育4 h贴壁,弃去培养基,在EBC组及PBC组孔板中加入37℃预热的EBC及PBC的DMEM(Hyclone, 美国Thermo公司)浸提液培养液。对照组加入DMEM培养液培养成骨细胞。空白组内只加DMEM培养液。
孵育48 h后,EBC、PBC、对照组及空白组内每孔加入10 μL Cell Counting Kit-8(CCK-8,上海七海生物公司)后继续孵育6 h后,酶标仪450 nm波长处测量各组吸光度。以相对吸光度比较各组之间差异。
1.5统计学处理
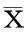
2结果
2.1理化性质
EBC及PBC的膨胀倍率、面团时间,凝固时间及聚合温度见表1。EBC在3.0~4.0 h吸SBF饱和,体积恒定;PBC在固液混合后可以观察到体积膨胀,但1.0 h后体积又产生收缩变化,直至体积恒定。EBC及PBC的膨胀倍率分别为 8.80%及1.67%,两者之间差异具有统计学意义(P<0.05)。EBC较PBC的面团时间长,两者之间差异具有统计学差异(P<0.05),EBC与PBC的凝固时间差异无统计学差异(P>0.05)。EBC聚合温度较PBC下降约29.6%,两者聚合温度之间差异具有统计学差异(P<0.05)。
2.2生物力学
压缩实验标本见图1,PBC、EBC及CB的压缩强度分别为(95.32±3.80) MPa、(36.15±11.19) MPa、(4.77±0.72) MPa,通过力-位移曲线换算为应力-应变曲线后,Origin软件线性拟合求应力-应变曲线直线部分的斜率为PBC、EBC、CB的弹性模量分别为(2 148.89±176.13) MPa、(849.26±324.47) MPa、(405.90±105.67) MPa。由图2可见EBC压缩强度较PBC组低,两者之间差异具有统计学意义(P<0.05),但EBC压缩强度仍显著高于CB组,两者之间差异具有统计学意义(P<0.05)。同时,EBC的弹性模量较PBC明显下降(见图3),差异具有统计学意义(P<0.05)。
2.3生物相容性
2.3.1成骨细胞培养与鉴定
贴壁骨片孵育培养7~10 d后,倒置显微镜下观察可见成骨细胞从骨片边缘爬出,细胞呈梭形、星形平铺及重叠生长,胞体形态较大,细胞核位于胞浆中间或偏于胞浆一侧。碱性磷酸酶染色可见胞浆中有浓染的不溶性的蓝紫色颗粒(见图4)。
表1EBC及PBC的理化性质
Tab.1 Physicochemical property of EBC and PBC


组别Groups膨胀倍率/(%)Expansiverate/(%)面团时间/minDoughtime/min凝固时间/minSettingtime/min聚合温度/(℃)Polymerizationtemperature/(℃)PBC组PBCgroup1.67±1.164.50±0.2714.39±1.07*73.53±9.50EBCEBCgroup8.80±0.105.06±0.4615.33±1.1651.73±3.64
注:*n=7,因PBC组中有1个离群值
Note:*n=7, Because of an outlier in PBC group

图1PBC、 EBC及CB压缩实验标本
Fig.1Samples of PBC, EBC and CB for compressive test
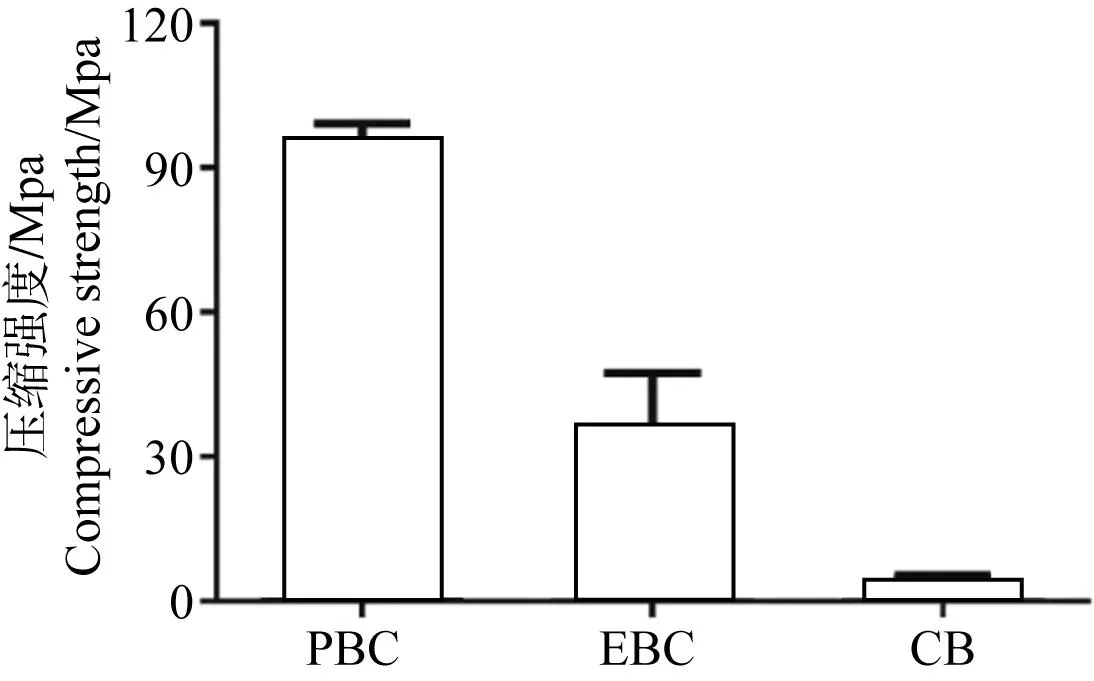
图2PBC、EBC及CB的压缩强度
Fig.2Compressive strength of PBC, EBC and CB
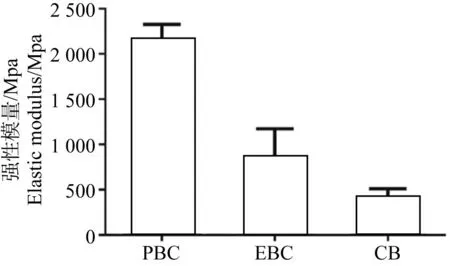
图3PBC、EBC及CB的弹性模量
Fig.3Elastic modulus of PBC, EBC and CB

图4成骨细胞碱性磷酸酶染色 (×10)
Fig.4Alkali phosphatase stain of osteoblast (×10)
2.3.2细胞毒性实验
毒性实验结果见图5。用含有EBC及PBC浸提液的DMEM培养基培养成骨细胞48 h后,EBC组及PBC组、对照组的相对吸光度分别为1.30±0.11、1.31±0.08及1.69±0.18,EBC及PBC 2组间相对吸光度差异无统计学意义(P>0.05),但EBC组与PBC组的细胞活性均低于对照组,由此可见,EBC与PBC骨水泥对细胞的生长无差异,但与对照组比较,两者均对细胞生长有一定的影响。
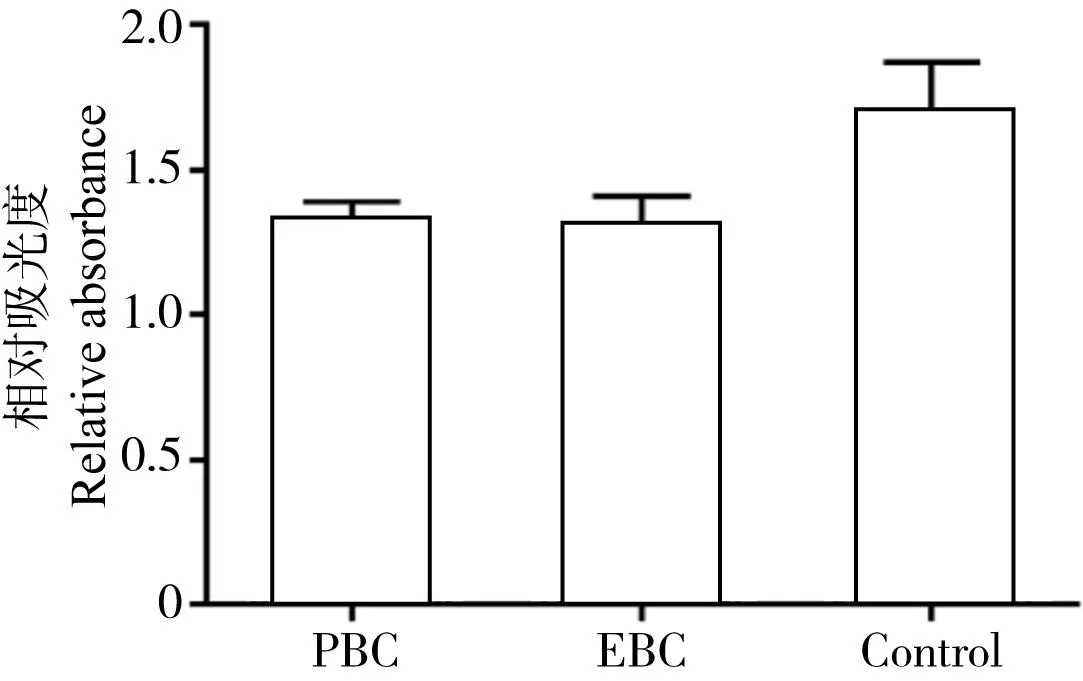
图5CCK-8检测成骨细胞相对吸光度
Fig.5Relative absorbance of osteoblast tested with CCK-8
3讨论
PBC是椎体成形术中常用骨替代材料,但有研究表明,在凝固过程中其会产生体积收缩的现象[3-5,11-12]。Kinzl等[5]发现PBC强化椎体后体积收缩使骨水泥与骨之间产生残余应力导致骨-水泥界面产生微裂,使骨水泥-骨复合体的初始刚度下降进而影响PBC强化椎体的力学稳定性。Orr等[13]发现由于骨水泥的体积收缩产生的残余应力导致水泥-假体界面及水泥-骨界面裂隙产生,成为假体松动的一个重要因素,该研究与Kinzl等[3]的研究相似。因此,改善PBC体积收缩对骨水泥型假体的稳定性及椎体成形术的远期效果具有重要的影响。
PAA为一种交联状的高分子丙烯酸类水凝胶吸水树脂,其三维网状分子结构及所含有的亲水基团使PAA具有独特的吸水膨胀及保水性能[14-16]。同时,PAA也具备较好的生物相容性而作为载药系统广泛应用于药物制备的研究领域[17-18]。因此本研究应用PAA改性PBC,在PAA发挥自身膨胀功能的同时,避免增加骨水泥的毒性作用。将PBC粉剂与PAA 以10∶1的重量比通过物理共混的方法改性的膨胀骨水泥在SBF中吸液平衡后能够实现约8.80%的体积膨胀,说明PAA均匀共混后能够保留有效的吸水膨胀的性能达到改善PBC体积收缩的目的。
面团时间、凝固时间及凝固温度是决定骨水泥性能重要的物理性质。面团时间越长,骨水泥的可操作时间越长[18],ISO5833-2002标准[10]将面团时间>5 min定义为可注射骨水泥。Abd等[9]用生物玻璃改性PBC后,发现随着加入生物玻璃比例越大,改性骨水泥的面团时间越短。但在本实验中,加入PAA颗粒改性的EBC的面团时间较PBC长,达到5.06 min,满足可注射骨水泥的标准,这可能与其中加入了提高EBC可注射性的3% CMC有关,但还有待进一步的实验证实。凝固时间是决定骨水泥在术中可操作性的另一个重要因素,理想的骨水泥的凝固时间为10~15 min[19],骨水泥的凝固时间过长会增加骨水泥在术中使用的不便[9]。虽然EBC中共混了PAA,但实验中测得的EBC的凝固时间与PBC没有差异,这可能因为EBC中PMMA∶AA的比例仍然与PBC中两者的比例是一致的。PBC聚合放热导致局部高温会使周围组织热损伤,也是骨水泥在临床应用中难以克服的一个缺陷[20-21]。有研究发现,改性骨水泥的凝固温度与加入的改性物质及固/液比例有关,液体成分MMA越少,反应的凝固温度越低[9,22]。与Kim等[23]以羟基磷灰石改性PMMA的骨水泥凝固温度的趋势相似,加入PAA改性的EBC的凝固温度低于PBC。另外,本实验得出的凝固温度越低面团时间越长的结果与Castaldini等[22]研究结果一致。
PBC较好的生物力学强度是其广泛应用于临床的因素之一,但在椎体成形术中,PBC因弹性模量过高而导致应力集中一直被认为是导致邻近椎体产生再次骨折的重要因素[24-27]。与PMMA加入羟基磷灰石[23]、聚丙烯酸丁酯纳米颗粒[28]等外源性物质改性的骨水泥压缩强度和弹性模量的变化趋势相似,EBC的压缩强度及弹性模量均较PBC显著降低,但EBC的压缩强度仍然高于松质骨的压缩强度,保证了EBC能够有效地发挥力学支撑的作用,其较低的弹性模型能够有效地避免椎体应力集中,从而降低邻近节段再次骨折的风险。
生物相容性是材料可应用于临床的前提条件。虽然MMA游离单体具有一定的细胞毒性[29-30],PBC在临床的广泛应用证实其具有较好的生物相容性[31]。用含有PBC与EBC浸提液的培养液培养成骨细胞48 h后,两者之间的细胞活性没有差异,说明EBC具有较好的生物相容性。但是,值得注意的是2组的细胞活性均较对照组低,可能与未聚合的MMA单体游离入培养基中有关,这也进一步说明了PAA不影响细胞活性。
综上所述,EBC不仅消除了PBC聚合收缩的缺陷,还具有更佳的面团时间,同时降低了骨水泥凝固聚合温度,能有效减轻水泥聚合时对周围组织的热损伤。在保证力学支撑强度的同时,EBC弹性模量更加接近人体松质骨,减少了椎体强化中邻近椎体再次骨折的风险,有希望应用于未来椎体成形及关节置换手术中。
参 考 文 献
[1] Kuehn KD, Ege W, Gopp U.Acrylic bone cements: composition and properties[J].Orthop Clin North Am, 2005, 36(1):17-28.
[2] Lai PL, Chen LH, Chen WJ, et al.Chemical and physical properties of bone cement for vertebroplasty[J].Biomed J, 2013, 36(4):162-167.
[3] Kwong FN, Power RA.A comparison of the shrinkage of commercial bone cements when mixed under vacuum[J].J Bone Joint Surg Br, 2006, 88(1):120-122.
[4] Griza S, Ueki MM, Souza DH, et al.Thermally induced strains and total shrinkage of the polymethyl-methacrylate cement in simplified models of total hip arthroplasty[J].J Mech Behav Biomed Mater, 2013, 18:29-36.
[5] Kinzl M, Boger A, Zysset PK, et al.The mechanical behavior of PMMA/bone specimens extracted from augmented vertebrae: a numerical study of interface properties, PMMA shrinkage and trabecular bone damage[J].J Biomech, 2012, 45(8):1478-1484.
[6] López A, Hoess A, Thersleff T, et al.Low-modulus PMMA bone cement modified with castor oil[J].Biomed Mater Eng, 2011, 21(5-6):323-332.
[7] Lai PL, Tai CL, Chen LH, et al.Cement leakage causes potential thermal injury in vertebroplasty[J].BMC Musculoskelet Disord, 2011, 12:116.
[8] Huang KY, Yan JJ, Lin RM.Histopathologic findings of retrieved specimens of vertebroplasty with polymethylmethacrylate cement: case control study[J].Spine (Phila Pa 1976), 2005, 30(19):E585-588.
[9] Abd Samad H, Jaafar M, Othman R, et al.New bioactive glass-ceramic: synthesis and application in PMMA bone cement composites[J].Biomed Mater Eng, 2011, 21(4):247-258. KD, Ege W, Gopp U.Acrylic bone cements: composition and properties[J].Orthop Clin North Am, 2005, 36(1):17-28.
[2] Lai PL, Chen LH, Chen WJ, et al.Chemical and physical properties of bone cement for vertebroplasty[J].Biomed J, 2013, 36(4):162-167.
[3] Kwong FN, Power RA.A comparison of the shrinkage of commercial bone cements when mixed under vacuum[J].J Bone Joint Surg Br, 2006, 88(1):120-122.
[4] Griza S, Ueki MM, Souza DH, et al.Thermally induced strains and total shrinkage of the polymethyl-methacrylate cement in simplified models of total hip arthroplasty[J].J Mech Behav Biomed Mater, 2013, 18:29-36.
[5] Kinzl M, Boger A, Zysset PK, et al.The mechanical behavior of PMMA/bone specimens extracted from augmented vertebrae: a numerical study of interface properties, PMMA shrinkage and trabecular bone damage[J].J Biomech, 2012, 45(8):1478-1484.
[6] López A, Hoess A, Thersleff T, et al.Low-modulus PMMA bone cement modified with castor oil[J].Biomed Mater Eng, 2011, 21(5-6):323-332.
[7] Lai PL, Tai CL, Chen LH, et al.Cement leakage causes potential thermal injury in vertebroplasty[J].BMC Musculoskelet Disord, 2011, 12:116.
[8] Huang KY, Yan JJ, Lin RM.Histopathologic findings of retrieved specimens of vertebroplasty with polymethylmethacrylate cement: case control study[J].Spine (Phila Pa 1976), 2005, 30(19):E585-588.
[9] Abd Samad H, Jaafar M, Othman R, et al.New bioactive glass-ceramic: synthesis and application in PMMA bone cement composites[J].Biomed Mater Eng, 2011, 21(4):247-258.
[10]International Organization for Standardization. Implant for surgery-acrylic resin cements[S]. ISO5833-2002: P1.
[11]Gilbert JL, Hasenwinkel JM, Wixson RL, et al.A theoretical and experimental analysis of polymerization shrinkage of bone cement: A potential major source of porosity[J].J Biomed Mater Res, 2000, 52(1):210-218.
[12]Haas SS, Brauer GM, Dickson G.A characterization of polymethylmethacrylate bone cement[J].J Bone Joint Surg Am, 1975, 57(3):380-391.
[13]Orr JF, Dunne NJ, Quinn JC.Shrinkage stresses in bone cement[J].Biomaterials, 2003, 24(17):2933-2940.
[14]马斐, 程冬炳, 王颖, 等. 聚丙烯酸类高吸水性树脂的合成及吸水机理研究进展 [J]. 武汉工程大学学报, 2011, 33(1): 4-9.
[15]杨瑞成, 杨娟, 穆元春, 等.聚丙烯酸高吸水性聚合物的制备与性能 [J]. 兰州理工大学学报, 2008, 34(5): 24-27.
[16]Witono JR, Noordergraaf IW, Heeres HJ, et al.Water absorption, retention and the swelling characteristics of cassava starch grafted with polyacrylic acid[J].Carbohydr Polym, 2014, 103:325-332.
[17]Jia X, Yin J, He D, et al.Polyacrylic acid modified upconversion nanoparticles for simultaneous pH-triggered drug delivery and release imaging[J].J Biomed Nanotechnol, 2013, 9(12):2063-2072.
[18]Tarvainen T, Svarfvar B, Akerman S, et al.Drug release from a porous ion-exchange membrane in vitro[J].Biomaterials, 1999, 20(22):2177-2183.
[19]Ginebra MP, Fernández E, Boltong MG, et al.Compliance of an apatitic calcium phosphate cement with the short-term clinical requirements in bone surgery, orthopaedics and dentistry[J].Clin Mater, 1994, 7(2):99-104.
[20]Heini PF, Wälchli B, Berlemann U.Percutaneous transpedicular vertebroplasty with PMMA: operative technique and early results. A prospective study for the treatment of osteoporotic compression fractures[J].Eur Spine J, 2000, 9(5):445-450.
[21]Lim TH, Brebach GT, Renner SM, et al.Biomechanical evaluation of an injectable calcium phosphate cement for vertebroplasty[J].Spine (Phila Pa 1976), 2002, 27(12):1297-1302.
[22]Castaldini A, Cavallini A.Setting properties of bone cement with added synthetic hydroxyapatite[J].Biomaterials, 1985, 6(1):55-60.
[23] Kim SB, Kim YJ, Yoon TL, et al. The characteristics of a hydroxyapatite-chitosan-PMMA bone cement[J]. Biomaterials, 2004, 25(26):5715-5723.
[24]Fribourg D, Tang C, Sra P, et al.Incidence of subsequent vertebral fracture after kyphoplasty[J].Spine (Phila Pa 1976), 2004, 29(20):2270-2276.
[25]Civelek E, Cansever T, Yilmaz C, et al.The retrospective analysis of the effect of balloon kyphoplasty to the adjacent-segment fracture in 171 patients[J].J Spinal Disord Tech, 2014, 27(2):98-104.
[26]Lamy O, Uebelhart B, Aubry-Rozier B.Risks and benefits of percutaneous vertebroplasty or kyphoplasty in the management of osteoporotic vertebral fractures[J].Osteoporos Int, 2014, 25(3):807-819.
[27]毛宁方, 石志才. 骨水泥在脊柱外科中的应用现状与进展 [J]. 脊柱外科杂志, 2006, 4(4): 239-242.
[28]Gutiérrez-Mejía A, Herrera-Kao W, Duarte-Aranda S, et al.Synthesis and characterization of core-shell nanoparticles and their influence on the mechanical behavior of acrylic bone cements[J].Mater Sci Eng C Mater Biol Appl, 2013, 33(3):1737-1743.
[29]Ciapetti G, Granchi D, Savarino L, et al.In vitro testing of the potential for orthopedic bone cements to cause apoptosis of osteoblast-like cells[J].Biomaterials, 2002, 23(2):617-627.
[30]Gough JE, Downes S.Osteoblast cell death on methacrylate polymers involves apoptosis[J].J Biomed Mater Res, 2001, 57(4):497-505.
[31]Thomson LA, Law FC, James KH, et al.Biocompatibility of particulate polymethylmethacrylate bone cements: a comparative study in vitro and in vivo[J].Biomaterials, 1992, 13(12):811-818.
(本文编辑张建芬)
·消息·
“第三届全国颈椎外科学术会议”通知
由中国康复医学会脊柱脊髓专业委员会颈椎外科研究学会、北京大学第三医院、强生(上海)医疗器材有限公司举办的“第三届全国颈椎外科学术会议(颈椎退变专题)”将于2015年6月27~28日在北京市远望楼宾馆召开。
届时,国内脊柱外科领域知名专家将聚首北京,通过中心发言、焦点论坛(设正方、反方)、主题发言、疑难病例讨论、优秀论文评选等形式与大家一起分享临床工作遇到的一些实际问题。会议还将邀请著名国际颈椎外科专家带来国际上颈椎外科领域的最新进展。会议同时增设微信互动环节,每位代表均有机会与国内外知名专家进行面对面交流。颈椎外科研究学会秉承“严谨学术作风,坚持密切结合临床,反映最新学术动态”的办会宗旨。相信通过本次颈椎外科学术会议的成功举办,一定会促进其成为国内知名的学术会议品牌,为广大脊柱外科医师提供先进、高端的学术交流平台。
再次衷心感谢全国各地同仁的支持,并诚邀您的参与,让我们共享此次学术盛宴!
会议时间:2015年6月26日报到,2015年6月27~28日学习班
会议地点:北京市北三环中路57号 北京远望楼宾馆
注册费: 2015年6月1日前注册1000元/人(以汇款时间为准);现场注册1200元/人
邮局汇款:北京大学第三医院骨科(北京市海淀区花园北路49号,100191)张振会收
银行汇款: 开户单位 北京大学第三医院; 开户银行 北京银行学知支行; 账号 010903757001201090230-52
联系人:张振会 15611908821; 李艳琴 15611963392; E-mail Cervical-section@126.com