水平振摇在骨髓间充质干细胞提纯中的作用
2015-12-24王伟恒,邓国英,徐立璋等
·基础研究·
水平振摇在骨髓间充质干细胞提纯中的作用
王伟恒,邓国英,徐立璋,程自申,杨向群,叶晓健
作者单位:200003上海, 第二军医大学附属长征医院骨科
通信作者:叶晓健yexj2002@163.com
【摘要】目的研究水平振摇对全骨髓贴壁分离大鼠骨髓间充质干细胞在细胞数量、纯度、凋亡及远期增殖及分化能力的影响,探索更为简单、高效的间充质干细胞提纯方法。 方法在全骨髓贴壁法的基础上,使用水平摇床,以180 r/min、4 h为干预条件,水平振摇后计算贴壁细胞总数量;使用流式细胞仪测定贴壁细胞纯度及凋亡情况;使用MTT法测定振摇后贴壁细胞24 h的增殖情况;对分离纯化后细胞使用定向诱导培养基进行诱导分化。结果经振摇处理后,获得的细胞总量有所下降,细胞纯度显著提升,凋亡略有增加,增殖情况变化不大,具有向成骨细胞和脂肪细胞分化的能力。结论水平振摇法可显著提高全骨髓贴壁法的提纯效率,具有推广价值。
【关键词】大鼠; 骨髓; 间质干细胞; 分离和提纯;
基金项目:国家高技术研究发展计划(863计划)(2013AA032203)
作者简介:王伟恒(1989— ), 硕士在读,医师
【中图分类号】R 329.28 【文献标志码】 A
DOI【】
收稿日期:(2014-10-12)
Exploration of horizontal shaking for bone marrow mesenchymal stem cells purificationWANGWei-hang,DENGGuo-ying,XULi-zhang,CHENGZi-shen,YANGXiang-qun,YEXiao-jian.DepartmentofOrthopaedics,ChangzhengHospital,SecondaryMilitaryMedicalUniversity,Shanghai200003,China
Abstract【】ObjectiveTo study the effects of horizontal shaking on cell purity, activity, apoptosis, and differentiation in the process of the in vitro isolation and purification of rat bone marrow mesenchymal stem cells (BMSCs). Even the shaking effect for the cells proliferation, differentiation ability in the future. To establish a simpler and more efficient method for BMSCs purification. Methods Based on the whole bone marrow adhesion method, BMSCs isolated and purified by using different attachment method and shaking treatment of 180 r/min for 4 h, and then analyzed the adherent cell state including cell counting by cells counter; cell purity and apoptosis by flow cytometry; cells proliferation after shaking 24 h by MTT method; cells differentiation by directional induction medium. ResultsAfter shaking, cell count was decrease, purity was increased, apoptosis was increased, proliferation had no change, and the harvested cells had the ability to differentiate into osteoblasts and adipocytes. ConclusionThe whole bone marrow adhesion method combined with appropriate shaking is more efficient and worth popularizing.
【Key words】Rats; Bone marrow; Mesenchymal stem cells; Isolation & purification;
J Spinal Surg, 2015,13(1):45-49
近年来,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)作为种子细胞在脊髓损伤[1-3]、椎间盘退变[4-6]和纤维环修复[7-8]等脊柱外科领域备受关注。但因其在骨髓中含量低,体外培养易分化和老化[9],获得足够数量的高纯度、高活性、低分化的间充质干细胞是进行相关研究的重要基础。
目前从骨髓中提纯BMSCs方法主要包括:全骨髓贴壁法[10]、密度梯度离心法[11]、流式细胞仪分离法[12]、免疫磁珠分离法[13]。全骨髓贴壁法是根据细胞贴壁能力的差异筛选间充质干细胞,此法简单易行,但得到的细胞纯度较低。密度梯度离心法操作繁复,提取细胞纯度较高,但生长缓慢活性低,原代细胞首次融合时间长[14]。流式细胞仪分离法和免疫磁珠分离法是利用特异性抗体筛选BMSCs,提取效率较高,但对细胞正常生理有影响,且成本高难以普及[12-13]。因此寻找一种简单高效的提取方法,对BMSCs的推广研究具有特殊意义。
从骨髓中分离纯化的间充质干细胞主要混有成纤维细胞和造血系细胞。在这几种细胞中成纤维细胞的贴壁能力最强,BMSCs次之,造血系细胞较弱[10]。本研究借鉴小胶质细胞和少突胶质细胞前体细胞的分离纯化方法[15],在全骨髓贴壁法的基础上利用水平振摇对BMSCs进行分离纯化。研究机械振摇在纯化BMSCs中的作用以及对细胞增殖分化的影响,最终简便而高效的从大鼠骨髓中成功分离培养出高纯度的BMSCs,并将其诱导分化为成骨细胞和脂肪细胞。
1材料和方法
1.1试剂和仪器
清洁级SD大鼠(第二军医大学实验动物中心),雌雄不限,体重(100±10) g;5 mL一次性注射器,DMED-F12培养基(Gibco,美国),胎牛血清(Gibco,美国),T75培养瓶(corning,美国),大培养皿(corning,美国),三抗(Gbico,美国),无EDTA 0.25%胰酶(GIBCO),BMSC成骨成脂诱导分化培养基(Cyagen,美国),CD45,CD31,CD90,CD29 流式分析抗体及同型对照(BD,美国),细胞凋亡检测试剂盒(BD,美国),MTT增殖活性试剂盒(碧云天,中国)。
1.2BMSCs原代细胞的获取
根据文献[10, 20]中报道方法并适当改良 ,取12只SD大鼠CO2窒息处死后,置于75%酒精中浸泡10 min,于无菌条件下取出双侧股骨和胫骨,剪除两端骨骺,用5 mL注射器吸取DMEM培养液从长骨一端反复冲洗骨髓腔,离心后以完全培养基(10%FBS,DF-12,1%三抗)重悬。收集细胞悬液,以约平均2只/瓶的细胞总量,10 mL的培液体积,接种于6个T75培养瓶中。于37℃,体积分数5% CO2饱和湿度孵育箱中培养。24 h后换液,之后隔日换液。1周后可观察到集落明显形成,为实验所用对象。每次实验振摇前30 min更换培养液。
1.3实验方法/干预
取6瓶同批次BMSCs原代细胞,随机分为2组,每组各3瓶。一组于37℃水平摇床180 r/min振摇4 h(实验组),另一组不加处理(对照组)。振摇结束后弃上清,消化贴壁细胞后计数,经流式细胞仪检测贴壁细胞CD45、CD31、CD90、CD29的表达情况,同时进行AnnexinⅤ-fitc+PI标记的细胞凋亡检测。贴壁消化的细胞重新种于96孔板,24 h后MMT法测定贴壁细胞传代后的增殖活性,另一批种于24孔板中进行成骨成脂诱导分化。
使用Counterstar全自动细胞计数仪计数处理前后贴壁细胞总数量。
流式细胞术测定BMSCs纯度:相同条件下使用37℃、0.25%的胰酶将细胞消化后移至离心管内,以150×g(g=9.806 65 m/s2)离心,5 min后弃上清,按试剂盒说明书进行细胞准备,加入抗体及同型对照,染色15 min后,经PBS稀释至500 μL,由流式细胞仪(FAC500)进行贴壁细胞CD29、CD90、CD45、CD31阳性率检测,计算细胞纯度,鉴定振摇的分离纯化效果。
流式细胞术测定BMSCs凋亡:取同批次细胞,经上述消化离心调整密度后,取剩余细胞,按照试剂盒使用说明书染色后,行流式细胞仪检测[21-22]。测定贴壁细胞凋亡率,评估贴壁细胞的凋亡情况。
MMT法测定振摇后细胞活性:将处理后与不处理的贴壁细胞消化后,以1×104/mL的细胞密度,每孔100 μL种于96孔板内,每瓶种3个孔,每组9个孔,20 h贴壁后,按照文献[19]报道的方法检测细胞活性,评估振摇处理对细胞后续增殖能力的影响。
体外分化潜能测定:经纯度鉴定后,选取纯度最高组以细胞密度1×105/mL,每孔1 mL接种于24孔板内,细胞贴壁后分别加入成骨、成脂诱导分化培养基,每3 d换液,3周后经4%多聚甲醛固定后分别以茜素红和油红O染色[23],镜下观察分化指标。以茜素红染色后骨结节的形成和油红O染色后脂滴的形成来评价成骨成脂分化能力,评估振摇后的细胞分化潜能。
所有染色过程均按照产品说明书操作,染色后1 h内检测拍照完毕。
1.4统计学分析
所得到的数据使用SPSS 21.0软件(美国IBM公司)进行分析和处理,使用单因素方差分析法,进行2组间的比较。设定P<0.05为差异有统计学意义。
2结果
2.1振摇后贴壁细胞量及纯度的结果
与对照组相比,水平振摇处理后,贴壁细胞的数量约下降1/3(见图1a),细胞CD29和CD90 2项指标阳性率均显著上升,振摇后贴壁细胞的纯度大幅提升(见图1b-f)。CD45和CD31 2个阴性指标阳性率均<1%,对结果分析影响不大,故未在图中显示。
2.2振摇后贴壁细胞凋亡
流式细胞仪结果分析显示振摇刺激可使贴壁细胞凋亡增加。实验组和对照组间差异有统计学意义(P>0.05,见表1),但在目前的干预条件下,凋亡水平均较低,振摇后凋亡率升高幅度不大(见图2)。
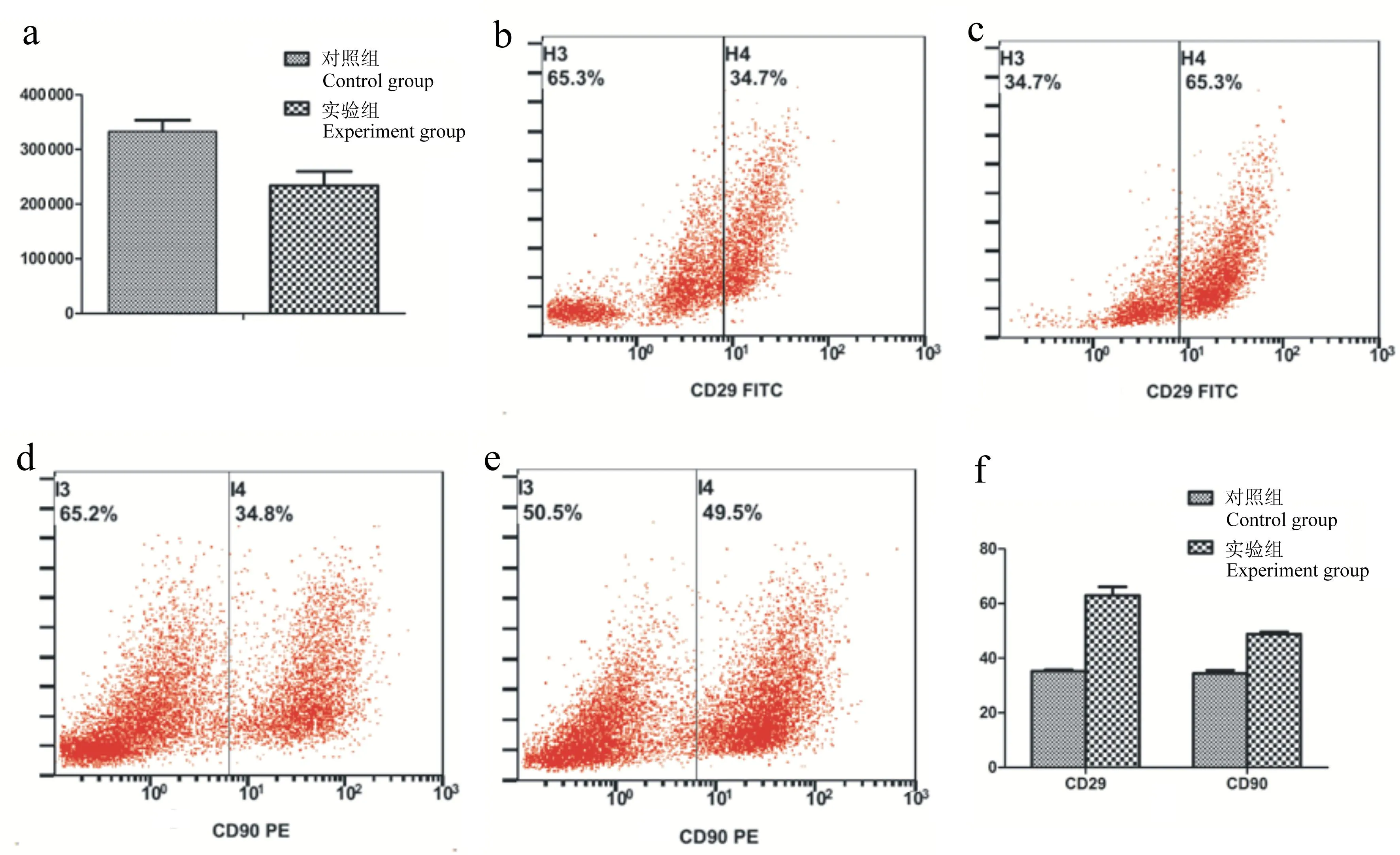
a: 2组贴壁细胞量b: 对照组贴壁细胞CD29阳性率c: 实验组组贴壁细胞CD29阳性率d: 对照组贴壁细胞CD90阳性率e: 实验组组贴壁细胞CD90阳性率f: 2组贴壁细胞纯度
a: Number of adherent cells of 2 groupsb: Control group CD29 positive rate of adherent cellsc: Experiment group CD29 positive rate of adherent cellsd: Control group CD90 positive rate of adherent cellse: Experiment group CD90 positive rate of adherent cellsf: Purity of adherent cells of 2 groups
图12组贴壁细胞量及细胞纯度
Fig.1Number and purity of adherent cells of 2 groups
表12组贴壁细胞的凋亡率
Tab.1Apoptosis rate for adherent cells of 2 gruoups


组别Groups早期凋亡Earlyapoptosis晚期凋亡Lateapoptosis总凋亡Totalapoptosis对照组Controlgroup1.13±0.214.53±0.705.67±0.76实验组Experimentgroup1.53±0.617.23±0.72*8.77±0.21*
注:早期凋亡不明显,差异无统计学意义(P>0.05);*晚期凋亡和总凋亡率明显,差异有统计学意义(P<0.05)
Note:Early apoptosis was not obvious, difference has no statistically significant (P>0.05); *Late apoptosis and total apoptosis was obvious, difference has statistically significant (P<0.05)
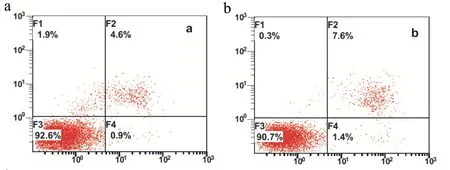
a: 对照组b: 实验组
a: Control groupb: Experiment group
图22组贴壁细胞凋亡率
Fig.2Apoptosis of adherent cells of 2 groups
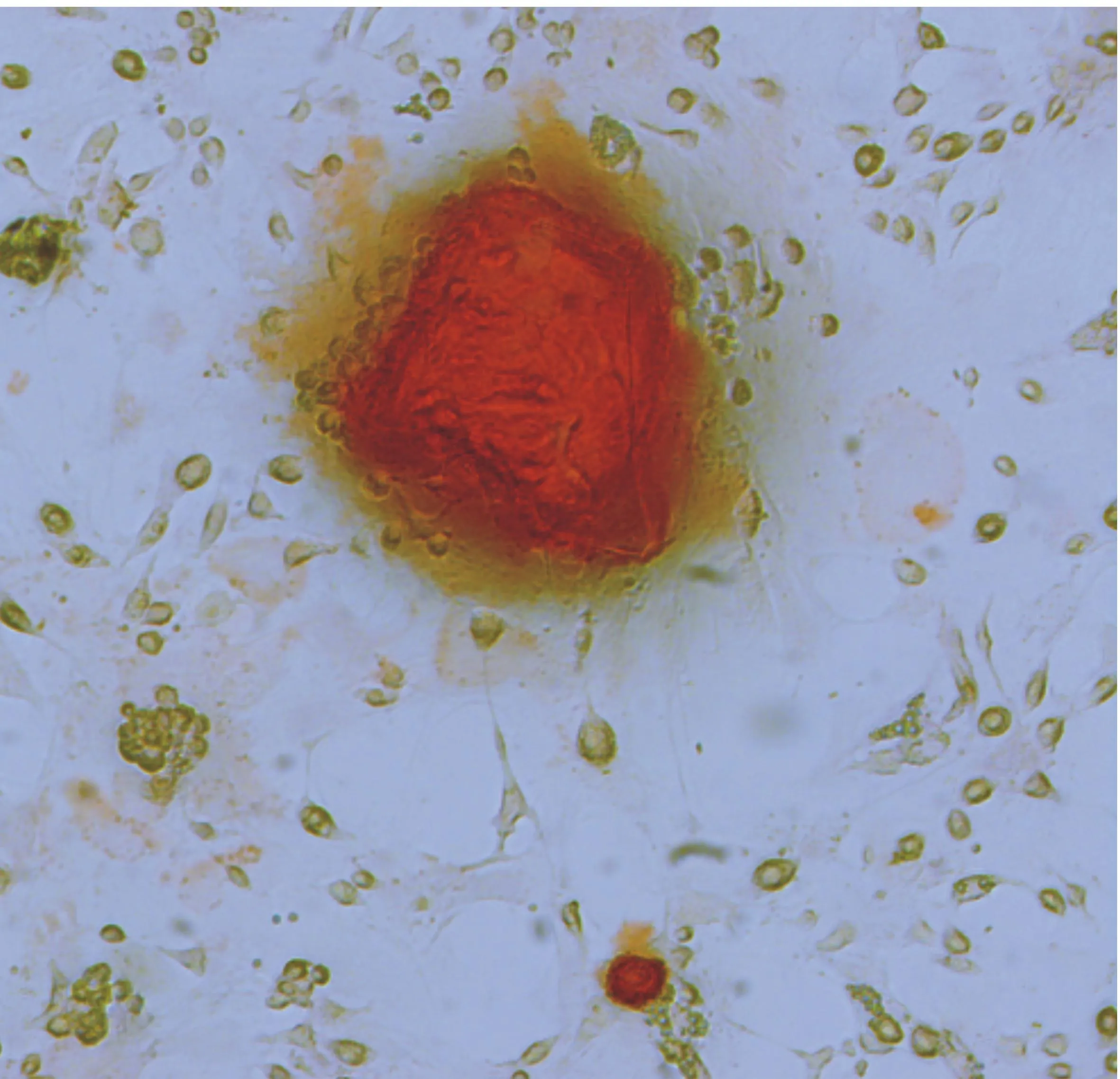
图3成骨诱导3周后茜素红染色情况(×400)
Fig.3Alizarin red staining after osteogenic induction 3 weeks(×400)
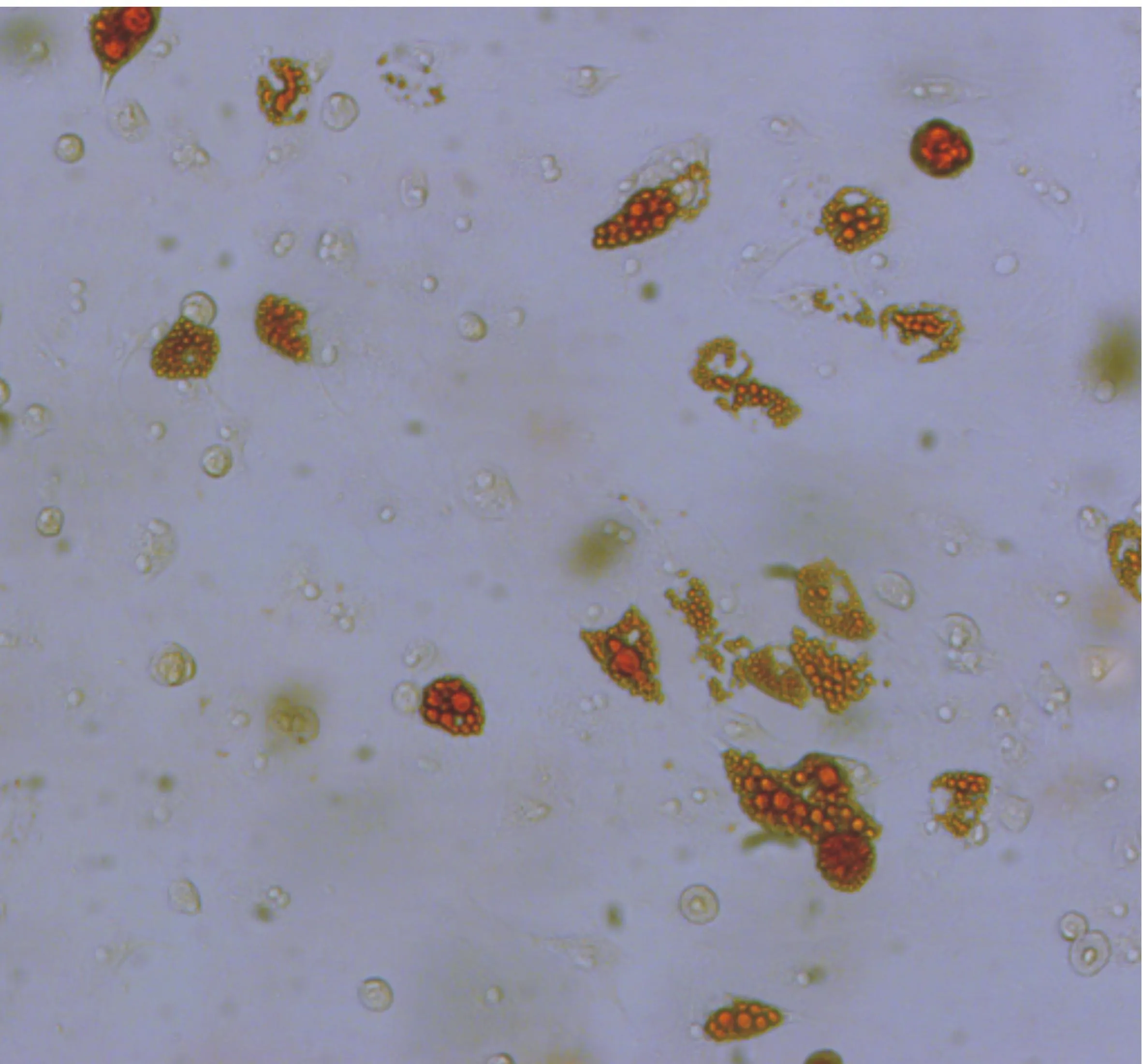
图4成脂诱导3周后油红O染色情况(×400)
Fig.4Red O staining after adipogenic induction 3 weeks(×400)
2.3振摇24 h后MTT检测贴壁细胞增值能力
MTT检测显示振摇前后贴壁细胞均形成蓝紫色结晶,全自动酶标仪显示实验组与对照组比色结果分别为0.299±0.013 82和0.304±0.025 17。2组间差异无统计学意义(P>0.05)。振摇对贴壁细胞的增值能力影响并不显著。
2.4振摇后贴壁细胞成骨成脂诱导分化结果
用成骨诱导培养基对振摇处理后的贴壁细胞行诱导分化,成骨诱导培养3周后,茜素红染色显示细胞外基质中有钙结节形成(见图3)。成脂诱导培养7 d左右可见细胞形态有所改变并随着诱导培养时间的延长,细胞中脂滴变大,诱导3周时油红O染色结果显示多数细胞的细胞质可见红色脂滴(见图4)。
3讨论
虽然在实验设计及操作中实验人员采取了多种改进方法,但由于原代细胞提取本身的局限性,批次之间、各培养瓶内细胞量之间的差异不可避免,最终结果,批次间和培养瓶内细胞略有不同,但在实验干预前后均出现稳定显著差异,说明水平震摇的纯化效果。在实验操作中,原代细胞提取时统一重悬后平均接种于各培养瓶中,培养瓶内细胞差异不大。但大批量操作时实验质量的可控性降低,故同一批次实验时使用大鼠数量定为12只,平均分为2组,每组均匀接种与3个培养瓶,整个实验在不同时间段内重复进行验证。另外,因过高的细胞密度可导致干细胞分化[16-17],因此选择1周为时间节点以控制不同批次间细胞量的差异。即便如此,因批次之间基线不尽相同,不宜同时进行统计分析,但经多次重复实验,振摇分离方法稳定性佳,振摇前后差异显著,故本研究所展示为其中1组数据。而同一批次内,瓶与瓶之间在细胞状态上不尽相同,虽经过重悬和平均分配,同组内不同培养瓶间差异仍无法完全避免,但因差异较小而未做进一步处理。
4个抗体的选择上[18],CD29和CD90 阳性指标在整个实验中敏感性强,但CD45和CD31 阴性指标在整个实验中皆处于极低水平,敏感性差,故未做处理分析。被摇晃下来的大量细胞因成分复杂,需要试验性使用多种抗体进行鉴定,不属于此次研究的重点,且不影响BMSCs纯化结果的可靠性,因此未做鉴定。
参照小胶质细胞的分离方法,本研究选择180 r/min、4 h作为干预条件[19],明确证明通过物理刺激,即振摇法分离纯化细胞的可行性。整体而言,在BMSCs的纯化中,水平振摇法可引起培养液运动,产生对贴壁细胞的流体剪切力[20],这对有较强贴壁能力的BMSCs的提纯有显著的优化作用[21],从而实现不同贴壁能力细胞的分离。这也是经典的小胶质细胞和少突胶质细胞前体细胞分离的理论依据[19]。全骨髓贴壁法中,细胞分为造血系细胞和间充质干细胞,其中造血系的细胞贴壁能力较差而BMSCs贴壁能力较强[10]。因此,参照小胶质细胞和突胶质细胞前体细胞的分离方法进行BMSCs分离纯化理论上是可行的。
从细胞的凋亡上看,贴壁细胞在流体剪切力作用下不断凋亡、不断脱壁,在不同的阶段维持相对稳定的凋亡比例[22]。凋亡细胞的贴壁能力较低,较易脱壁,在较高振摇频率下导致更易脱壁。从细胞总数量来看,虽然有接近1/3的细胞脱壁,但贴壁细胞中总凋亡率只有9%左右,因此在180 r/min,4 h水平振摇的条件下对于细胞的纯化作用应远大于其所造成的细胞损伤。
从分离后细胞活性看,水平振摇对贴壁细胞的活性影响并不显著,但可实现细胞纯度的显著增高,细胞纯度的增高可能更利于细胞的增殖活性。因此本方法具有实际应用的价值。
在混合培养体系中,一种细胞的纯度增加可表现为该细胞分裂能力突出引起的“绝对”纯度增加和杂细胞数量降低引起的“相对”纯度增加。物理方法纯化细胞的机制可能是:细胞本身贴壁能力的差异导致直接分离;细胞对物理刺激抵抗能力的差异引起细胞不同程度的继发凋亡,而凋亡后细胞的贴壁能力降低导致不同程度的间接分离。BMSCs细胞因其相对较强的贴壁能力和抵抗物理刺激的能力,在水平振摇后得到纯化。而造血系细胞则因贴壁能力较差在振摇的过程中直接脱壁,或是因其对物理刺激的抵抗能力较弱而产生凋亡后贴壁能力减弱而脱壁。最终达到纯化BMSCs的作用。
综上所述,全骨髓贴壁法提取BMSCs经过水平振摇处理后得到的贴壁细胞,细胞纯度得到显著提升,且由振摇所导致的细胞凋亡较轻,对后续细胞增殖分化能力影响不明显。因此,相较于现有的提纯方法,可更快地获得高纯度、高活性、低分化的间充质干细胞。可以作为治疗脊髓损伤,椎间盘退变,纤维环修复的种子细胞,具有更为广阔的应用前景。
参 考 文 献
[1] 李洪秋, 王哲, 阿良.骨髓间充质干细胞移植对大鼠脊髓损伤后氧化应激的影响[J].脊柱外科杂志, 2010, 8(3):157-161.
[2] 张宪郁, 徐皓.骨髓间充质干细胞在脊髓损伤治疗中的应用[J].脊柱外科杂志, 2006, 4(6):373-376.
[3] Oda Y, Tani K, Isozaki A, et al. Effects of polyethylene glycol administration and bone marrow stromal cell transplantation therapy in spinal cord injury mice[J]. J Vet Med Sci, 2014, 76(3):415-421.
[4] Sakai D, Mochida J, Yamamoto Y, et al.Transplantation of mesenchymal stem cells embedded in Atelocollagen gel to the intervertebral disc: a potential therapeutic model for disc degeneration[J]. Biomaterials, 2003, 24(20):3531-3541.
[5] 李超, 李明.间充质干细胞治疗椎间盘退行性变的研究进展[J].脊柱外科杂志, 2012, 10(3):186-189.
[6] Wang LJ, Zhang RP, Li JD.Transplantation of neurotrophin-3-expressing bone mesenchymal stem cells improves recovery in a rat model of spinal cord injury[J]. Acta Neurochir (Wien), 2014, 156(7):1409-1418.
[7] 杨成伟, 邓国英, 杨洋, 等.单层组织工程纤维环取向纳米纤维支架的构建和初步验证[J].脊柱外科杂志, 2014, 12(2):87-91.
[8] Connelly JT, Vanderploeg EJ, Mouw JK, et al.Tensile loading modulates bone marrow stromal cell differentiation and the development of engineered fibrocartilage constructs[J].Tissue Eng Part A, 2010, 16(6):1913-1923.
[9] Friedenstein AJ, Deriglasova UF, Kulagina NN,et al.Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method[J]. Exp Hematol, 1974, 2(2):83-92.
[10]Dexter TM, Testa NG, Allen TD, et al.Molecular and cell biologic aspects of erythropoiesis in long-term bone marrow cultures[J]. Blood, 1981, 58(4):699-707.
[11]Chen ZZ, Van Bockstaele DR, Buyssens N, et al.Stromal populations and fibrosis in human long-term bone marrow cultures[J]. Leukemia, 1991, 5(9):772-781.
[12]Dezawa M, Kanno H, Hoshino M, et al. Specific induction of neuronal cells from bone marrow stromal cells and application for autologous transplantation[J]. J Clin Invest, 2004, 113(12):1701-1710.
[13]Nadri S, Soleimani M.Isolation murine mesenchymal stem cells by positive selection[J]. In Vitro Cell Dev Biol Anim, 2007, 43(8-9):276-282.
[14]Rouger K, Fornasari B, Armengol V, et al. Progenitor cell isolation from muscle-derived cells based on adhesion properties[J]. J Histochem Cytochem, 2007, 55(6):607-618.
[15]刘文, 王燕, 宋玲, 等. 周期性张应力促进兔髁状突软骨细胞的增殖[J]. 中国组织工程研究, 2014, 18(20):3144-3148.
[16]Majd H, Wipff PJ, Buscemi L, et al. A novel method of dynamic culture surface expansion improves mesenchymal stem cell proliferation and phenotype[J]. Stem Cells, 2009, 27(1):200-209.
[17]Engler AJ, Sen S, Sweeney HL, et al. Matrix elasticity directs stem cell lineage specification[J]Cell, 2006, 126(4):677-689.
[18]徐无忌, 庄洪. 骨康含药血清对大鼠骨髓间充质干细胞成脂分化的影响[J]. 中国组织工程研究与临床康复, 2008, 12(43):8434-8438.
[19]Giulian D, Baker TJ. Characterization of ameboid microglia isolated from developing mammalian brain[J]. J Neurosci, 1986, 6(8):2163-2178.
[20]Feugier P, Black RA, Hunt JA, et al. Attachment, morphology and adherence of human endothelial cells to vascular prosthesis materials under the action of shear stress[J]. Biomaterials, 2005, 26(13):1457-1466.
[21]Liu X, Zhang X, Lee I. A quantitative study on morphological responses of osteoblastic cells to fluid shear stress[J]. Acta Biochim Biophys Sin (Shanghai), 2010, 42(3):195-201.
[22]Chen R, Wang J, Jiang B, et al. Study of cell apoptosis in the hippocampus and thalamencephalon in a ventricular fluid impact model [J]. Exp Ther Med, 2013, 6(6):1463-1468.
(本文编辑于倩)
