梯度液相色谱中梯度曲线变形对色谱峰宽的影响
2015-12-24郝卫强岳邦毅张培培
吴 顺, 郝卫强 , 岳邦毅, 张培培, 狄 斌, 陈 强*
(1. 常州大学石油化工学院,江苏 常州213164;2. 上海烟草集团有限责任公司,烟草行业卷烟烟气重点实验室,上海200082;3. 常州南京大学高新技术研究院,江苏 常州213164;4. 中国药科大学药物分析教研室,江苏 南京210009)
梯度洗脱是高效液相色谱的一种基本操作模式。它通过在输液系统中设定梯度程序(即梯度曲线),从而使流动相组成(通常表示为强洗脱溶剂在流动相中的体积比,φ)在分离过程中随时间的改变而发生变化[1-3]。在梯度液相色谱(gradient liquid chromatography,GLC)中,色谱峰不仅会受到轴向扩散等传质因素的影响而发生展宽(即“谱带展宽效应”),而且还会受到梯度曲线的影响而发生压缩(即“谱带压缩效应”)[4,5]。这两种效应共存使得对GLC 中峰宽的理论研究要比等度情形复杂许多,而后者仅需要考虑“谱带展宽效应”所造成的影响。Poppe 等[6]基于平衡扩散色谱模型对GLC 中的峰宽进行了研究。在该研究中,设定溶剂强度为线性:

其中:k 为保留因子,k0和S 为溶剂强度参数。同时,色谱柱的理论塔板高度(H)被假定不会随流动相组成的改变而发生变化。需要指出,这些假设在实践中均具有一定的局限性。为了拓展Poppe 等的工作,Guiochon 等[7-10]将非线性溶剂强度以及溶剂在固定相上的吸附引入到数学分析之中,在此基础上探讨了单线性梯度洗脱中的谱带压缩因子的计算方法。本文作者以速率色谱模型为理论基础,推导得到适合任意形式的溶剂强度、梯度曲线以及Hφ 关系的理论塔板高度方程[11]:
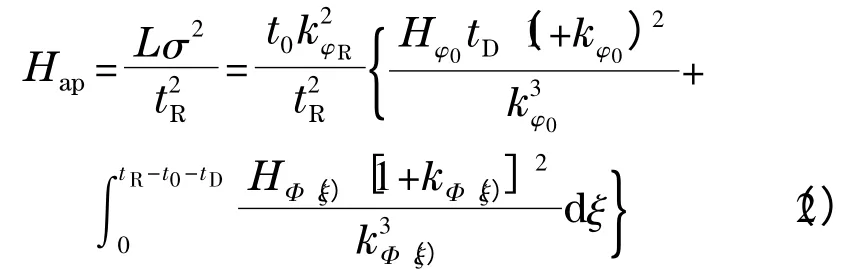
其中:Hap为GLC 中的表观理论塔板高度,H 为等度模式下的理论塔板高度,k 为保留因子,L 为柱长,σ为色谱峰的标准偏差,tR为保留时间,t0为死时间,tD为梯度延迟时间,k 和H 中的下标为其所对应的流动相组成,φ0为初始流动相组成,Φ(t)为梯度曲线表达式,φR为溶质流出色谱柱时所对应的流动相组成(即φR=Φ(tR-t0-tD))。作者[12]发现式(2)同样适用于平衡扩散色谱模型,这就为式(2)在实践中的应用奠定了良好的理论基础。
在实践中,线性梯度和阶梯梯度是梯度曲线的两种基本形式。通过改变线性梯度的斜率,以及将线性梯度和阶梯梯度以任意形式组合,可衍生出众多具有不同形状的梯度曲线,从而极大地增加了实际梯度操作的灵活性。然而,由于输液系统中溶剂的混合以及受到管线中轴向扩散等因素的影响,线性梯度和阶梯梯度在曲线的拐角处将不可避免地出现弥散现象,这就会使实际梯度曲线与设定形状之间存在一定差异。为了探讨这种梯度曲线变形对色谱峰宽的影响,本文以反相液相色谱体系为研究对象,基于所设定的梯度条件以及在柱入口处测得的梯度曲线,根据由式(2)推导得到的线性、阶梯以及任意线性梯度组合的数学公式,对GLC 中的色谱峰宽进行计算。然后比较理论值与实验值之间的差异,探讨了梯度曲线变形对色谱峰宽的影响。
1 理论部分
对于阶梯梯度(本文均假定溶质在最后一个梯度区间内流出色谱柱):
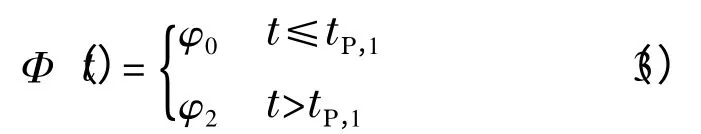
其中:tP,1为流动相组成发生变化所对应的时间。当溶剂强度为线性(即符合式(1)),且H-φ 的关系符合抛物线方程:

由式(2)可推导得到式(5)[11]:
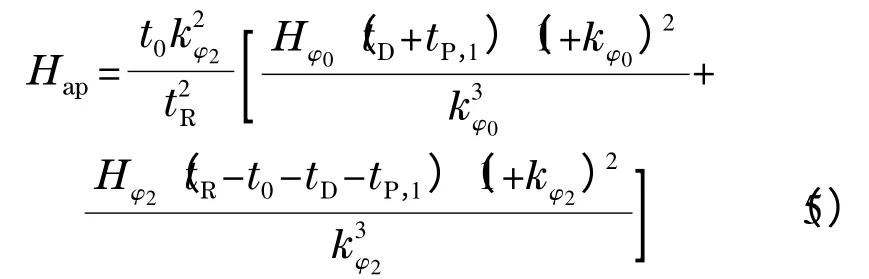
类似地,对于具有如下形式的线性梯度:
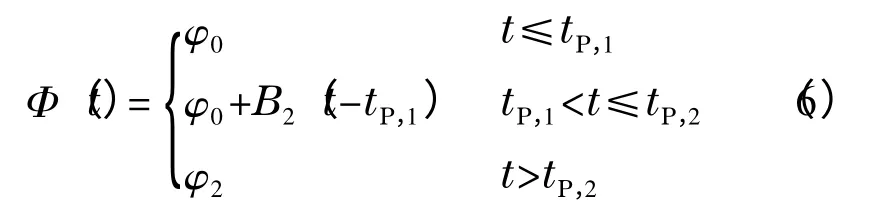
其中:B2为梯度的斜率,tP,1和tP,2为梯度曲线发生两次转向所对应的时间。由式(2)可推导得到式(7)[11]:
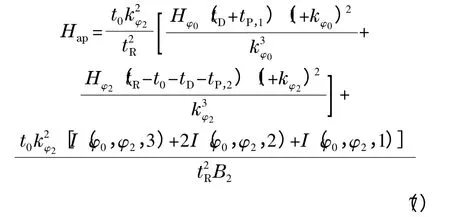
其中:数学函数I(φ1,φ2,n)定义为:
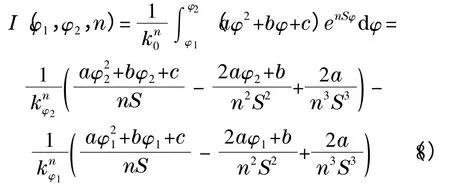
对于在色谱柱入口处测得的梯度曲线,其可以看作是由一组线性梯度首尾相连而成,即:
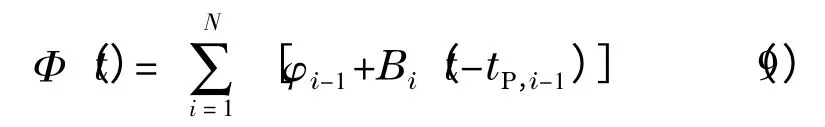
其中:tP,0=0,N 为溶质流出色谱柱时所对应的梯度区间的编号(即tR-t0∈(tN-1,tN)),tP,i-tP,i-1等于色谱工作站记录数据的时间间隔。相应地,式(2)可写为式(10)(该情形中tD=0)[11]:
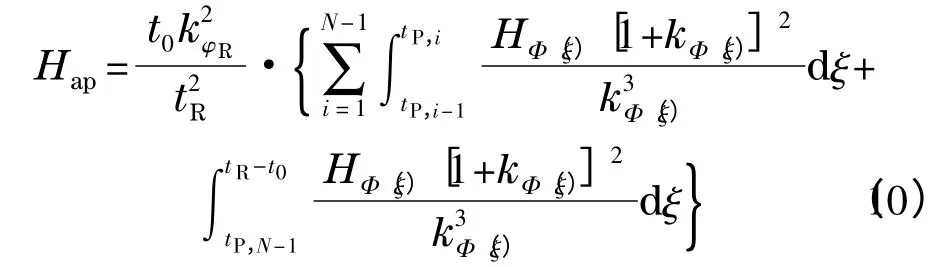
其中:
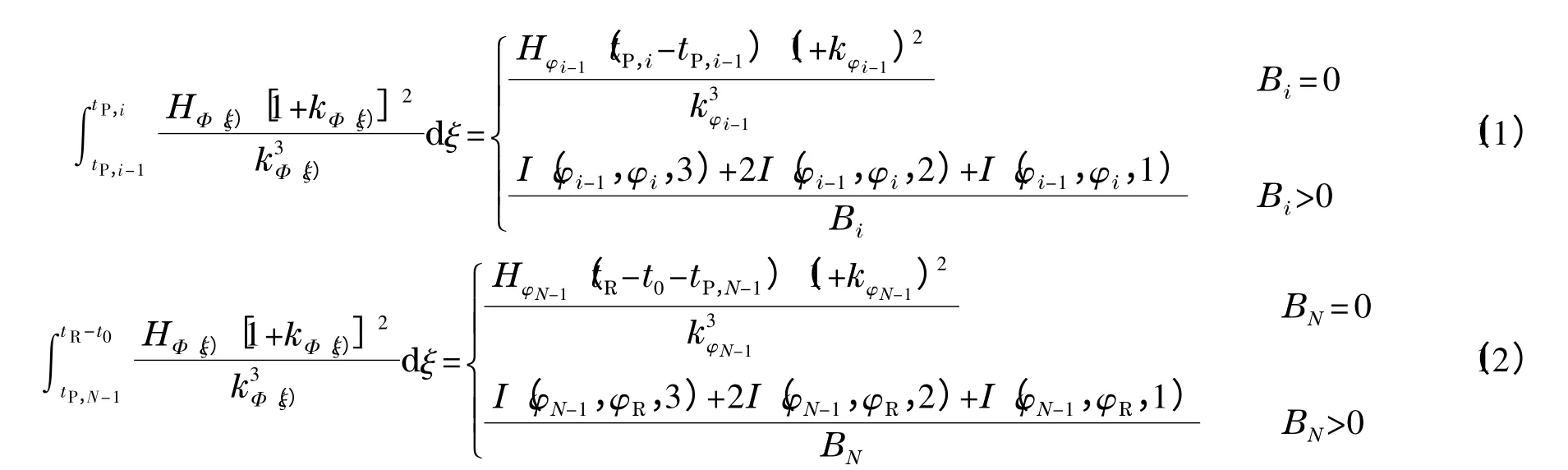
色谱峰宽(W)与Hap的关系为:
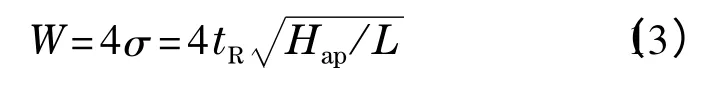
2 实验部分
2.1 仪器、试剂与材料
日本岛津公司Prominence 液相色谱系统,包括两个LC-20AT 输液泵,一台SIL-20A 自动进样器,一台SPD-20A 紫外检测器,一个CTO-20AC 柱温箱,以及LabSolutions 色谱工作站等。
联苯(纯度99%)和苯乙酮(纯度99%)均购自常州润友商贸公司。Ultimate XB C18 色谱柱购自月旭材料科技(上海)有限公司。甲醇为色谱纯。试验用水为超纯水。
2.2 色谱条件
色谱柱:Ultimate XB C18 柱(150 mm×4.6 mm,5 μm);柱温:35 ℃;检测波长:254 nm;进样量:5 μL。流动相:甲醇和水,流速:1.0 mL/min,梯度曲线中各节点对应的时间和甲醇体积分数(φ)见表1。
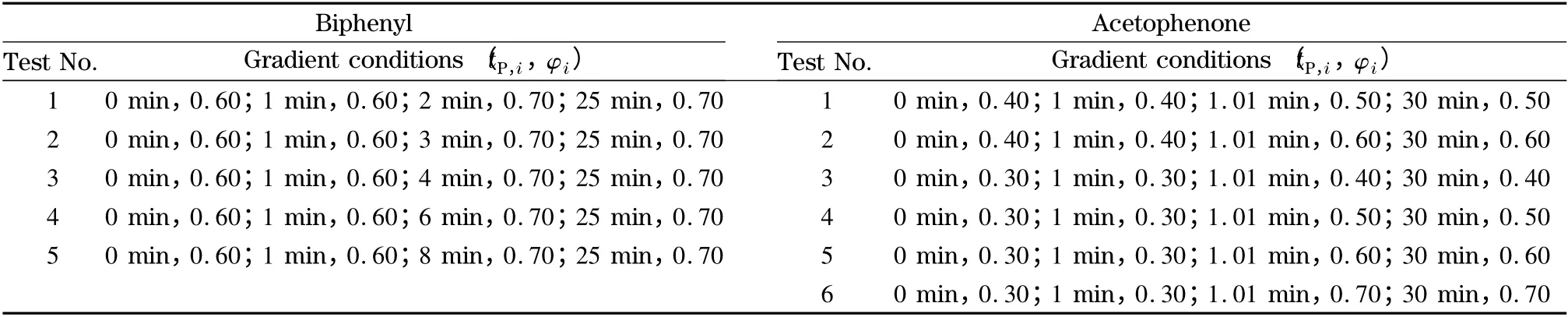
表1 联苯和苯乙酮的梯度洗脱条件Table 1 Gradient conditions for biphenyl and acetophenone
2.3 实验步骤
样品溶液的配制:取联苯和苯乙酮适量,用60% (v/v)甲醇水溶液分别配成20 mg/L 和30 mg/L 的样品溶液。
死时间和梯度延迟时间的测定:同文献[13]。
柱入口处梯度曲线的测定:以二通管替换色谱柱,并将检测波长设定为205 nm。首先,记录不同甲醇体积分数的流动相在该波长下的响应值,绘制校准曲线。然后,在表1 所示的梯度条件下记录检测器的响应值随时间的变化曲线。根据校准曲线将响应值换算成甲醇的比例。
色谱峰宽的测定:在表1 所示的梯度条件下记录联苯和苯乙酮的色谱峰,峰宽从色谱工作站的处理结果中获得(即USP 峰宽)。
3 结果与讨论
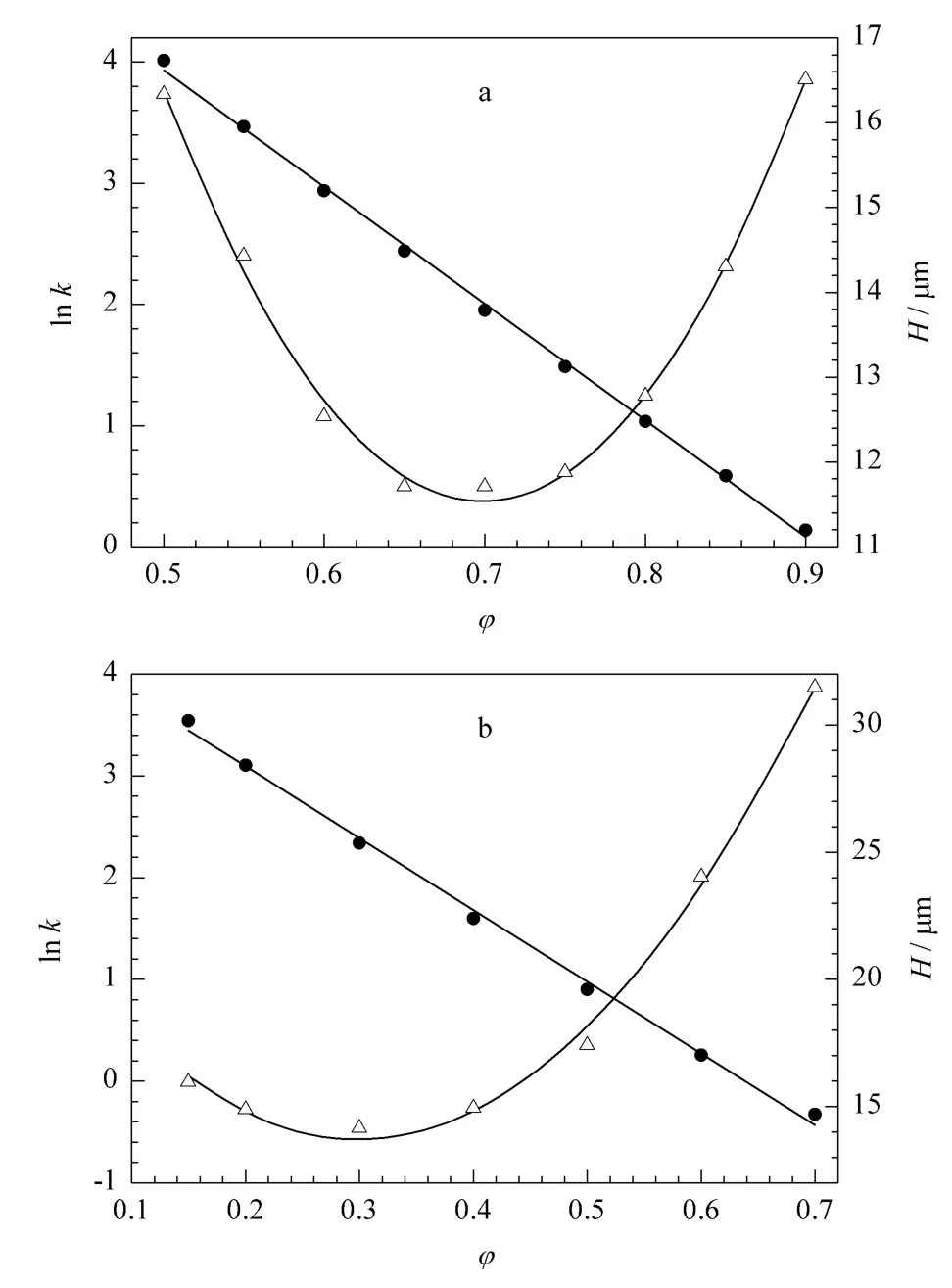
图1 (a)联苯和(b)苯乙酮的lnk-φ 和H-φ 曲线Fig.1 Plots of lnk-φ and H-φ for (a)biphenyl and (b)acetophenone
实验中首先通过等度洗脱考察了联苯和苯乙酮在不同甲醇体积分数条件下的出峰情况,实验结果见图1。由图1 可见,lnk 和H 与流动相中甲醇体积分数的关系可分别通过式(1)和式(4)进行描述。另外,理论塔板高度随流动相组成的改变而发生了明显变化。这是因为一些与传质过程相关的物理参数,如流动相的黏度等会随着流动相中甲醇体积分数的改变而发生变化。这一结果表明,当计算GLC中的色谱峰宽时,流动相组成对理论塔板高度的影响也必须考虑在内。
图2 是实验测得的柱入口处的甲醇体积分数随时间的变化曲线。由图2 可见,在梯度曲线的拐角处,曲线的形状均发生了不同程度的弥散化,而这在阶梯梯度(图2b)以及斜率较高的线性梯度(图2a中最左侧的曲线)中表现得尤为明显。梯度曲线形状的改变是由于溶剂在混合器中的混合以及受到在管线中轴向扩散等因素的影响,导致甲醇体积分数的实际值与设定值之间产生了偏差。而这种偏差会使梯度曲线的形状呈现出非线性的特点,从而势必会对溶质谱带的宽度产生影响。
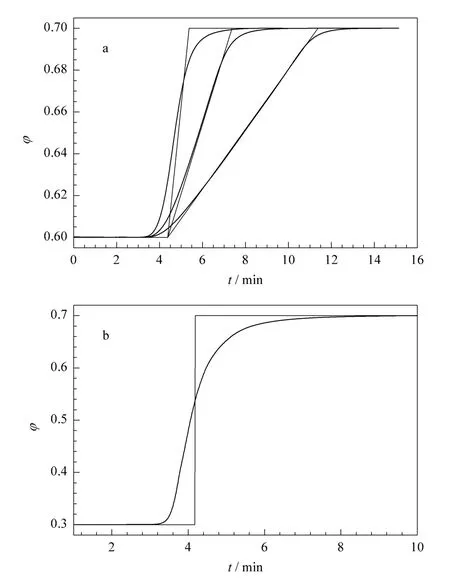
图2 柱入口处测得的梯度曲线Fig.2 Gradient profiles obtained at column inlet
为了考察上述梯度曲线变形对色谱峰宽的影响,我们分别基于在输液系统中设定的梯度曲线(即表1)以及在柱入口处测得的梯度曲线,计算得到色谱峰宽的理论值,并将这些理论值与实验值进行了比较,结果见表2。
从表2 可以看到,当将梯度曲线变形的影响考虑在内后,计算得到的峰宽的理论值(即Theoretical value 2 一栏)比未考虑梯度曲线变形影响的理论值(即Theoretical value 1 一栏)更接近于实验值。另外,在阶梯梯度中,当初始和终止流动相的比例相差较小时(如苯乙酮中第1 至4 项实验),梯度曲线变形对色谱峰宽计算的影响较小,即表2 中Theoretical value 1 与Theoretical value 2 的值以及与实验值的差异不大;而当初始和终止流动相的比例相差较大时(如苯乙酮中第5 和第6 项实验),基于设定的梯度曲线计算得到的理论值与实验值之间差异明显;当将梯度曲线变形的影响考虑在内后,这种差异显著降低。上述结果表明,GLC 中梯度曲线的变形会对色谱峰宽产生影响。当梯度曲线中的流动相组成在短时间内出现显著变化时,梯度曲线变形对色谱峰宽的影响就需要考虑在内。另外,图2b 中柱入口处测得的梯度曲线呈现一种S 型的非线性特征。由该曲线计算得到的峰宽理论值要小于相应阶梯梯度条件下的理论值。这一结果暗示非线性的梯度曲线将有助于获得更窄的色谱峰宽。目前,许多商品化的液相色谱仪都具备非线性梯度设定的功能,然而实践中非线性梯度洗脱的应用还不是很多。本文的研究将为今后非线性梯度条件的选取以及优化打下基础。
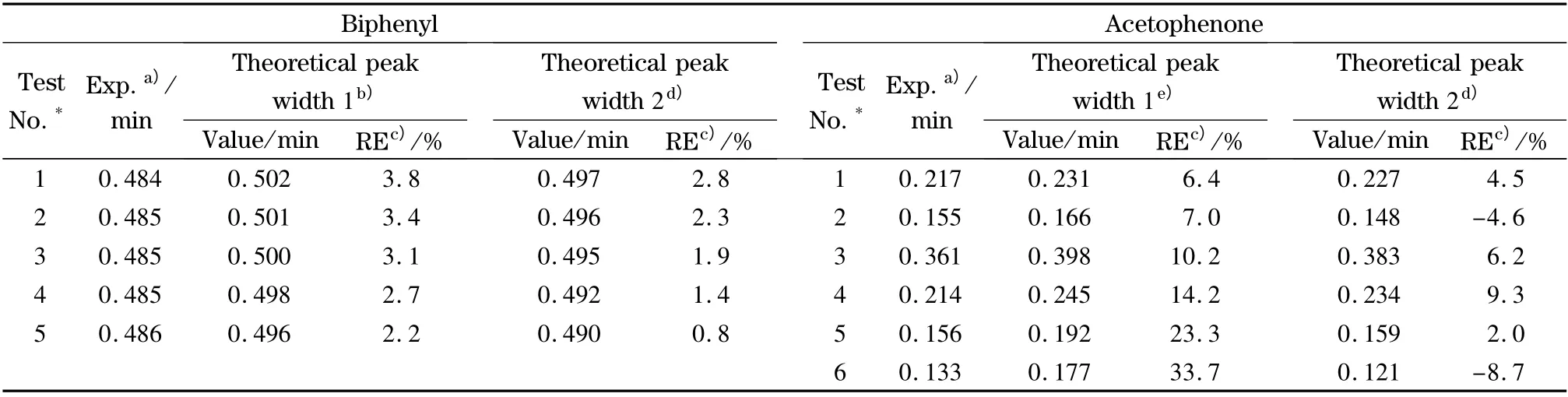
表2 不同梯度洗脱条件下色谱峰宽的理论值与实验值的比较Table 2 Comparison of theoretical and experimental values of peak width under different gradient conditions
4 结论
本文研究了GLC 中梯度曲线变形对色谱峰宽的影响。研究结果表明,在阶梯梯度以及斜率较高的线性梯度中,实际的梯度曲线形状会与设定形状之间存在较大差异,而这种差异将会对色谱峰宽产生影响。因此,当梯度曲线中存在类似的形状时,在计算色谱峰宽时需要将梯度曲线变形的影响考虑在内。另外,柱入口处的梯度曲线呈现出S 型的非线性特征;基于该曲线计算得到的峰宽理论值要小于相应阶梯梯度条件下的理论值。这一结果暗示了非线性梯度洗脱在实践应用中的潜在价值。
[1] Zhu Y Z,Feng Y N,Kim J. Chinese Journal of Chromatography (朱永哲,冯雅男,金正汉. 色谱),2013,31(9):850
[2] Wiczling P,Kaliszan R. Anal Chem,2010,82(9):3692
[3] Zisi C,Fasoula S,Nikitas P,et al. Analyst,2013,138:3771
[4] Hao W Q,Zhang X M,Hou K Y. Anal Chem,2006,78(22):7828
[5] Hao W Q,Zhang X M,Hu F L. Anal Chem,2007,79(6):2507
[6] Poppe H,Paanakker J,Bronckhorst M. J Chromatogr,1981,204:77
[7] Gritti F,Guiochon G. J Chromatogr A,2007,1145:67
[8] Gritti F,Guiochon G. J Chromatogr A,2008,1212:35
[9] Gritti F,Guiochon G. J Chromatogr A,2008,1178:79
[10] Gritti F,Guiochon G. J Chromatogr A,2009,1216:6124
[11] Hao W Q,Di B,Chen Q,et al. J Chromatogr A,2013,1295:67
[12] Hao W Q,Di B,Chen Q,et al. J Chromatogr A,2014,1369:191
[13] Sun X L,Hao W Q,Wang J D,et al. Chinese Journal of Chromatography (孙小丽,郝卫强,王俊德,等. 色谱),2013,31(8):753
