高脂血症血清脂肪酸分析
2015-12-24刘小珊,赵秀举,胡志雄等
通信作者:张维农(1969-),男,教授,E-mail:zhangweinong@163.com.
高脂血症血清脂肪酸分析
刘小珊,赵秀举,胡志雄,齐玉堂,张维农
(武汉轻工大学 食品科学与工程学院,湖北 武汉 430023)
摘要:探讨高脂血症小鼠血清脂肪酸水平的变化。以高脂血症小鼠为模型,以生化检测指标为基础,通过GC—MS检测技术监测基础组、高脂组及配方油脂干预组小鼠血清脂肪酸的差异。将50只SPF级KM系雄性小鼠随机分为基础组、高脂组、配方油低中高剂量组。连续喂养4周,提取小鼠血清,检测血清生化指标,并使用气相色谱—质谱联用技术检测其脂肪酸的种类与含量。结果表明,成功建立高脂血症小鼠模型,且小鼠血清脂肪酸种类并无差别;而与基础组比较,高脂组C14∶0、C16∶1、C18∶1、C22∶6的含量有显著性差异;与高脂组相比,配方油组各脂肪酸含量均有不同程度变化,其中C16∶1、C18∶1、C22∶6的含量变化趋势显著(P<0.05);且不饱和脂肪酸比例在各组之间也有显著性差异。根据GC—MS(气质联用)监测结果可知,C16∶1、C18∶1、C22∶6三种脂肪酸在各组之间变化显著,与高脂血症代谢异常有关,血清不饱和脂肪酸比例与高脂血症关系密切。
关键词:高脂血症;血清脂肪酸;GC—MS;不饱和脂肪酸
收稿日期:2015-03-23.修回日期:2015-05-12.
作者简介:刘小珊(1989-),女,硕士研究生,E-mail:13554338623@163.com.
基金项目:国家自然科学
文章编号:2095-7386(2015)03-0025-06
DOI:10.3969/j.issn.2095-7386.2015.03.006
中图分类号:R 589.2
Research on biomarkers in serum fatty acids of hyperlipidemia
LIUXiao-shan,ZHAOXiu-ju,HUZhi-xiong,QIYu-tang,ZHANGWei-nong
(School of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract:To explore the differences of serum free fatty acids (FFA) of hyperlipidemia.Based on the hyperlipidemia model, the biochemical detection index, looking at the differences of serum fatty acids of group, fat group, formula oil low, medium, high dose groups. After continuously feeding four weeks, the serum was taken, the biochemical indexes were detected and the content of fatty acids were detected with gas chromatography-mass spectrometry. The results showed that the model of hyperlipidemia was successfully established and there was no species difference in all these fatty acids. Compared with the basic group, the content of C14∶0,C16∶1,C18∶1,C22∶6 of high-fat group were significantly different. Compared with the high-fat group, the fatty acid of formula oil groups varied on some degrees, and the diversification of C16∶1、C18∶1、C22∶6 was significantly. The ratio of unsaturated fatty acid was significantly difference between the groups. Based on GC-MS monitoring results, we could know that C16∶1,C18∶1,C22∶6 changed significantly between the groups, and could be related with the abnormal metabolism of hyperlipidemia, and the proportion of unsaturated fatty acids in serum had a close relationship hyperlipidemia.
Key words:hyperlipidemia; serum fatty acids; GC-MS; unsaturated fatty acids
1引言
游离脂肪酸即非酯化脂肪酸或未酯化脂肪酸是人体内重要活性物质,参与多种生理功能,代谢活性高且易受脂肪代谢影响;随着血清游离脂肪酸与疾病关系的研究不断深入,已证实游离脂肪酸,尤其是不饱和脂肪酸[1-2]与很多系统疾病的发生发展有关。有研究显示血清中脂肪酸组成能反映某些疾病特点,饱和脂肪酸有促进血小板聚集作用,可诱发冠状动脉急性阻塞而导致心肌梗塞;不饱和脂肪酸中的亚油酸、亚麻酸和花生四烯酸属于必需脂肪酸,对人体有重要作用[3-8]。临床医学证实血清游离脂肪酸的浓度变化与很多疾病有关。因此测定人体中脂肪酸含量,寻找潜在疾病标志物,对于疾病预防控制、治疗有意义[9-10]。笔者在血清生化检测结果的基础上,研究功能性油脂干预后的各组小鼠血清脂肪酸的差异,期待找到与高脂血症血清脂质代谢异常相关的物质,为进一步深入研究提供参考。
2材料与方法
2.1材料与试剂
SPF级KM系小鼠60只,18—20 g,雄性,由湖北省疾控中心实验动物研究中心提供;功能性油脂:配方油(85%米糠油、10%亚麻籽油、5%玉米油),中兴能源湖北有限公司提供;动物基础饲料,华中科技大学同济医学院动物实验中心;康德牌蛋黄粉,江苏南通康德生物制品有限公司;新鲜猪油,武商量贩常青店;胆盐3号,国药集团试剂有限公司;胆固醇(纯度大于95%),Aladdin公司;高脂饲料(自制),配比为78.8%的基础饲料粉料、10%的猪油、10%的蛋黄粉、0.2%胆盐3号、1%胆固醇;正己烷(色谱纯),天津市科密欧化学试剂有限公司;浓硫酸(分析纯) 、甲醇(分析纯)、氯化钠(分析纯),天津市天力化学试剂有限公司;总胆固醇试剂盒(酶法)、甘油三酯试剂盒(酶法)、高密度脂蛋白胆固醇试剂盒(选择性沉淀法)、低密度脂蛋白胆固醇试剂盒(选择性沉淀法),北京北化康泰临床试剂有限公司;葡萄糖测定试剂盒(葡萄糖氧化酶法),中生北控生物科技股份有限公司。
2.2仪器与设备
XW-80A微型漩涡混合仪,上海沪西分析仪器厂有限公司;ACS-3JZ电子计重秤,中山市衡新电子有限公司;TGL-16G 台式离心机,上海安亭科学仪器厂制造;DZF-6021型真空干燥箱,上海精宏实验设备有限公司;Agilent7890GC/5975C气相色谱质谱联用仪,美国Agilent公司;HH-4数显恒温水浴锅,国华电器有限公司。
2.3实验方法
2.3.1动物分组与喂养
60只SPF级昆明系雄性小鼠18 g左右在25 ℃,湿度为70%的环境下适应10 d,淘汰掉体重较平均值低以及病态的小鼠10只。适应期间全部喂养基础饲料和饮用水,自由取食。适应期后将剩下的50只小鼠随机分为5组(A—E组),每组10只。其中A组在实验期间喂养基础饲料,剩余组均喂养高脂饲料(78.8%基础饲料、1%胆固醇、0.02%3号胆盐、1%蛋黄粉、10%猪油)。
此外C—E组小鼠每天定点灌胃配方油(85%米糠油、10%亚麻籽油、5%玉米油),喂养4周。分组情况和剂量设置如表1所示。
表1小鼠实验分组与剂量/(mL/10g)
2.3.2小鼠血清的提取
禁食12 h后,对小鼠采取摘除眼球法取血,随后引颈处死。采集的血液4 ℃静置30 min以上,3 000 r/min离心10 min,取上层血清并转移到液氮中保存,最后将所有分离出的血清转移到-80 ℃条件下保存待测。
2.3.3小鼠血清血生化检测
血清中需要检测的指标主要有总甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。采用酶法试剂盒来检测血脂的各项指标[11],根据测量结果判定血脂调节效果。
2.3.4小鼠血清甲酯化
甲酯化方法参照李海静[1]、马晓丽[2]的实验方法。取血清样品100 μL于EP管中,加1 mL 10% H2SO4和甲醇混合溶液,涡匀震荡。于70 ℃恒温水浴30 min,结束后冷却至室温,在试管中加入1 mL正己烷和1 mL饱和食盐水,震荡萃取,3 000 r/min离心10 min,取上层正己烷,N2吹干,用100 μL正己烷复溶后,待用。
2.3.5气相色谱—质谱分析
色谱条件:HP-FFAP石英毛细管色谱柱(30 m×0.32 mm,0.25 μm);采用程序升温法:起始温度为100 ℃,保持1 min,然后以3 ℃/min升到220 ℃,保持29 min。载气为N2。质谱条件:电子能量70 eV,传输温度250 ℃,离子源温度220 ℃,电离方式EI-,质量扫描范围m/z50—800。
2.3.6数据处理
3结果与讨论
3.1各组血清生化指标检测结果
本实验功能性油脂的降脂功效以生化检测结果为依据,各组小鼠血清的TC、TG、LDL-C、HDL-C含量整理见表2。(1)总胆固醇:与空白组相比,高脂组血清TC水平有极显著差异,说明高脂组小鼠在饲养高脂饲料期间TC水平明显升高。与高脂组相比,配方油高、中剂量组有显著差异,说明配方油能显著减少TC水平。(2)总甘油三酯:与空白组相比,高脂组小鼠血清中TG水平有极显著差异。与高脂组相比,配方油高低剂量组有显著性差异,说明配方油能降低血清TG水平。(3)低密度脂蛋白胆固醇:与空白组相比,高脂组小鼠血清LDL-C水平有极显著差异。与高脂组相比,低剂量配方油组有显著性差异。(4)高密度脂蛋白胆固醇:与空白组相比,高脂组小鼠血清HDL-C水平有极显著差异;与高脂组相比,配方油各剂量组均显著升高血清HDL-C水平。根据以上分析结果可知:配方油有辅助降血脂功效。
3.2基础组、高脂血症组、配方油脂干预组脂肪酸检测结果
3.2.1各组小鼠血清脂肪酸定量分析

表2 各组小鼠血脂指标 /(mmol/L)
注:(1)■■与A组比较有极显著差异(P<0.01);(2)■与A组比较有显著差异(P<0.05);(3)##与B组比较有极显著差异(P<0.01);(4)#与B组相比有显著差异(P<0.05)。
在该实验条件下,各组小鼠血清游离脂肪酸都可以得到完全分离,各组均检测到C14∶0、C16∶0、C16∶1、C18∶0、C18∶1、C18∶2、C20∶3、C20∶4、C22∶6。各组小鼠血清脂肪酸只有量的差异,无种类差异。
使用峰面积归一法,测得各组小鼠血清脂肪酸相对百分含量,详见表3。
(1)B组(高脂组)与A组(基础组)相比较,C14∶0、C16∶1有显著性差异(P<0.05),C18∶1、C22∶6有极显著性差异(P<0.01)。C16∶0、C18∶0、C18∶2、C20∶3、C20∶4都有不同程度的差异,但是差异不显著(P>0.05)。综上可知高脂组相对于基础组而言C14∶0、C16∶1、C18∶1、C22∶6四种脂肪酸变化显著。
(2)C—E组与B组比较,C14∶0的含量有上升趋势,但是C—E组C14∶0整体与B组比较差异不显著;C16∶1的含量有下降趋势,其中D、E组差异显著(P<0.05),C组差异极显著(P<0.01);C18∶1的含量整体下降,C—E组差异均显著(P<0.05);C22:6含量上升,且C—E组差异显著(P<0.05);而剩余五种被检测出的脂肪酸在C—E组与B组之间虽然也产生差异,但是差异不显著。综上可知C—E组也即配方油干预组相对于B组也即高脂组而言,C16∶1、C18∶1、C22∶6三种脂肪酸变化显著。
表3小鼠血清脂肪酸相对含量的变化

脂肪酸ABCDEC14:01.228±0.0750.672±0.245▲0.796±0.0560.878±0.3100.928±0.198C16∶031.402±2.83228.009±2.38827.663±0.83828.941±0.38232.206±6.793C16∶11.237±0.2062.850±0.939▲0.581±0.224◆◆0.766±0.052◆0.858±0.129◆C18∶015.844±0.53017.360±0.93716.550±0.48317.134±0.37216.612±2.318C18∶19.463±1.08813.414±0.894▲▲11.371±0.897◆11.308±0.972◆9.805±2.100◆C18∶218.510±2.39619.183±1.59721.247±0.74919.370±1.13717.693±2.149C20∶32.090±0.4272.197±0.6343.896±0.691◆3.912±0.676◆4.138±0.943◆C20∶48.880±1.02512.067±1.93811.358±0.88511.533±0.63211.990±2.745C22∶68.853±0.4084.248±0.289▲▲6.537±1.261◆6.157±0.853◆5.770±0.998◆
(1)▲▲与A组比较有极显著差异(P<0.01);(2)▲与A组比较有显著差异(P<0.05);(3)◆◆与B组比较有极显著差异(P<0.01);(4)◆与B组相比有显著差异(P<0.05)。
C16∶1,C18∶1和C22∶6三种脂肪酸水平对比图见图1,图2和图3。
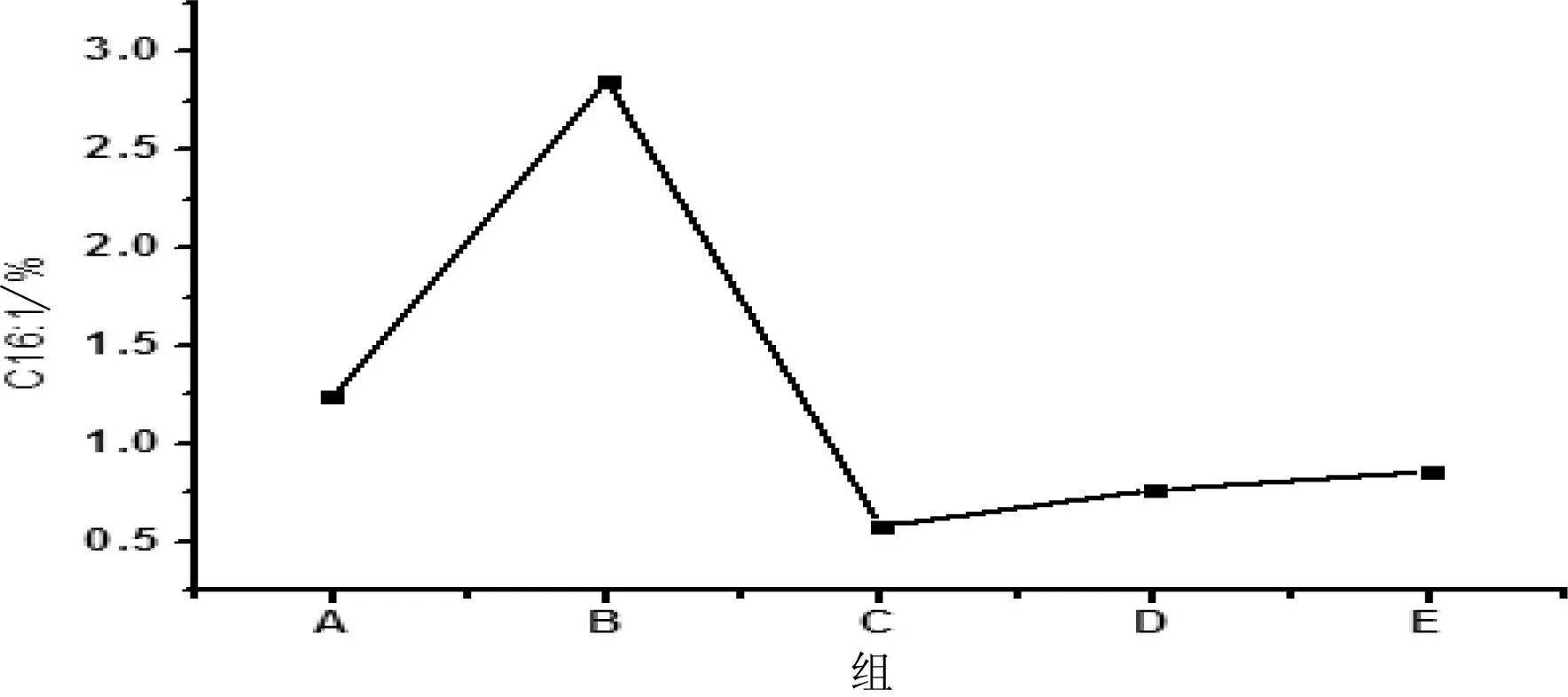
图1 各组小鼠C16∶1水平

图2 各组小鼠C18∶1水平

图3 各组小鼠C18∶1水平
从以上分析结果可知,C16∶1、C18∶1、C22∶6三种脂肪酸在各组之间变化具有规律性,且有统计学意义,功能性油脂具有减小高脂组与基础组间差别的作用。说明C16∶1、C18∶1、C22∶6这3种脂肪酸与高脂血症代谢异常有着密切关系。
3.2.2各组小鼠血清不同类型脂肪酸差异
根据表3的统计结果,将每组脂肪酸进行分类,分析各组小鼠血清不同类型脂肪酸的变化情况,见表4。
(1)B组和A组比较,MUFA、MUFA/UFA、PUFA/UFA含量有极显著性差异(P<0.01),SFA、UFA、PUFA、SFA/UFA差异不显著(P>0.05)。说明B组也即高脂组相对于A组也即基础组而言,MUFA、MUFA/UFA、PUFA/UFA变化显著。
(2)C—E组与B组比较, MUFA含量整体下降,其中C—E组变化均具有统计学意义(P<0.01);PUFA/UFA含量上升,C—E组变化都有统计学意义(P<0.05、P<0.01);而MUFA/UFA只有E组变化具有统计学意义,C组、D组变化没有统计学意义;SFA、UFA、PUFA、SFA/UFA变化不显著(P>0.05)。综上可知MUFA、PUFA/UFA、MUFA/UFA在高脂组与配方油干预组之间的变化较显著。
不饱和脂肪酸含量在各组之间有显著性差异,各类不饱和脂肪酸的比例分配在各组之间也具有显著性差异。得出某一类脂肪酸尤其是不饱和脂肪酸也可能作为研究高脂血症的一个关注点。
表4小鼠血清脂肪酸的分类比较

脂肪酸ABCDESFA(饱和脂肪酸)49.894±2.78146.041±2.44045.009±0.47446.953±0.06149.746±6.944UFA(不饱和脂肪酸)50.106±2.78153.960±2.44054.991±0.47453.047±0.06150.254±6.944MUFA(单不饱和脂肪酸)10.667±1.14616.264±1.206★★11.953±1.106●●12.074±0.982●●10.663±2.208●●PUFA(多不饱和脂肪酸)39.439±1.74837.695±3.21543.038±1.576●40.973±1.04139.591±4.858SFA/UFA1.000±0.1100.856±0.0850.819±0.0160.885±0.0021.018±0.300MUFA/UFA0.213±0.0130.302±0.031★★0.217±0.0220.228±0.0190.211±0.017●●PUFA/UFA0.787±0.0130.698±0.031★★0.783±0.022●●0.772±0.019●0.789±0.017●●
(1)★★与A组比较有极显著差异(P<0.01);(2)★与A组比较有显著差异(P<0.05);(3)●●与B组比较有极显著差异(P<0.01);(4)●与A组比较有显著差异(P<0.05)。
4结论
血清中FFAs在健康状态下处于相对平衡状态,只有疾病状态下导致某个系统功能紊乱,血清脂肪酸平衡状态被打破,其组成才会发生改变[12]。胰岛素抵抗[13-14]、糖尿病[15-17]等多种代谢疾病都存在血清游离脂肪酸升高的现象。其机理是,脂肪细胞增生,脂肪体积增大,肿瘤坏死因子等细胞因子表达增多,脂肪分解速率明显增加,脂肪代谢紊乱,大量FFA进入血清,引起高FFA血症。血清游离脂肪酸跟其他血脂相比,能更灵敏,更早,更准确地反映机体血脂代谢紊乱状况,不同脂肪酸在脂质代谢中所表现作用不同,因此对血清游离脂肪酸进行检测可以发现早期脂质代谢异常,起到预警作用[18]。单不饱和脂肪酸可降低心血管疾病的发病率, n-3和n-6PUFAs可降低血清甘油三酯水平,预防心血管疾病[19-21]。
本研究中,高脂组C16∶1、C18∶1、C22∶6相对于基础组差异显著 ,配方油干预组相对于高脂组而言,C16∶1、C18∶1、C22∶6三种脂肪酸含量变化也显著,可得出C16∶1、C18∶1、C22∶6与高脂血症脂质代谢异常有密切关系。而MUFA、MUFA/UFA、PUFA/UFA变化也较显著,高脂组MUFA显著高于基础组,PUFA/UFA显著低于基础组,得出不仅各种血清脂肪酸含量多少对生理功能有影响,各类脂肪酸占总脂肪酸比例也应得到重视,尤其是不饱和脂肪酸。
综上所述,血清中C16∶1、C18∶1、C22∶6含量随饮食改变产生的变化显著,可做为疾病早期血清脂肪酸变化的敏感指标物。由于疾病组游离血清脂肪酸谱较正常组发生改变,为更好地控制疾病的发生以及更好地进行疾病的后期治疗,应对血清脂肪酸水平的变化加以关注,做到早发现早干预、早治疗。
参考文献:
[1]李海静, 吴胜明, 方均健, 等. 气质联用法测定人血清游离脂肪酸[J]. 质谱学报, 2009, 30(2): 84-87.
[2]马晓丽, 田兰, 李琳琳, 等. 基于气相色谱的血清中游离脂肪酸代谢轮廓分析区分糖尿病与正常人[J]. 分析科学学报, 2013, 29(5): 615-619.
[3]徐惠珠, 张伟利, 陈瑞冠. 气相色谱法测定人体血液中游离脂肪酸[J]. 营养学报, 1986, 8(2): 165-170.
[4]许自超, 李晓晔, 蒋静霞, 等. 气相色谱法测定恶性血液病患者血浆中游离脂肪酸的含量[J]. 色谱, 1994, 12(4): 268-269.
[5]王俊义, 许自超, 李晓晔, 等. 脂肪乳剂Intralipid对全胃切除后病人脂肪酸代谢的影响[J]. 中国临床营养杂志, 1994, 2(4):163-166.
[6]何桂珍, 蒋朱明. 两种测定血浆非酯化脂肪酸方法的比较[J]. 中国临床营养杂志, 1994, 2(2): 69-80.
[7]胡永狮, 杨巷菁. 气相色谱法测定血清中游离脂肪酸及其在临床中的应用[J]. 色谱, 1990, 8(1): 59-60.
[8]王传丰, 陈瑞冠, 刘红, 等. 脂肪组织和血浆标本中脂肪酸的气相色谱分析[J]. 营养学报, 1990, 12(4): 398-404.
[9]李向慧. 血清中脂肪酸标记物GC-MS分析方法的建立及应用研究[D]. 温州: 温州医学院, 2013.
[10]应珊红, 栾霞, 安友仲. 气相色谱法测定手术前后人体血浆中游离脂肪酸含量的变化[J]. 现代仪器, 2000(3): 30-33.
[11]中华人民共和国卫生部医政司编著. 全国临床检验操作教程[M]. 南京: 东南大学出版社, 2006.
[12]Bahrami G, Ghanbarian E, Masoumi M, et al. Comparison of fatty acid profiles of aorta and internal mammary arteries in patients with coronary artery disease[J]. Clin Chim Acta, 2006, 370(1/2): 143-146.
[13]Kim JY, Park JY, Kim OY, et al. Metabolic profiling of plasma in overweight/obese and lean men using ultra performance liquid chromatography and Q-TOF mass spectrometry (UPLC-Q-TOF MS)[J]. J Proteome Res, 2010, 9(9): 4368-4375.
[14]高青松, 刘源, 赵爽, 等. 不同类型脂肪酸对SD大鼠血清脂肪酸及胰岛素抵抗的影响[J]. 中国比较医学杂志, 2010, 20(5): 50-56.
[15]Liu L, Li Y, Guan C, et al. Free fatty acid metabolic profile and biomarkers of isolated post-challenge diabetes and type 2 diabetes mellitus based on GCMS and multivariate statistical analysis[J]. J Chromatogr B Analyt Technol Biomed life Sci, 2010, 878(28): 2817-2825.
[16]辛衍代. 基于GC-MS技术高脂饮食干预的肥胖抵抗大鼠代谢组学研究[D]. 济南: 济南大学, 2012.
[17]李嘉强, 戴颖秀, 刘玉敏, 等. 高血压患者血清脂联素与游离脂肪酸、糖及脂代谢[J]. 高血压杂志, 2006, 14(5): 352-355.
[18]韩雪玲, 于海涛, 胡丽贞, 等. GCMS方法检测超重/肥胖男性青年血清游离脂肪酸代谢谱[J]. 营养学报, 2013, 35(2): 137-141.
[19]张坚, 孟丽苹, 姜元荣, 等. 中国成人膳食脂肪酸摄入和食物来源状况分析[J]. 营养学报, 2009, 31(5): 424-427.
[20]Rajni Chopra, Kari Sambaiah. Effects of rice bran oil enriched with n-3 PUFA on liver and serum lipids in rats [J]. Lipids, 2009, 44(1): 37-46.
[21]Arne Nordøya, Roberto Marchioli, Harald Arnesenc, et al. n-3 Polyunsaturated Fatty Acids and Cardiovascular Diseases: To Whom, How Much, Preparations [J]. Lipids, 2001, 36(1): 127-129.
