1D TOCSY 技术用于水溶液中氨基葡萄糖结构指认
2015-12-23叶剑良欧阳捷
叶剑良, 欧阳捷, 陈 忠
(厦门大学a. 化学化工学院;b. 物理与机电工程学院,福建 厦门361005)
0 引 言
D-氨 基 葡 萄 糖 盐 酸 盐 (D-Glucosamine Hydrochloride,GAH,化学名为2-氨基2-脱氧D-葡萄糖盐酸盐)和 N-乙酰-D-氨基葡萄糖(N-Acetyl-DGlucosamine,GlcNAc)是生物体细胞中糖链的重要组成单元,也是一类具有显著生物活性的氨基葡萄糖类化合物[1]。氨基葡萄糖在人体内分布非常广泛,其在血液中的正常浓度比葡萄糖浓度还高。但一般都以与蛋白质结合的状态参与人类的重要生理活动[2],无游离态存在。由于具有显著的抗炎、抗肿瘤、抗氧化、免疫调节和防腐抗菌等功效[3-5],这类化合物在药物、保健食品和美容产品中应用广泛。开展氨基葡萄糖结构及光谱学特性的研究,能够为该类化合物的化学修饰改性工作提供很好的参考价值[6-9]。
核磁共振(NMR)应用于糖化合物的结构鉴定[10]始于20 世纪70 年代,该技术可直接测定单糖、寡糖以及糖链的结构,能为研究者省去许多复杂的化学降解步骤。但目前有关氨基糖及其衍生物的NMR 谱研究报道相对较少[3,11]。而氨基糖类化合物在水溶液中很容易发生变旋,由单一构型化合物变为α,β 两种构型的混合物,加之糖环质子化学位移差异不大,导致信号相互重叠交叉严重,极大增加了核磁谱图的复杂性。如果遵循常规思路,需要各类型1H、13C 及2D NMR(包括COSY、HSQC、HMBC、TOCSY 甚至NOESY 等)实验数据综合推敲,才能保证此类化合物的结构得以准确解析。本文利用选择性1D TOCSY 技术随混合时间的延长能由近到远顺序提取耦合网络中不同位置质子信息的特点[12-13],使得同一端基异构体糖环上的质子选择性地顺序出峰,有效地消除了谱峰重叠的影响,快速、明确地完成了无法分离的α,β-氨基糖端基异构体混合物的质子信号的分组归属和核磁信息全指认流程。该结论得到了2D NMR 实验数据的很好验证。
1 实验部分
1.1 仪器设备
实验均在AVANCE Ⅲ500 型超导核磁共振波谱仪(德国布鲁克公司)上完成,配有11.74 T 牛津超导磁体,三通道检测系统,BVT3000 温控单元,5 mm Z 梯度宽带探头(BBO Probe)和TOPSPIN2.1 核磁共振专用软件。
1.2 试剂和样品
重水(D2O,北京金鸥翔科贸有限公司,氘代度大于99.9%)。
待测样383 和170 均为白色粉末状晶体,易溶于溶剂重水(D2O),分子式为C6H14NO5Cl 和C8H15NO6,初步判断为化合物D-氨基葡萄糖盐酸盐和N-乙酰-D-氨基葡萄糖。
1.3 实 验
1D TOCSY[14-15]技术是二维TOCSY 实验的一维简化,选择性1D TOCSY[16]则是通过优化整形脉冲的脉冲形状、宽度、强度、间隔(即混合时间),对目标核进行激发,最终能够选择性地顺序(随相隔共价键数由近及远)获得同一自旋体系下,与激发核直接或间接耦合的质子信息[17],在糖环类结构解析中具有独特的优势[18-19]。综合选择性、信噪比及峰型等方面的实验效果考虑,本工作选择Gaussian 脉冲,以糖环上异头质子峰为激发中心,信号激发宽度为16 Hz。通过改变整形脉冲的混合时间,获得系列1D TOCSY 谱,对糖环质子位移信息进行指认。混合时间选择区间为10 ~200 ms。
在此基础上,结合13C NMR、DEPT135、HSQC 和HMBC 实验结果完成对2 种氨基糖类化合物的α,β构型混合物氢、碳核磁信息的全指认。所有实验均在室温条件(298 K)条件下完成。
2 结果与讨论
2.1 常规1H NMR、13CNMR 数据分析
重水溶解待测样383 和170,其常规1H NMR 谱的信号均明显严重重叠(见图1)。以样品383 为例,如果其为单一的D-氨基葡萄糖盐酸盐化合物,扣除羟基及氨基活泼氢(实际检测中会被重水氘代而不产生质子峰)数目,结构中只有7 个质子。而实际氢谱,以δH4.5 以上积分值约为1.0∶0.6 的2 组质子信号为参考,其余质子峰积分值分别接近1.0 或0.6 的整数倍,不再满足同一整数比的关系;并且积分总加和值接近1.6 的7 倍;同样,样品170 的1H NMR 谱也呈现出类似情况。
实际采集到的13C NMR 谱中分别有11 和16 个碳峰信号,数量也均接近样品383 和样品170 化学结构中实际碳原子个数的2 倍。
基于以上分析,判断2 个待测样在D2O 溶液中并非以单一化合物形式存在,和D-葡萄糖一样在溶液中发生变旋[22],转化为α,β 两种构型的端基异构体。而两种构型的存在加剧了氢谱信号重叠。
2.2 1D TOCSY 对溶液态构型混合物质子信号的分离与指认
选择性1D TOCSY 技术能够有效提取与激发核在同一耦合体系中、但相隔共价键数递增(由近及远)的不同位置质子信息,是简化分解常规氢谱的有效方法。异头质子处于糖环自旋耦合体系的起始位置,由于直接与2 个氧原子相连,其化学位移一般处于糖环区相对低场(δH5.5 ~4.5),谱峰独立,特征性鲜明,可选择作为该方法提取同一糖环自旋体系其他质子位移信息的切入点。
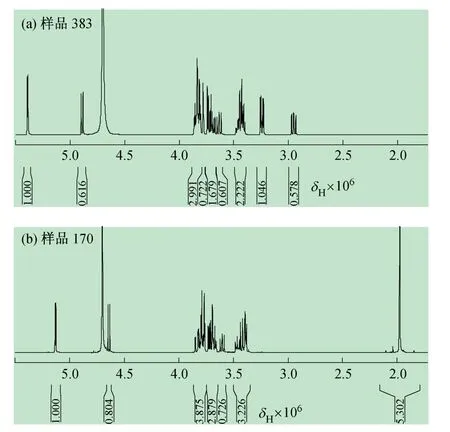
图1 样品1H NMR 谱(D2O)
2.2.1 样品383 的质子信号指认
基于存在2 种构型化合物的假设分析,待测样383 氢谱低场的2 组质子信号δH5.39 (d,J = 3.5 Hz)和δH4.89 (d,J = 8.5 Hz)均符合异头质子信号的特征。质子δH5.39 耦合常数较小(3.5 Hz),应与相连的2 位质子成ae 或ee 键关系,即两质子在糖环同侧,因此其所属化合物应为α 构型;而质子δH4. 89(d,8.5 Hz)与相邻的2'位质子都处于a 键,两质子分别指向糖环上下个方向,所属化合物定为β 构型[20]。由积分值估计2 种构型化合物的含量比约为62∶38,与D-葡萄糖在水溶液中α,β 构型的比例37∶63 正好相反。
以δH5.39 (d,H1)为1D TOCSY 谱的激发中心,逐渐增大混合时间,属于同一化合物383-α 糖环其他质子峰依次“接力”出现(图2 (a-1)自上而下):δH3.24 (dd,H2),δH3. 83 (dd,H3),δH3. 43 (dd,H4)。由于与H3 重叠,无法按信号提取的先后次序定义信号δH3.83,δH3.73 和δH3.79 代表的质子位置,但HSQC 实 验 数 据 显 示δH3. 83 分 别 与δC69. 69 和δC71.56相关,表明δH3.83 确实为2 个不同质子信号的重叠;另外δH3.73 和δH3.79 为同碳质子峰,从而确定以下归属:δH3.83 (m,H5),δH3.73 (dd,H6a)和δH3.79 (dd,H6b)。
以δH4. 89 (d,H1’)为激发中心,在系列1D TOCSY 谱(图2(a-2))中剩余6 组积分值接近0.6 的质子峰依次“接力”出现:δH2.95 (dd)、δH3.64 (dd)、δH3.42 (dt)、δH3.45 (dt),可依次归属为另一构型化合物383-β 上与H1'相隔共价键数递增的2'位、3'位、4'位、5'位质子;最后同步出现的1D TOCSY 相关信号是δH3.85 (dd)与和δH3.69 (dd),结合HSQC 结果定为6'位亚甲基的2 个同碳质子峰。
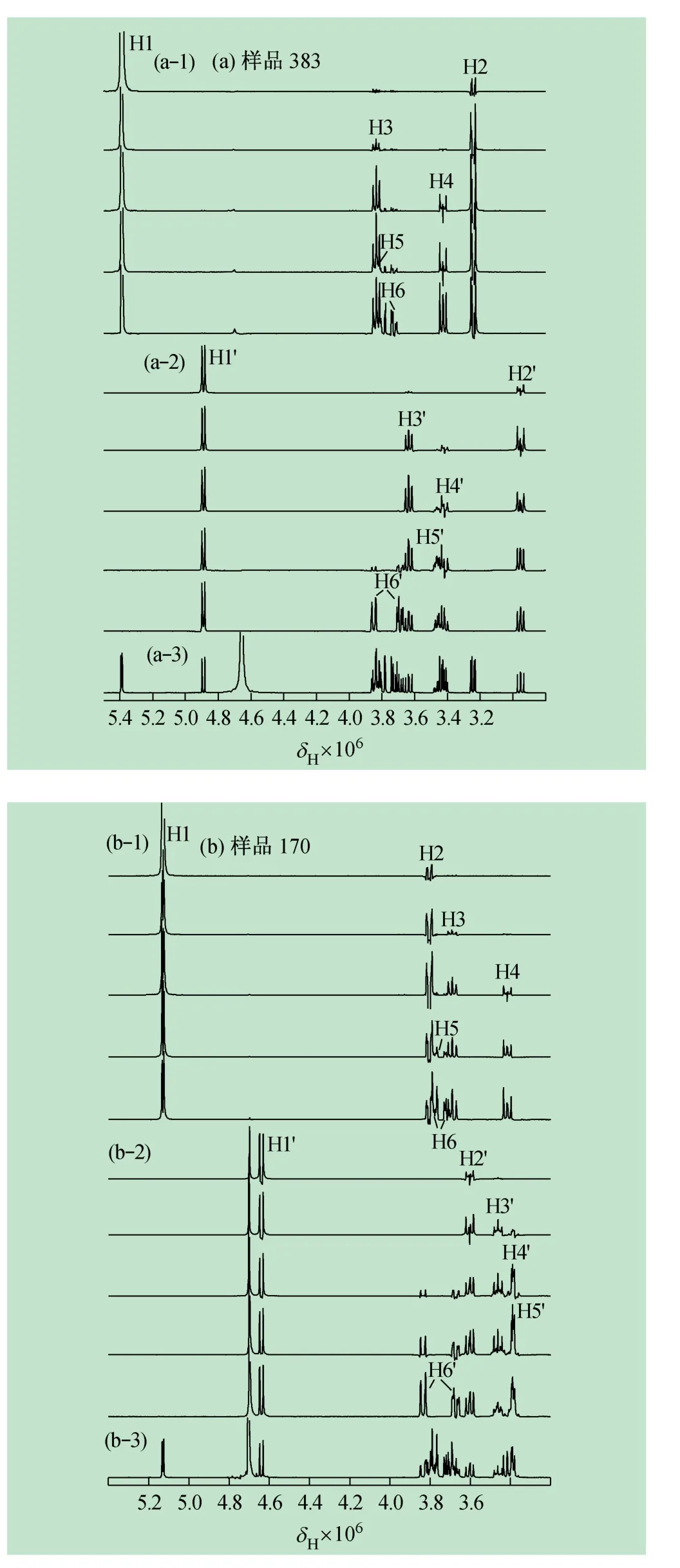
图2 样品的1D TOCSY 图组(D2O)
2.2.2 样品170 的质子信号指认
样品170 氢谱中δH5. 13 (d,J = 3. 5 Hz)和δH4.64 (d,J = 8.5 Hz)符合异头质子信号的特征。结合耦合常数同样可判断,质子δH5.13 所属化合物为1,2 位ae 或ee 键关系的α 构型,δH4.64 所属化合物则为1,2 位aa 键关系的β 构型。由2 组信号的积分值估计这2 种构型化合物的含量比约为55∶45,与上述D-氨基葡萄糖相比,虽然还是α 构型的较多,但两种构型的比例更为接近。
1D TOCSY 系列谱中,以δH5.13 (d,H1)为激发中心(图2(b-1)),按构型化合物170-α 的糖环上其他质子产生的先后顺序归属出:δH3. 80 (dd,H2),δH3.69 (t,H3),δH3.42 (dd,H4),δH3.78 (m,H5),δH3.71 (dd,H6a)和δH3.78 (m,H6b);以δH4. 64(d,H1')为激发中心(图2(b-2)),构型化合物170-β的糖环其他质子位移依次为:δH3. 60 (dd,H2'),δH3.46 (dd,H3'),δH3. 39 (m,H4'),δH3. 39 (m,H5'),δH3.67 (dd,H6a')和δH3.84 (dd,H6b')。其中在1D TOCSY 系列激发实验中,δH3.78 和δH3.39 处信号产生时,均是随混合时间的增加峰强度连续明显增强。依据2 个异头质子积分值之比约为1.0∶0.8,分析氢谱δH3.90 ~3.75、δH3.75 ~3.65、δH3.50 ~3.35三段信号的分组积分值,基本可判断位移δH3.78 和δH3.39 处均分别重叠了2 个质子,即H5 和H6、H4'和H5'的质子峰分别存在重叠。后期HSQC 数据显示,δH3.78 与δC60.59、δC71.56,δH3.39 与δC69.84、δC75.95均同时存在相关,从而进一步验证了以上结论。
2.3 NMR 结构解析和验证
在利用系列1D TOCSY 基本完成了质子信息全指认的基础上,结合DEPT135、HSQC 实验数据,待测样383 和170 的13C NMR 谱的所有连氢碳的位移信息也均一一得到有效指认(见表1)。HMBC 实验结果显示2 个样品共4 种构型异构体的1 位和5 位之间均存在远程氢、碳耦合关系,证明化合物确实成糖环结构;同时其他HMBC 数据也验证了TOCSY 技术指认糖环区氢位移顺序的正确性。另样品170 的碳谱信息显示其2 个构型化合物结构中分别还含有一个羰基和一个甲基片段,但HMBC 数据表明季碳δC174.51 与质子峰δH4.642 (2 位)、δH1.979 (s,3),δC174.75 与质子峰δH4.642(2'位)、δH1.977 (s,3)分别存在远程相关信息,从而170 中各个构型化合物在2 位氨基上连接的乙酰基片段的碳氢位移信息得以确定。
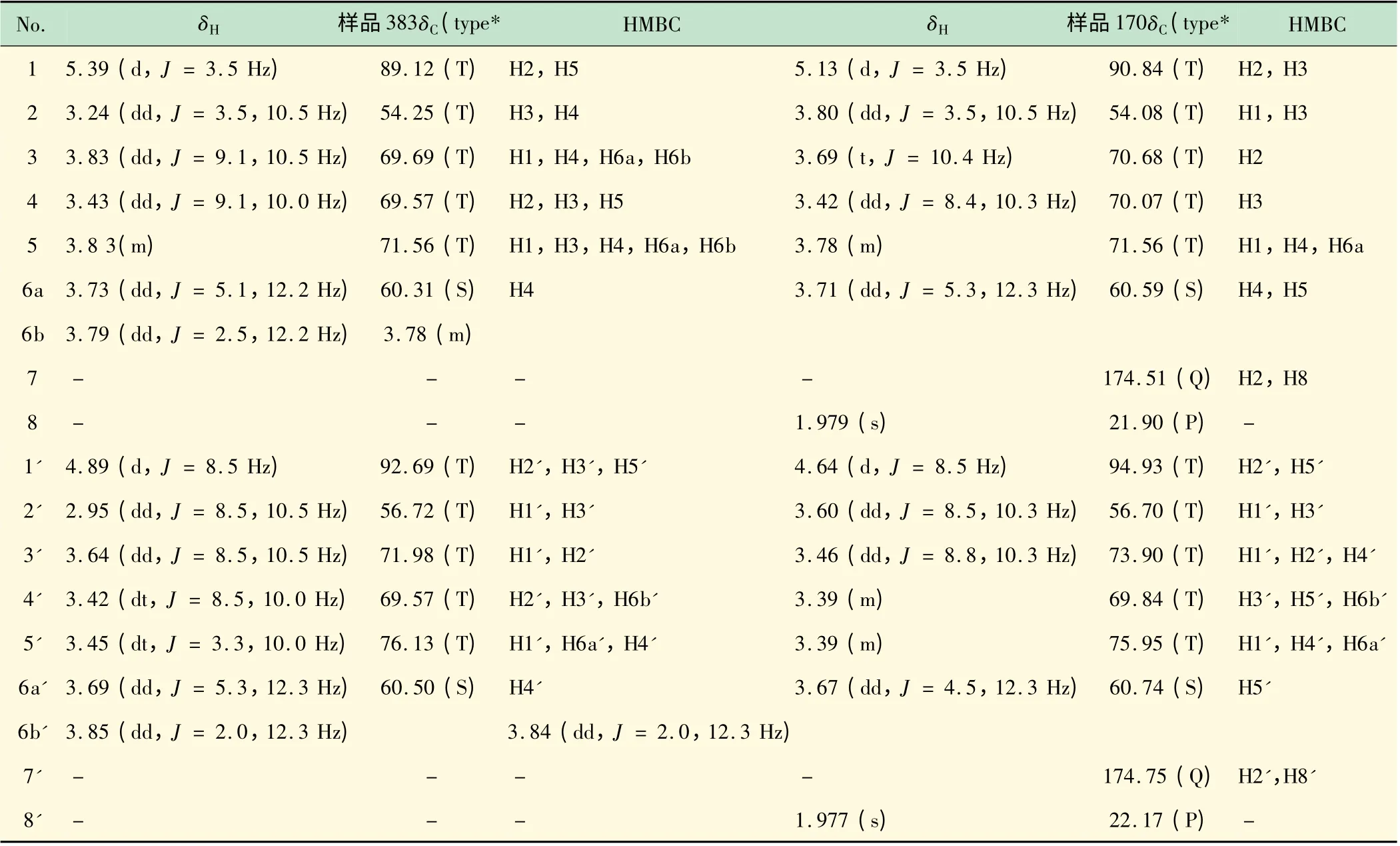
表1 样品383(D-氨基葡萄糖盐酸盐)和170(N-乙酰-D-氨基葡萄糖)的相关核磁信息指认(D2O)
此外,借助系列选择性1D TOCSY 实验对常规氢谱做“分解”后,各组质子信号的精细裂分也得以识别。测得2 个样品共4 种构型异构体的2 位-5 位质子的耦合常数值基本为8 ~11 Hz,表明4 个化合物2 位/3 位,3 位/4 位,4 位/5 位质子均处于直立键(a 键)的位置,为aa 耦合;这也说明2 和4 位质子同在糖环一侧,3 和5 位质子同在糖环另一侧。另外可以根据1,2位质子间耦合常数推断170,383 中两中异构体的构型:当异构体中1,2 位质子间耦合常数较小(3.5 Hz)时属ae 键或ee 键耦合,而2 位质子处于直立键(a键),所以可确定1 位质子处于平伏键(e 键)的位置,该异构体为α-构型;当异构体中1,2 位质子间耦合常数较大(8.5 Hz)时属aa 键耦合,两质子均处于直立键(a 键)的位置,因此该异构体为β-构型。
综合以上核磁数据解析,可确定待测样383 和170 分别是D-氨基葡萄糖盐酸盐和N-乙酰-D-氨基葡萄糖,溶解于重水后分别转化为1/2 位氢分别处于a键/e 键和a 键/a 键2 种形式的化合物,即产生α 和β两种构型化合物(见图3)。2 个样品共4 种构型异构体的核磁结构信息均得以完整指认。
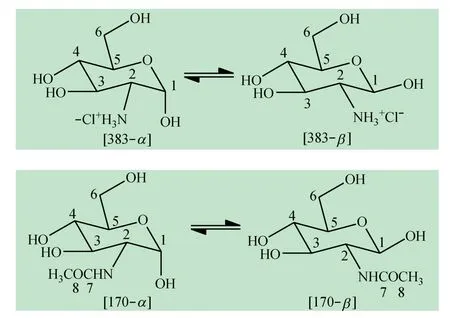
图3 样品383 和170 构型异构体的化学结构
3 结 语
本文利用1D TOCSY 技术,通过优化整形脉冲的混合时间,使得与异头质子在同一糖环自旋体系、相隔共价键数递增的质子,其信号依次“接力”出现。获得的选择性1D TOCSY 系列谱,相当于对复杂重叠的常规氢谱进行了有效分解,并且“分解谱”中大多数信号均能清晰呈现出原本的精细峰型结构,为核磁解析提供了更明确和丰富的帮助信息,使得D-氨基葡萄糖盐酸盐和N-乙酰-D-氨基葡萄糖在水溶液中的两种构型结构得以完全确认,大大简化了对不同构型化合物质子信号分组归属和核磁信息全指认的流程。该思路对于核磁共振在快速解析碳水化合物中多糖环、在溶液中会发生变旋的糖类混合物等结构,能够提供一定的参考。
[1] 沈 国,许建中,唐 旭,等. 高效离子色谱法测定氨基葡萄糖类化合物[J]. 中国卫生检验杂志,2010,20(3):495-497.
[2] 冷艳霞,孙 璐,邸 欣,等. 盐酸氨基葡萄糖片的相对生物利用度及其生物等效性评价[J]. 沈阳药科大学学报,2006,23(1):6-9.
[3] 周 岚,李 燕. 氨基葡萄糖对骨关节影响的临床研究进展[J]. 现代预防医学,2014,41 (21):4018-4022.
[4] 刘利萍,卢秋静,宣 亮,等. 姜黄素协同氨基葡萄糖对小鼠急性酒精性肝损伤的保护作用[J]. 中国新药杂志,2014,23 (23):2794-2797.
[5] 吴伟刚,刘威龙,诸葛福艳,等. 氨基葡萄糖对人肝癌HepG2 细胞增殖及凋亡的影响[J]. 现代肿瘤医学,2015,23(5):601-604.
[6] 吕 珑,付伯桥,覃彩芹,等. 1,3,4,6-四-O-乙酰基-β-D-氨基葡萄糖盐酸盐的制备及其还原性研究[J]. 湖北工程学院学报,2014,34(6):15-19.
[7] 宋沙沙,周宏勇,李小娜,等. 氨基葡萄糖衍生物配体在不对称合成中的应用进展[J]. 有机化学,2014,34:706-716。
[8] 郭 静.N-(O,O-二烷基磷酰基)-D-氨基葡萄糖的合成、表征以及相关量化研究[D].郑州:郑州大学,2010.
[9] 宋沙沙,周宏勇,李小娜,等.氨基葡萄糖衍生物配体在不对称合成中的应用进展[J]. 有机化学,2014,34(4):706-716.
[10] 刘 明,李春霞,辛现良. 核磁共振技术在糖类化合物化学结构研究的应用[J]. 中国药学杂志,2009,44(5):327.
[11] 郭振楚,韩亮,胡博,等. 保护的氨基葡萄糖苷结构测定中的核磁共振光谱研究[J]. 光谱学与光谱分析,2004,24(11):1476-1481.
[12] Espinosa J F. Determination of Magnitudes and Relative Signs of1H?19F Coupling Constants through 1D-and 2D-TOCSY Experiments[J].Journal of Organic Chemistry,2013,78(24):12844-12847.
[13] 耿珠峰,欧阳捷,邓志威,等. NMR 在天然产物选择性分离与结构研究中的应用[J]. 波谱学杂志,2009,26(3):422-436.
[14] Davis D G,Bax A. Simplification of1H NMR spectra by selective excitation of experimental subspectra[J]. Journal of the American Chemical Society,1985,107(24):7197-7198.
[15] Plainchont B,Martinez A,Tisse S,et al. An alternative scheme for the multiplexed acquisition of 1D and 2D NMR spectra[J]. Journal of Magnetic Resonance,2010,206(1):68-73.
[16] Dalvit C,Bovermann G. Pulsed field gradient one-dimensional NMR selective ROE and TOCSY experiments[J]. Magnetic Resonance in Chemistry,1995,33(2):156-159.
[17] Pappalardo F,Fragala M,Mineo P G,et al. Production of filmable medium-chain-length polyhydroxyal-kanoates produced from glycerol by Pseudomonas mediterranea[J]. International Journal of Biological Macromolecules,2014,65(1):89-96.
[18] 赵玉梅,汤立合,缪振春,等. 盐酸非索非那定的NMR 归属和立体化学研究[J]. 波谱学杂志,2011,28(2):265-271.
[19] Ghiviriga I. Selective Excitation 1D-NMR Experiments for the Assignment of the Absolute Configuration of Secondary Alcohols[J].Journal of Organic Chemistry,2012,77(8):3978-3985.
[20] Brakta M,Farr R N,Chaguir B,et al. Assignment of anomeric configuration of C-glycopyranosides and C-glycofuranosides. A1H,13C,and nuclear Overhauser enhancement spectrometric study[J].Journal of Organic Chemistry,1993,58(11):2992-2998.
