卵母细胞体外成熟过程中CTSB、CTSS和caspase 3活性与表达量的变化
2015-12-23刘梦鹤李捷鑫田树军苏文龙孟娜娜王寒阳李俊杰孙树春
刘梦鹤,李捷鑫,田树军,2*,苏文龙,孟娜娜,王寒阳,李俊杰,2,孙树春,2
(1.河北农业大学动物科技学院,河北保定071000;2.河北省牛羊胚胎工程技术研究中心,河北保定071000)
卵母细胞体外成熟过程中CTSB、CTSS和caspase 3活性与表达量的变化
刘梦鹤1,李捷鑫1,田树军1,2*,苏文龙1,孟娜娜1,王寒阳1,李俊杰1,2,孙树春1,2
(1.河北农业大学动物科技学院,河北保定071000;2.河北省牛羊胚胎工程技术研究中心,河北保定071000)
CTSB、CTSS和caspase 3对细胞凋亡具有重要作用,其活性和蛋白表达量可反映细胞内、外环境对卵母细胞的凋亡刺激。本研究利用双夹心ELISA方法测定绵羊卵母细胞内CTSB、CTSS和caspase 3在IVM 0、8、16、24 h的活性与蛋白表达量,研究其在IVM过程中的变化、与卵母细胞质量的相关性及E-64对其产生的影响。结果表明:质量差组卵母细胞内CTSB、CTSS和caspase 3活性与CTSB蛋白表达量均极显著高于正常质量组(P<0.01);CTSB、CTSS活性和蛋白表达量在IVM过程中无显著变化(P>0.05),caspase 3活性呈现先降低后升高的趋势,蛋白表达量无显著变化(P>0.05);5 μmol/L和10 μmol/L E-64显著或极显著降低了CTSB、CTSS和caspase 3活性(P<0.05 or P<0.01),10 μmol/L E-64显著提高了CTSB蛋白表达量(P<0.05)。结果显示,CTSB、CTSS和caspase 3的活性及CTSB蛋白表达量与卵母细胞质量呈负相关,E-64可降低CTSB、CTSS和caspase 3活性,并提高CTSB蛋白表达量。
绵羊;卵母细胞;组织蛋白酶;caspase 3;ELISA
组织蛋白酶B、S(CTSB、CTSS)属于溶酶体内半胱氨酸蛋白酶家族中的成员,通过激活含半胱氨酸的天冬氨酸蛋白酶(caspase)3开启凋亡通路[1]。CTSB普遍存在于哺乳动物细胞中[2],主要分解细胞内蛋白[3];CTSS仅存在于与其功能有关的主要组织相容性复合体中[4],对细胞外高分子物质如层茹连蛋白、胶原蛋白和弹性蛋白进行分解[5],在细胞凋亡和胚胎附植上发挥重要作用[6-7]。E-64(L-反-环氧琥珀酸-L-亮酸胺4-胍丁烷)作为一种组织蛋白酶抑制剂,可有效抑制组织蛋白酶B活性[8]。
有研究表明,在牛卵丘中和卵母细胞内,CTSB、CTSS mRNA表达量均与卵母细胞发育能力呈负相关[9-10]。Balboula等[11-12]发现,牛卵母细胞和胚胎中CTSB活性和表达量均与卵母细胞和胚胎的质量呈负相关,当卵母细胞受到凋亡刺激后,caspase 3的活性和表达量会显著升高[13]。刘志涛等[14]报道,绵羊卵母细胞体外成熟液中添加E-64可降低CTSB和CTSS mRNA表达量,提高卵母细胞后续发育能力;Balboula等[11-12]报道,E-64可降低牛卵丘细胞和胚胎细胞的凋亡率。本研究通过酶联免疫吸附试验(ELISA)测定绵羊卵母细胞内CTSB、CTSS和caspase 3的活性和蛋白表达量,探究这三种酶的活性和蛋白表达量与卵母细胞质量间的关系、体外成熟(IVM)过程中的变化及E-64对其产生的影响,为提高卵母细胞体外发育能力提供新思路。
1 材料与方法
1.1 试验材料试验所用绵羊卵巢采集于河北唐县屠宰场,离体卵巢获得后立即被放入30℃、青霉素和链霉素浓度均为100 IU/mL的生理盐水中,并在2~3 h内运回实验室。
1.2 试验试剂以下试剂若无特殊说明,均购自
Sigma aldrich公司。
卵母细胞成熟液:TCM199+100 mol/L半胱氨酸+10 g/mL促卵泡素(Bioniche,Canada)+10 g/mL促黄体素(Bioniche,Canada)+1 g/mL雌二醇+10%胎牛血清(Gibco)。
采卵液:TCM199(Gibco)+5 mmol/L NaHCO3+ 10 mmol/L Hepes+10 mmol/L Hepes-Na+0.01 g/L肝素钠+10 mL/L胎牛血清(Gibco)+0.025 g/L青霉素+ 0.025 g/L链霉素。
1.3 卵丘卵母细胞复合体(COCs)的收集将绵羊卵巢移入烧杯,用38.5℃生理盐水冲洗3~5次,置于水浴锅内。将卵巢置于放有采卵液的培养皿中,选取卵巢上直径为2~6 mm的卵泡用刀片进行切割。利用口吸管在显微镜下收集COCs。挑选形态正常、卵丘细胞不少于3层的COCs作为正常质量组;胞质不均匀、无或仅有少量卵丘细胞包匣的卵母细胞作为质量差组。
1.4 卵母细胞体外成熟将COCs分别移入E-64浓度分别为0、5、10 μmol/L的熟液滴中,微滴体积为100 μL置于38.5℃、饱和湿度和5%CO2的条件下进行体外成熟。
1.5 样品收集在IVM 0、8、16、24 h收集正常质量组中的卵母细胞,IVM 24 h收集质量差组中的卵母细胞。将COCs置于PVA含量为1 g/L的DPBS(Gibco)中并移入1.5 mL离心管,用移液枪反复吹打,直至卵丘细胞从卵母细胞上完全脱离,用DPBS洗3遍,最终移入200 μL离心管中,每个离心管中含50个卵母细胞。每组样品均进行3次重复采样。
1.6 样品裂解用移液枪测量保存样品的200 μL离心管中液体体积,加入DPBS,使离心管中液体总体积均为70 μL,并用超声波匀浆仪对样品进行裂解。
1.7 ELISA利用测定CTSB、CTSS和caspase 3活性或蛋白表达量的6种双夹心ELISA试剂盒(慧颖应用生物科技公司),分别对裂解液中的6个指标进行测定,按照说明书进行操作在酶标包被板上设10个标准品孔,按照说明书将标准品稀释成5个浓度梯度,每个浓度梯度的标准品占2个孔,每个加样孔加样量为50 μL;每个待测样品孔加入10 μL裂解液,40 μL样品稀释液,37℃温育30 min后,弃去液体,在每个加样孔加满洗涤液,30 s后弃去洗涤液,并重复5次;向加样孔加入50 μL酶标试剂,利用上述方法温育和洗涤后,每个加样孔依次加入显色剂A和显色剂B各50 μL,37℃避光显色15 min;向每个加样孔加入50 μL终止液,15 min后在酶标仪中以450 nm波长依序测量各孔的吸光度(OD值);最后利用标准品的OD值绘制标准曲线,利用样品OD值计算样品中CTSB、CTSS和caspase 3的活性和蛋白表达量。
1.8 统计分析试验结果利用SPSS 17.0进行One-Wway ANOVA分析及Ducan′s检验,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著,结果均以平均值±标准误表示。
2 结果
2.1 不同质量卵母细胞内CTSB、CTSS和caspase 3活性和蛋白表达量的比较由表1可以看出,体外成熟24 h后,质量差的卵母细胞内CTSB、CTSS和caspase 3活性均极显著高于质量正常的卵母细胞(P<0.01),而在3种酶蛋白表达量上的对比表明,2种卵母细胞仅在CTSB蛋白表达量上存在极显著差异(P<0.01)。
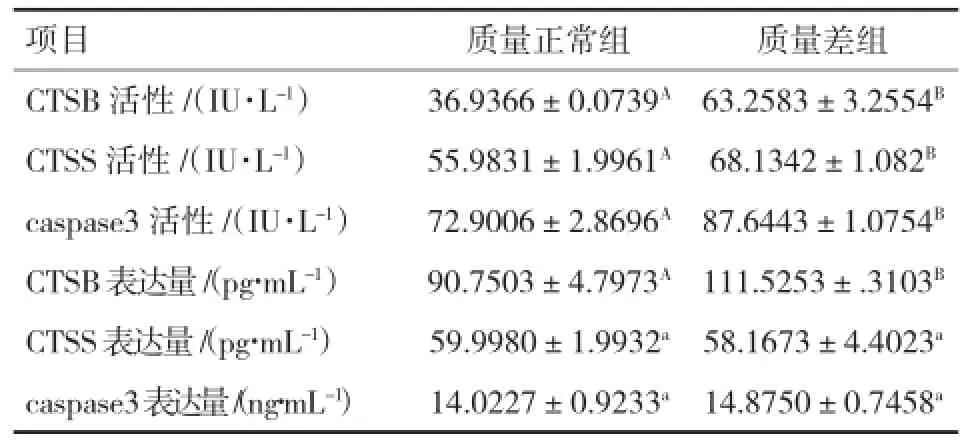
表1 不同质量卵母细胞内CTSB、CTSS和caspase 3酶活性及蛋白表达量对比
2.2 E-64对卵母细胞内CTSB、CTSS和caspase 3活性变化的影响不同浓度E-64对卵母细胞内CTSB活性变化的影响如表2所示。对照组卵母细胞于IVM 0、8、16、24 h CTSB活性保持稳定(P>0.05);5 μmol/L E-64组,CTSB活性仅在IVM 8 h时显著低于IVM 0 h组和对照组中卵母细胞内CTSB活性(P<0.05);10 μmol/L E-64组在体外成熟过程中一直显著或极显著低于0 h组和对照组(P<0.05或P<0.01)。5 μmol/L E-64组和10 μmol/L E-64组之间无显著差异(P>0.05)。
由表3可知,对照组卵母细胞内CTSS活性无显著变化(P>0.05)。E-64试验组中CTSS活性呈下降趋势,其中5 μmol/L E-64组中CTSS活性仅在体在IVM 24 h时显著低于对照组(P<0.05);10 μmol/L E-64组中CTSS活性在IVM 8 h和24 h显著或极显著低于对照组(P<0.05或P<0.01),而在IVM 16 h与对照组无显著差异(P>0.05);10 μmol/L E-64组在IVM 24 h时显著低于5 μmol/L E-64组(P<0.05)。
由表4可知,在IVM过程中,卵母细胞内caspase 3活性呈先降低后升高的趋势,IVM 8 h除对照组卵母细胞内caspase 3活性与IVM 0 h组无显著差异(P>0.05)外,各E-64试验组中caspase 3活性均显著或极显著低于(P<0.05、P<0.01)IVM 0 h组,并且IVM 24 h时各组卵母细胞内caspase 3活性均显著或极显著(P<0.05、P<0.01)高于IVM 8 h。10 μmol/L E-64组中caspase 3活性均显著低于对照组(P<0.05),5 μmol/L E-64组与对照组和10 μmol/L E-64组无显著差异(P>0.05)。
2.3 E-64对卵母细胞内CTSB、CTSS和caspase 3蛋白表达量的影响E-64对卵母细胞内CTSB、CTSS和caspase 3蛋白表达量的影响如表5、6、7所示,IVM过程中卵母细胞内CTSB、CTSS和caspase 3蛋白表达量无显著变化(P>0.05);5 μmol/L和10 μmol/L E-64对卵母细胞内CTSS和caspase 3蛋白表达量无显著影响(P>0.05);10 μmol/L E-64组中CTSB蛋白表达量在IVM 24 h时显著高于IVM 0 h和8 h(P<0.05),且显著高于(P<0.05)IVM 24 h对照组内CTSB蛋白表达量。

表2 不同浓度E-64对卵母细胞内CTSB活性的影响IU·L-1

表3 不同浓度E-64对卵母细胞内CTSS活性的影响IU·L-1
3 讨论
3.1 不同质量卵母细胞内CTSB、CTSS和caspase 3活性及蛋白表达量的差异CTSB和CTSS在凋亡信号传导上具有重要作用,caspase 3的活化发生在凋亡早期。组织蛋白酶介导凋亡的过程中,组织蛋白酶会从溶酶体中释放出来,促使线粒体中细胞色素C进行释放,激活caspase 9,最后激活caspase 3,继而开启凋亡通路[15]。Balboula[11,13]在牛卵母细胞上的研究表明,质量差的卵母细胞内CTSB活性和蛋白表达量高于质量正常的卵母细胞,并且在体外成熟过程中,利用热应激对卵母细胞给予凋亡刺激后,CTSB和caspase 3的活性和蛋白表达量均会显著升高。质量差的卵母细胞周匣缺少卵丘细胞,因此更容易受到活性氧等因素引起的凋亡刺激[16]。本试验结果表明,在IVM 24 h时,质量差卵母细胞内CTSB、CTSS和caspase 3活性均极显著高于质量正常的卵母细胞,与Balboula[11,13]的研究结果一致,由此可推断,在体外成熟过程中,质量差组中的卵母细胞受到了较正常质量组更高水平的凋亡刺激。然而蛋白表达量的测定结果表明,只有CTSB蛋白表达量与卵母细胞质量呈负相关性,与Balboula等[13]结果不一致,因此质量差组中的卵母细胞在体外成熟过程中所受到的凋亡刺激,在种类或程度上不同于热应激产生的凋亡刺激,同时,相较于CTSS和caspase 3,CTSB在凋亡过程中起到了更为重要的作用。

表4 不同浓度E-64对卵母细胞内caspase 3活性的影响IU·L-1

表5 不同浓度E-64对卵母细胞内CTSB蛋白表达量的影响pg·mL-1

表6 不同浓度E-64对卵母细胞内CTSS蛋白表达量的影响pg·mL-1

表7 不同浓度E-64对卵母细胞内caspase 3蛋白表达量的影响ng·mL-1
3.2 E-64对卵母细胞内CTSB、CTSS和caspase 3活性变化和蛋白表达量的影响E-64作为特异性组织蛋白酶抑制剂,仅对CTSB、CTSH(组织蛋白酶H)和CTSL(组织蛋白酶L)活性产生抑制作用[13]。卵母细胞在IVM 0、8、16 h和24 h分别处于GV期(生发泡期)、GVBD期(生发泡破裂期)、MⅠ期(第1次减数分裂中期)和MⅡ期(第2次减数分裂中期),因此这4个时间点能较为准确地反映CTSB、CTSS和caspase 3在体外成熟过程中的变化。然而结果表明,E-64组中CTSB、CTSS和caspase 3的活性均有所降低,因此CTSB、CTSS和caspase 3的活性之间可能存在联系。当细胞受到凋亡刺激后,CTSB和CTSS从溶酶体中释放出来,最终活化caspase 3,开启凋亡通路[15]。因此当CTSB活性受到抑制后,caspase 3活性也会随之降低。CTSS活性的降低表明E-64组中卵母细胞受到较对照组中卵母细胞更低的凋亡刺激,由于CTSB对细胞内蛋白分解上具有重要作用[2],并且E-64组中CTSB和caspase 3活性均呈现先降低后升高的趋势,因此推断,在离体卵巢运输和卵母细胞收集过程中,外界对卵母细胞产生的凋亡刺激促使CTSB从溶酶体中释放出来,除传导凋亡信号外,CTSB还对细胞内蛋白进行分解,而其中部分蛋白分解过程是不必要的,由此对卵母细胞产生了来自于细胞内的凋亡刺激,因此当CTSB活性受到抑制后,来自于细胞内的凋亡刺激减弱,CTSS的活性也随之降低。
Bettegowda等[9]研究表明,10 μmol/L E-64组中卵丘细胞凋亡率显著低于1 μmol/L E-64组,但两试验组在囊胚率上没有差异。刘志涛等[14]发现,5、10 μmol/L E-64可显著降低卵丘细胞内CTSB和CTSS基因表达量,并提高囊胚发育率,但是两试验组之间无显著差异。本研究结果显示,10 μmol/L E-64组中卵母细胞内CTSB活性与5 μmol/L E-64组无差异,蛋白表达量显著高于对照组,表明过度抑制CTSB活性会刺激CTSB的表达。因此推断,体外成熟过程中卵母细胞内CTSB活性须保持在一定水平以上,使其在除传导凋亡信号的其他生理活动中发挥作用或在体外成熟后作为母源物质积累,因此10 μmol/L或更高浓度的E-64不但不会继续提高卵母细胞的发育能力,还可能会影响其正常生理活动产生。
4 结论
绵羊卵母细胞在体外成熟过程中,CTSB、CTSS和caspase 3蛋白表达量保持稳定,CTSB和CTSS活性没有显著变化,caspase 3活性呈先降低后升高的趋势。CTSB、CTSS和caspase 3活性及CTSB蛋白表达量与体外成熟后卵母细胞质量呈负相关。成熟液中添加E-64可以降低卵母细胞内CTSB、CTSS和caspase 3的活性,10 μmol/L E-64可以提高卵母细胞内CTSB的蛋白表达量。
[1]Vancompernolle K,Van Herreweghe F,Pynaert G,et al. Atractyloside-induced release of cathepsin B,a protease with caspase-processing activity[J].FEBS Lett,1998,438(3):150-158.
[2]Barrett A J,Rawlings N D,Woessner J F.Handbook of Proteolytic Enzymes 2[M].Amsterdam:Elsevier Academic Press, 2004.
[3]Szpaderska A M,Frankfater A.An intracellular form of cathepsin B contributes to invasiveness in cancer[J].Cancer Res,2001,61(8):3493-500.
[4]Honey K,Rudensky A Y.Lysosomal cysteine proteases regulate antigen presentation[J].Nat Rev,2003,3(6):472-482.
[5]Wang B,Sun J,Kitamoto S,et al.Cathepsin S controls angiogenesis and tumor growth via matrix-derived angiogenicfactor[J].Biol Chem,2006,281(9):6020-6029.
[6]Turk B,Stoka V,Rozman-Pungercar J,et al.Apoptotic pathways: involvement of lysosomal proteases[J].Biol Chem,2002,383: 1035-1044.
[7]Baston Buest D M,Schan A,Bust S,et al,The embryo's cystatin C and F expression functions as a protective mechanism against the maternal proteinase cathepsin S in mice[J]. Reproduction,2010,139(4):741-748.
[8]Barrett A J,Kembhavi A A,Brown M A,et al.L-transepoxysuccinyl-leucylamido(4-guanidino)butane(E-64)and its analogues as inhibitors of cysteine proteinases including cathepsins B,H and L[J].Biochem J,1982,201(1):89-98.
[9]Bettegowda A,Patel O V,Lee K B,et al.Identification of novel bovine cumulus cell molecular markers predictive of oocyte competence:Functional and diagnostic implications[J].Biol Reprod,2008,79(2):301-309.
[10]Patel O V,Bettegowda A,Ireland J J,et al.Functional genomics studies of oocyte competence:Evidence that reduced transcript abundance for follistatin is associated with poor developmental competence of bovine oocytes[J].Reproduction,2007,133:95-106.
[11]Balboula A Z,Yamanaka K,Sakattani M,et al.Cathepsin B activity is related to the quality of bovine cumulus oocyte complexes and its inhibition can improve their developmental competence[J].Mol Reprod Devel,2010,77:439-448.
[12]Balboula A Z,Yamanaka K,Sakattani M,et al.Intracellular cathepsin B activity is inversely correlated with the quality and developmental competence of boving preimplantation embryos[J]. Mol Reprod Devel,2010,77:1031-1039.
[13]Balboula A Z,Yamanaka K,Sakattani M,et al.Cathepsin B activity has a crucial role in the developmental competence of bovine cumulus-oocyte complexes exposed to heat shock during in vitro maturation[J].Reproduction,2013,146(4):407-417.
[14]刘志涛,田树军,孙树春,等.组织蛋白酶对成年绵羊卵母细胞体外发育能力的影响[J].畜牧兽医学报,2011,42(12): 1704-1711.
[15]Kroemer G,Martin S J.Caspase-independent cell death[J].Nat Med,2005,11(7):725-730.
[16]Wongsrikeao P,Kaneshige Y,Ooki R,et al.Effect of the removal of cumulus cells on the nuclear maturation,fertilization, and development of porcine oocytes[J].Reprod Domest Anim, 2005,40:166-170.
Changes of Activity and Protein Expression of CTSB,CTSS and caspase 3 in Oocytes During in vitro Maturation
LIU Meng-he1,LI Jie-xin1,TIAN Shu-jun1,2*,SU Wen-long1,MENG Na-na1,WANG Han-yang1, LI Jun-jie1,2,SUN Shu-chun1,2
(1.College of Animal Science and Technology,Agricultural University of Hebei,Hebei Baoding 071000,China;2.Embryo Engineering and Technological Center of Cattle and Sheep,Hebei Baoding 071000,China)
CTSB,CTSS and caspase 3 pla y important role in apoptosis,and activities and protein expressions of them can reflect death signals induced by intracellular and extracellular environment.This study was aimed to discover changes of activities and protein expression of CTSB,CTSS and caspase 3 and the relation to the quality of oocytes through detecting activities and protein expressions of CTSB,CTSS and caspase 3 in sheep oocytes at IVM 0,8,16 h and 24 h.Double antibody sandwich ELISA method was undertaken to detect activities and protein expressions,the correlation with the quality of oocytes and the effect of E-64 on them.The results showed that activities of CTSB, CTSS and caspase 3 and the protein expressions in oocytes quality poor were very significantly high compared with the normal ones.There was no significant fluctuation(P>0.05)of CTSB and CTSS activities during IVM time,at the same time,there were no significant changes(P>0.05)in protein expressions either,but the activity of caspase 3 showed a significant fluctuation(P<0.05).Addition of 5 μmol/L and 10 μmol/L E-64 significantly and very significantly(P<0.05,P<0.01)decreased the activities of CTSB,CTSS and caspase 3,and 10 μmol/L E-64 increased the protein expressions of CTSB.According to the results,the activities of CTSB,CTSS and caspase 3 and the protein expression of CTSB were negatively correlated with the quality of oocytes,and the addition of E-64 can to decrease the activities of CTSB,CTSS and caspase 3 and increase the protein expressions of CTSB.
sheep;oocytes;cathepsins;caspase 3;ELISA
S826.3
A
0258-7033(2015)09-0021-05
2014-10-04;
2014-11-17
河北省自然科学基金(C2012204084);国家科技支撑计划(2011BAD19B02-6)
刘梦鹤(1989-),男,河北唐山人,硕士研究生,从事动物胚胎工程技术研究,E-mail:liumengheyouxiang@163.com
*通讯作者:田树军,男,教授,博导,E-mail:tsj7890@126.com
