急性热应激鹅心和肝和肺及肾脏组织中HSP70 mRNA及蛋白的表达
2015-12-23孙泽威仲庆振娄玉杰
孙泽威,仲庆振,娄玉杰
(吉林农业大学动物科技学院,吉林长春130118)
急性热应激鹅心和肝和肺及肾脏组织中HSP70 mRNA及蛋白的表达
孙泽威,仲庆振,娄玉杰*
(吉林农业大学动物科技学院,吉林长春130118)
选取1日龄健康雁鹅60只,随机分为6组,单笼饲养于环控仓内。6周龄时,A组置于(22±1)℃作为对照,B、C、D、E、F组分别施于2、4、6、8 h和10 h (40±1)℃的急性热应激处理,处理后立即剖杀,取心、肝、肺和肾脏组织,实时荧光定量PCR测定HSP70mRNA表达量,免疫组织化学方法测定HSP70表达量。结果表明:急性热应激处理可显著提高各组织中HSP70 mRNA及HSP70蛋白的表达水平,但不同组织出现显著变化的时间以及随热应激时间延长的变化规律存在差异。心脏组织HSP70mRNA和蛋白表达量均在热应激2 h后出现显著升高(P<0.05),热应激4 h后达到最高值,8 h后降至对照组水平,遵循二次曲线回归模式;肝脏热应激4~10 h间HSP70及其mRNA均显著高于对照组(P<0.05),但未表现出显著的线性与二次回归趋势;肺脏HSP70mRNA表达水平在热应激2~10 h间显著高于对照组(P<0.05),HSP70则从热应激4 h起才显著升高,但二者随热应激时间延长均呈显著的线性升高规律;与肺相似,肾脏HSP70及其mRNA表达量随热应激时间的变化趋势也遵循线性回归模式,两者均在热应激4~10 h显著升高(P<0.05)。
热应激;热休克蛋白70;鹅
应激是机体在基因水平上发动的全面抗胁迫过程,应激条件下机体能迅速激活一些基因,表达出一系列分子量不同的热休克蛋白(HSPs)参与机体的应激反应[1-2]。HSP70是热应激蛋白中最重要的家族,具有普遍性、高度保守性及应激性,并通过分子伴侣作用、抗氧化作用、协同免疫作用和抗细胞凋亡作用抵抗应激危害[3]。在家禽热应激方面,严建燕[4]、孙培明[5]、雷蕾[6]等分别针对不同热应激温度和时间条件下,鸡主要器宫组织中HSP60、HSP70、HSP90及其mRNA的表达进行了比较系统的研究,进一步证实了热休克蛋白的应激保护作用。但对于水禽热应激的研究,国内外均刚刚起步,仅吴晓平等[7]和仲庆振[8]就鹅的热应激方面开展了一些工作。仲庆振[8]研究发现,急性热应激可在一定程度上损伤鹅心、肝、脾、肺、肾等器宫组织,且不同器宫组织的损伤程度存在显著差异。但伴随着鹅热应激损伤的发生,热休克蛋白表达的响应情况尚有待于进一步揭示。
随着饲养方式由放养型向集约化、高密度饲养的转变,原本很少出现热应激的水禽也受到了热应激的威胁,而且水禽与陆生家禽存在着明显的生态适应性差异,揭示水禽器宫组织中热休克蛋白随热应激强度变化的表达规律,对于深入探讨家禽的热应激耐受机制具有重要意义。本研究以鹅为研究对象,对急性热应激条件下鹅主要组织中HSP70 mRNA及蛋白的表达,尤其是其随热应激强度的变化规律进行研究,以期为深入探讨HSP70在家禽抵抗应激性损伤中的生理功能和作用机制提供理论依据。
1 材料与方法
1.1 试验动物与试验设计选取1日龄健康雁鹅60只,随机分成6组,每组10个重复,每个重复1只,单笼饲养在环控仓内,自由采食及饮水。随着日龄的增长,逐渐将环境温度下调至(22±1)℃。待饲养至8周龄时,A组环境温度仍设置(22±1)℃,B、C、D、E、F组鹅分别施于2、4、6、8 h和10 h(40±1)℃(相对湿度65%)的高温处理,各组处理均在16∶00结束。
1.2 样品采集试验处理结束后,试验鹅全部屠宰,取心、肝、肺和肾脏组织样本,一部分固定于4%多聚甲醛溶液中以备免疫组织化学检测;另一部分迅速投入液氮速冻后置-80℃保存待测。
1.3 测定指标及方法
1.3.1 鹅体组织中HSP70mRNA定量检测总RNA的提取及反转录:利用Trizol试剂盒提取总RNA,凝胶电泳以及核酸蛋白仪鉴定其纯度和完整性,OD260/OD280为1.8~2.0,使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(宝生物工程有限公司)进行反转录合成cDNA,-20℃保存。
引物设计:根据GenBank发表的鹅HSP70基因序列(序列号:EU680475)和GAPDH基因序列(序列号:DQ821717),利用Primer Premier 5.0软件设计两对引物,HSP70 F:5′-GGAGACAAGTCCGAGAAT-3′, HSP70R:5′-GGAGGGATGCCTGTTAGA-3′;GAPDHF:5′-GGTGGTGCTAAGCGTGTCAT-3′,GAPDH-R:5′-CCCTCCACAATGCCAAAGTT-3′。所有引物均由上海生工生物技术公司合成。
实时荧光定量PCR检测:荧光实时定量PCR在美国产ABI7000荧光定量分析仪上进行。PCR反应体系为20 μL,反应液配比为cDNA模板1.0 μL,上、下游引物各0.4 μL,Premix Ex Taq10 μL,灭菌蒸馏水7.8 μL,ROX Reference Dye(50×)0.4 μL。反应条件:95℃预变性30 s,95℃5 s,60℃30 s,共40个循环。所有样品检测均设1个平行样和1个无模板的阱性对照以排除假阳性结果。获得HSP70标准方程为Y=-3.5846Log(X)+27.2794,相关系数为R2=0.9693;内参GAPDH标准方程为Y=-3.5086Log(X)+23.8604,相关系数为R2=0.9679。△Ct(CtHSP70-CtGAPDH)与模板倍比稀释浓度的线性方程为Y=0.018X+3.406,斜率接近0,说明HSP70 mRNA和内参GAPDH具有相似的扩增效率,可以应用2-△△Ct法对测定结果进行计算分析。
1.3.2 鹅体组织中HSP70含量检测组织切片的制备:按常规组织学方法,将多聚甲醛固定的心脏组织样修样,经过水洗、脱水和透明处理后进行石蜡包埋,制成腊块,5 μm切片,H.E染色,光镜下观察并拍照。
免疫组织化学染色:组织切片经二甲苯脱蜡、梯度酒精水化后置于pH6.0的柠檬酸盐缓冲液中修复5 min;经内源性过氧化物酶阻断剂孵育10 min;5%山羊血清封闭10 min;一抗(HSP 70单克隆抗体) 37℃孵育1 h;生物素标记的二抗孵育10 min;链霉菌抗生物素-过氧化物酶溶液孵育10 min;DAB显色3 min;苏木精复染8 min;脱水、透明、中性树胶封固,光镜下观察并拍照。HSP70阳性染色呈棕黄色。
图像采集与分析:用Olympus摄影显微镜进行图像采集,用Image-pro Plus5.02进行图像分析。每个观测样本选取5个视野进行照相,计算其平均数,为该张切片的测试值。以积累光密度值(IOD)表示HSP70的相对含量。

其中,αi每块免疫组化染色阳性区域的面积;βi该阳性区域的光密度;n 阳性区域的数目。
1.4 统计分析采用SPSS 17.0统计软件的One-Way程序,针对不同器宫HSP70及其mRNA随热应激处理时间延续的表达规律,遵循Yij=Ai+eij模型(i代表热应激处理时间,j代表重复)进行方差分析(LSD)和趋势分析,结果均以平均值±标准差表示。
2 结果与分析
2.1 各组织HSP70mRNA表达量变化如表1所示,心脏中HSP70 mRNA表达水平随热应激时间的延长,遵循二次曲线回归模式(P=0.004),HSP70 mRNA表达水平从热应激2 h开始显著升高(P<0.05),4 h热应激处理后达到最高水平,但随着热应激时间的延长,热应激8、10 h后HSP70 mRNA表达水平并未再持续升高,反而降低至对照组水平;肝脏的HSP70 mRNA水平在热应激4 h后达到峰值(P<0.05),此后的6、8、10 h HSP70 mRNA水平虽绝对值有所下降但仍显著高于对照组(P<0.05),未表现出显著的线性回归趋势(P=0.054);鹅肺脏组织HSP70 mRNA水平从热应激2 h开始,随热应激时间的延长呈现显著的线性升高趋势(P=0.004);肾脏HSP70 mRNA表达水平与肺脏相似,从热应激4 h开始随热应激时间的延长线性升高(P=0.027)。
2.2 各组织HSP70表达量变化如表2所示,热应激处理期间,心肌HSP70含量从热应激2 h后便显著升高,并于热应激4 h后达到峰值,此后在热应激8 h和10 h恢复到热应激前水平,随热应激时间延长的变化规律遵循二次曲线回归模式(P=0.006);肝脏中HSP70的含量随热应激时间的变化趋势与心肌组织相似,也在热应激4 h时显著升高至峰值,但此后各时间点HSP水平虽逐渐下降,但仍显著高于对照组;肺脏组织中HSP70水平随热应激时间延长呈线性升高趋势,峰值出现在6 h;肾脏与肺脏相似,HSP70含量随热应激时间的变化趋势也遵循线性回归模式(P=0.02),热应激4 h后HSP70水平达到峰值,4、6 h和8 h间无显著差异,热应激10 h后显著下降,但仍高于热应激前水平。
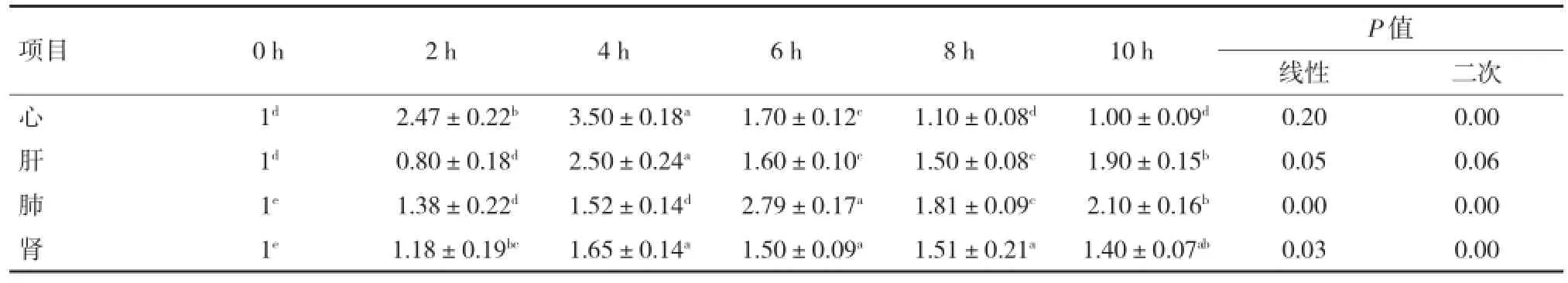
表1 热应激鹅各组织中HSP70mRNA相对表达量

表2 急性热应激对鹅各器官组织中HSP70表达的影响(积累光密度)
3 讨论
3.1 急性热应激对鹅各组织中HSP70mRNA表达量的影响本试验的热应激处理使雁鹅心、肝、肺和肾脏中HSP70 mRNA的表达水平均出现了不同程度的升高,鹅各组织中HSP70 mRNA水平高表达出现和维持的时间存在一定差异。心脏和肺脏组织对热应激的敏感性较高,HSP70 mRNA表达水平在热应激2 h后即出现了显著升高,而肝脏和肾脏HSP70 mRNA表达水平则在热应激4 h后出现高表达。在对热应激条件下肉鸡HSP 60mRNA、HSP70 mRNA、HSP90 mRNA表达情况的研究中也发现了类似的现象,热应激条件下不同组织HSPs mRNA水平的变化具有时间特异性[4-6]。
鹅组织中HSP70 mRNA随热应激时间的延长所表现出的变化规律也存在着一定的组织差异。总体来看,随着热应激时间的延长,组织中HSP70 mRNA水平均呈现波动性变化,出现高峰值后会有一个表达水平下降的过程。HSPs的转录是由HSFs介导的[9],在正常生理状态下HSFs位于胞浆内,处于一种无活性状态[10]。但在热应激条件下,HSF与HSE结合并活化HSPs基因转录的反式调控因子以控制HSPs的表达[11]。随着HSPs合成的增加,新生的HSPs又与HSF结合,反馈抑制HSPs的进一步合成[12]。本试验所检测到的这种HSP 70 mRNA水平的波动性变化完全符合这种负反馈调节机制。
3.2 急性热应激对鹅各组织中HSP70表达的影响HSP70作为机体内的一种重要的非特异性细胞保护蛋白,在应激状况下可以增强机体的应激耐受性,提高细胞生存率。当组织受到热应激损伤时,组织中的HSP70的含量升高以保护组织细胞[13]。本试验所测定各组织中的HSP70水平在热应激的刺激下均显著升高。心脏、肺脏和肝脏是热应激容易损伤的3种组织,热应激处理过程中HSP70的高表达说明HSP70在这3种组织的抗应激中发挥着重要保护作用。目前国内外尚未见有关鹅热应激过程中HSP70变化的相关报道,但与国内外针对肉鸡[14]、鼠[15]动物的研究结果存在较大差异,仍有待于进一步研究证实。
本试验所测定各组织中HSP70水平开始出现显著升高的时间不同。肝脏、肺脏和肾脏中HSP70均是在热应激持续4 h后才出现显著升高,而心脏在热应激2 h后其HSP70水平即已显著高于对照组。这在一定程度上说明,上述不同组织中HSP70水平对热应激的敏感性存在差异。石娇等[16]对急性热应激肉鸡组织中HSP70进行了定位。研究提出,HSP70的表达与其所在组织的血液供应有关,热应激时心肌活动增强,心肌收缩加速,心脏血流量大,细胞中会合成大量HSP70等热应激蛋白以抵抗急性热应激对肌丝中肌球蛋白、肌动蛋白、原肌球蛋白和肌钙蛋白结构产生的破坏,并助其恢复;肝脏中央静脉周匣血液供应丰富,因此肝脏中HSP70的表达也首先出现在肝中央静脉周匣,并且其反应比肝小叶其他部位要强。本试验也发现,心脏中HSP70对热应激的敏感性要高于其他器宫组织。随着热应激时间的延长,HSP70的表达并未表现出线性增长的趋势。热应激2 h后心脏组织中HSP70开始显著升高,4 h后显著高于2 h的水平,此后开始下降,直到热应激8 h和10 h后下降到了对照组水平。由此可见,心肌中HSP70水平随热应激时间的延长呈现波动性变化,这与严建燕[4]对热应激肉鸡HSP60研究结果相似。其他各器宫组织中HSP70随热应激时间延长的变化规律与也与心脏相似。
3.3 HSP70mRNA及蛋白在鹅体主要组织中表达的关系本研究发现,鹅各组织中HSP70水平随热应激时间延长的变化趋势与HSP70mRNA表达的变化趋势几乎完全相同。当组织中HSP70mRNA高表达时,该组织中HSP70含量亦会随之升高,这与雷蕾[6]对热应激肉鸡HSP90及其mRNA的表达规律的研究结果相似。热休克蛋白的表达调控包括转录和翻译两个水平,HSP70翻译水平的调控主要是由HSP70基因及其mRNA的特性所决定的。HSP70基因没有内含子,这样细胞一旦启动转录就能产生成熟的mRNA,致使HSP70大量、快速表达。此外,热应激时,其他正常蛋白的翻译受到抑制,从而减少了与HSP70 mRNA翻译的竞争,也是HSP70大量表达的原因之一[17]。但随着热应激时间的延长也出现了HSP70mRNA表达先降低至对照组水平而HSP70含量仍显著高于对照组的现象。这可能与HSP的负反馈调节有关,即高水平HSP和HSF结合时会抑制HSF活性,从而减少HSF和HSE的特异性结合,控制热休克基因的转录。
4 小结
本试验的急性热应激处理使鹅不同组织中HSP70 mRNA及HSP70水平均出现不同程度的升高。各组织中HSP70 mRNA及HSP70表达量的变化存在时间特异性,且随热应激时间的延长呈现出不同的回归模式,相比较而言HSP70水平的变化更加平稳,且在一些组织中的变化会滞后于HSP70 mRNA表达的变化。
[1]Akbarian A,Golian A,Gilani A,et al.Effect of feeding citrus peel extracts on growth performance,serum components,and intestinal morphology of broilers exposed to high ambient temperature during the finisher phase[J].Livest Sci,2013,157(2-3):490-497.
[2]付旭彬,孙培明,李玉保,等.肉鸡组织脏器的急性热应激损伤及HSP90的表达[J].南京农业大学学报,2004,27(3):85-88.
[3]张旭辉.热休克蛋白70与热耐受的机制[J].解放军预防医学杂志,2001,19(1):73-75.
[4]严建燕.肉鸡组织的热应激损伤和热休克蛋白60的表达变化[D].南京:南京农业大学,2008.
[5]孙培明.肉鸡热应激损伤与热休克蛋白70表达的研究[D].南京:南京农业大学,2006.
[6]雷蕾.肉鸡组织的热应激损伤与Hsp90水平及其mRNA表达的变化[D].南京:南京农业大学,2008.
[7]吴晓平,王宝维,张旭晖,等.鹅热休克蛋白70的表达提纯与病毒复合物形成的研究[J].中国农业科学,2007,40(9): 2084-2090.
[8]仲庆振.不同品种鹅急性热应激反应极其相关机理的研究[D].长春:吉林农业大学,2010.
[9]Morimoto R I,Santoro M G.Stress-inducible responses and heat shock proteins:new pharmacologic targets for cytoprotection[J]. Nat Biotech,1998,16(9):833-838.
[10]Voellmy R.Dominant-positive and dominant-negative heat shock factors[J].Methods,2005,(35):199-207.
[11]Zou J,Guo Y,Guettouche T,et al.Repression of heat shock transcription factor HSF1 activation by HSP90(HSP90 complex)that forms a stress-sensitive complex with HSF1[J].Cell,1998, 94(4):471-480.
[12]Zhu J,Katz R,Quyyumi A A.Association of serum antibodies to Heat-Shock protein 65 with coronary cacification levels.suggestion of Pathogen-Triggered autoimmunity in early atherosclerosis[J]. ACC Current J Rev,2004,13(4):29.
[13]Gabai V L,Meriin A B,Mosser D D,et al.HSP70 prevents activation of stress kinase-A novel pathway of cellular thermotolerance[J].Biol Chem,1997,272(29):18033-18037.
[14]Leandro N S,Gonzales E,Ferro J A,et al.Expression of heat shock protein in broiler embryo tissues after acute cold or heat stress[J].Mol Reprod Dev,2004,67(2):172-177.
[15]Wong C G,Bonakdar M,Mautz W J,et al.Chronic inhalation exposure to ozone and nitric acid elevates stress-inducible heat shock protein 70 in the rat lung[J].Toxicology,1996,107(2): 111-119.
[16]石娇,高明,赵金兰,等.急性热应激条件下肉鸡组织器官中HSP70表达定位[J].动物科学与动物医学,2004,21(11):5-7.
[17]吴炳义,宋亮年,徐仁宝.背部烫伤大鼠脑及肝脏热休克蛋白70(hsp70)mRNA的诱导[J].生理学报,1995,47(4):412-416.
S835.2
A
0258-7033(2015)09-0052-04
2014-07-02;
2015-01-10
国家自然科学基金项目(31372331);吉林省现代家禽产业技术体系(201229)
孙泽威(1974-),男,吉林长春人,博士,副教授,主要从事动物营养学研究,E-mail:sunzewei@jlau.edu.cn
*通讯作者:娄玉杰,E-mail:lyjjlau@163.com
