蛹虫草菌丝体多糖体外抗氧化活性研究*
2015-12-23张命龙焦春伟谢意珍梁慧嘉
张命龙,焦春伟,谢意珍,2**,梁慧嘉,张 松
(1.广东粤微食用菌技术有限公司,广东 广州 510663;2.广东省微生物研究所,广东 广州 510663;3.华南师范大学生命科学学院,广东 广州 510631)
蛹虫草菌丝体多糖体外抗氧化活性研究*
张命龙1,焦春伟1,谢意珍1,2**,梁慧嘉1,张 松3
(1.广东粤微食用菌技术有限公司,广东 广州 510663;2.广东省微生物研究所,广东 广州 510663;3.华南师范大学生命科学学院,广东 广州 510631)
通过摇瓶液体发酵获得蛹虫草菌丝体,采用脱脂、水提醇沉、去蛋白、脱色素、透析和冷冻干燥等一系列手段提取蛹虫草菌丝体多糖。利用羟基自由基(·OH)、超氧阴离子自由基(O2-·) 和1,1—二苯基-2-三硝基苯肼(DPPH)清除实验,评价蛹虫草菌丝体多糖体外抗氧化活性。结果显示,蛹虫草菌丝体多糖对3种自由基均表现出较强的清除效果,其中对DPPH的清除力相对最强。随着浓度上升,其抑制自由基的效果均增强,呈现剂量正相关。该多糖对3种不同自由基抑制作用的IC50值分别为7.01 mg·mL-1、19.90 mg·mL-1和3.51 mg·mL-1。蛹虫草菌丝体多糖表现出良好的体外抗氧化活性。
蛹虫草;菌丝体;多糖;自由基;抗氧化
生物体在氧化代谢过程中不可避免会产生许多活性自由基,其呈游离状态,带有未配对电子,包括羟基自由基(·OH)、超氧阴离子自由基(O2-·)、单线态氧(1O2)及过氧化氢(H2O2)等[1]。当机体抗氧化能力下降时,这些自由基容易攻击蛋白质、核酸和脂质等大分子物质,损伤细胞结构,破坏机体正常的生理功能,甚至诱发各种疾病。
近些年研究发现,食(药)用真菌中有不少种类具有天然的抗氧化能力,具体表现为可清除或抑制体内外的活性自由基。研究显示白灵菇、杏鲍菇和阿魏菇多糖提取物均具有较强的体外抗氧化活性[2]。姬松茸多糖也具有一定的抗氧化能力[3]。灵芝多糖肽在体内外均有抗氧化作用,其作用机制与清除自由基及提高机体谷胱甘肽过氧化物酶活性有关[4]。有研究者从鲍鱼菇子实体中分离出一种新的多糖肽,证实具有较高的体外抗氧化活性[5]。双孢蘑菇的乙醇提取物在体外可清除自由基,体内可显著提高小鼠体内抗氧化酶的活性[6]。有关食(药)用菌活性物质抗氧化的研究至今仍受研究者们关注。
蛹虫草(Cordyceps militaris)又称北冬虫夏草、北虫草,是虫草属(Cordyceps)一种,蛹虫草与闻名于世的冬虫夏草为同属异种,含有多种生理活性物质,如多糖、虫草素、虫草酸、甾醇类等[7]。蛹虫草具有抗肿瘤、抗菌、降血糖、提高免疫力、清除氧自由基和抗疲劳等药理作用[8]。其中,多糖是蛹虫草重要的生理活性物质。Rao等[9]研究表明蛹虫草多糖能明显抑制肿瘤细胞的增殖。Lee等[10]研究发现蛹虫草多糖能促进巨噬细胞分泌NO以及细胞因子(IL-1和TNF-a),从而激活免疫系统,增强抵抗力[10]。但是有关蛹虫草菌丝体多糖抗氧化作用的研究暂未有相关进展。本文通过液体发酵的方法获得了蛹虫草菌丝体并提取多糖,采用羟基自由基(·OH)、超氧阴离子自由基(O2-·)和1,1-二苯基-2-三硝基苯肼(DPPH)清除实验,评价其体外抗氧化活性,以期为蛹虫草多糖活性的研究提供理论依据。
1 材料与方法
1.1材料
1.1.1 供试菌株
蛹虫草(C.militaris)1号菌株,由华南师范大学生命科学学院提供。
1.1.2 培养基
斜面培养基:马铃薯(去皮)200 g、葡萄糖 20 g、蛋白胨 1 g、KH2PO41 g、MgSO41 g、(NH4)2SO41 g、琼脂20 g,水1 000 mL,pH 6.5。
液体培养基:蔗糖50 g、KNO34 g、KH2PO41 g、MgSO41 g、维生素B10.05 g,水1 000 mL,pH 6.5。
1.1.3 主要药品与试剂
浓硫酸、苯酚、氯仿、正丁醇、乙醇、石油醚、葡萄糖、蔗糖及胰蛋白酶等均为国产分析纯试剂。1, 1-二苯基-2-三硝基苯肼 [1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH](购自阿拉丁试剂公司),纯度为96%。透析袋(截留分子量8 kD~15 kD)。
羟基自由基和超氧阴离子自由基测定试剂盒均购自南京建成生物工程研究所。
1.1.4 主要仪器设备
ZHJH-1109超净工作台,上海智城分析仪器制造有限公司;ZHWY-1112C恒温培养振荡器,上海智城分析仪器制造有限公司;RE-52CS旋转蒸发仪,上海亚荣生化仪器厂;FD5-3真空冷冻干燥机,美国西盟国际公司;UV2450紫外-可见光分光仪,日本岛津公司。
1.2蛹虫草菌丝体多糖的制备
1.2.1 摇瓶液体发酵
选用500 mL三角瓶,每瓶装200 mL液体培养基。在无菌条件下,从活化好的蛹虫草斜面菌种上挑取4块~6块的菌块,送入已灭菌并冷却至室温的上述液体培养基中,封口三角瓶,160 r·min-1,24℃振荡培养8 d。
1.2.2 多糖的提取
发酵产物经离心分离菌丝体和发酵液。菌丝体60℃烘干后粉碎过40目筛,收集粉末。以粉末与石油醚比为1∶2(W∶V) 混匀,脱去菌丝体粉中的脂质。脱脂后的菌丝体粉以料液比1∶25(W∶V),提取温度75℃,时间2.5 h,提取2次。合并2次滤液,并浓缩到适当体积。浓缩后的菌丝体浸提液加入4倍体积乙醇沉淀。沉淀物经胰蛋白酶和Sevage法去蛋白[11],双氧水脱色素[12],透析等常规纯化工艺处理后,真空冷冻干燥获得蛹虫草菌丝体多糖(Intracellular Polysaccharides from C.militaris,IPCM)。
1.2.3 多糖含量测定
苯酚-硫酸法[13]。经测定,多糖含量为66.41%。
1.3IPCM对自由基的清除实验
1.3.1 IPCM对羟基自由基(·OH)清除作用
Fenton反应是最常见的产生羟基自由基的化学反应,H2O2的量和Fenton反应产生的·OH量成正比,当给予电子受体后,用Griess试剂显色,其呈色与·OH的产生量成正相关。具体操作依据试剂盒要求进行。清除率(R1,%)公式为:
R1=(A对照—A测定) /A对照×100
1.3.2 IPCM对超氧阴离子自由基(O2-·)清除作用
模拟机体中黄嘌呤与黄嘌呤氧化酶反应系统,产生超氧阴离子自由基O2-·,加入电子传递物质及显色剂,使反应体系呈现紫红色。当存在抗超氧阴离子物质时,可抑制该反应使超氧阴离子自由基O2-·减少,故比色时颜色变浅。依据形成物的颜色深浅,计算出抑制超氧阴离子自由基O2-·能力的强弱。具体操作依据试剂盒要求进行。清除率公式同1.3.1。
1.3.3 IPCM对DPPH的清除作用
参考Xu的方法[14],精密吸取不同浓度的多糖待测液1.0 mL,加入25 mg·L-1DPPH 50%甲醇溶液2.0 mL,摇匀,暗处室温静置20 min,在波长为517 nm处测定吸光度,记As;精密吸取50%甲醇溶液1.0 mL,加入25 mg·L-1DPPH·50%甲醇溶液2.0 mL,摇匀,记A0;精密吸取不同浓度的多糖待测液1.0 mL,加入50%甲醇溶液2.0 mL,摇匀,记Ab;每个浓度重复3次。以50%甲醇溶液校正仪器零点,清除率(R2)公式为:
R2= [1- (As-Ab)/A0]×100
2 结果与分析
2.1IPCM对羟基自由基(·OH)的清除活性
羟基自由基(·OH)是细胞代谢过程中产生的生理自由基,化学性质活泼,容易攻击蛋白质、核酸和脂质等大分子物质,从而损伤细胞的正常功能。IPCM对羟基自由基(·OH)的清除活性见图1。
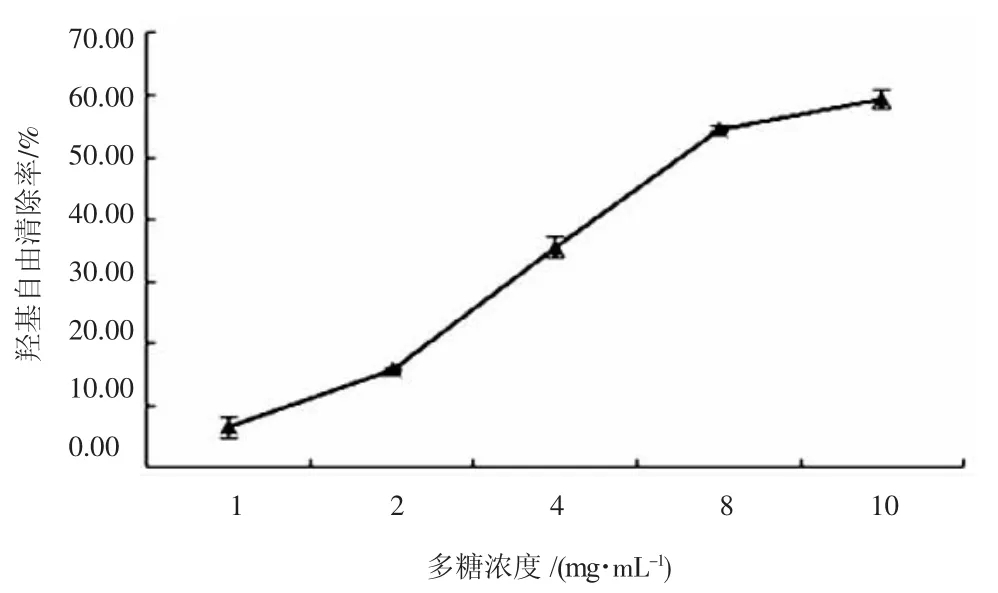
图1 IPCM对羟基自由基(·OH)的清除活性Fig.1 Scavenging activity of IPCM to hydroxyl radical(·OH)
由图1可知,随着IPCM浓度的上升,其对·OH的清除能力愈强。当浓度在2 mg·mL-1~8 mg·mL-1之间,清除能力与浓度几乎成线性关系。但浓度低于2 mg·mL-1或高于8 mg·mL-1时,清除效果增强缓慢。IPCM浓度为10 mg·mL-1时,对·OH的清除率达到59.30%。由此可知,当供试 IPCM浓度适中时,对·OH清除能力较强烈。由计算得,IPCM清除·OH的IC50值为7.01 mg·mL-1。
2.2IPCM对超氧阴离子自由基(O2-·)的清除活性
超氧阴离子自由基(O2-·)是一种生理自由基,氧化能力较强。TPCM对超氧阴离子自由基(O2-·)清除活性见图2。

图2 IPCM对超氧阴离子自由基(O2-·)的清除活性Fig.2 Scavenging activity of IPCM to superoxide radical(O2-·)
由图2可知,在本实验浓度范围内,IPCM对O2-·的清除能力随浓度增大明显增强,表现出线性相关。当IPCM浓度为10 mg·mL-1时,对O2-·的清除率达到43.09%。由计算得,IPCM清除O2-·的IC50值为19.90 mg·mL-1。在高浓度下,IPCM清除O2-·的增强趋势甚至强于对·OH的清除力。
2.3IPCM对DPPH的清除活性
DPPH是一种非生理环境的自由基,目前被广泛用来作为体外评价抗氧化活性。IPCM对DPPH的清除活性见图3。由图3可知,IPCM对DPPH有较强的清除活性。在设定浓度范围内,随着IPCM浓度增大,清除率相应提高,呈现低浓度增长较慢,中间浓度增长较快,高浓度趋于稳定的现象。IPCM浓度为10 mg·mL-1时,对DPPH的清除率达到69.39%。由计算得,IPCM清除DPPH的IC50值为3.51 mg·mL-1。由此可知,相对3种自由基而言,IPCM对DPPH的清除活性最高。
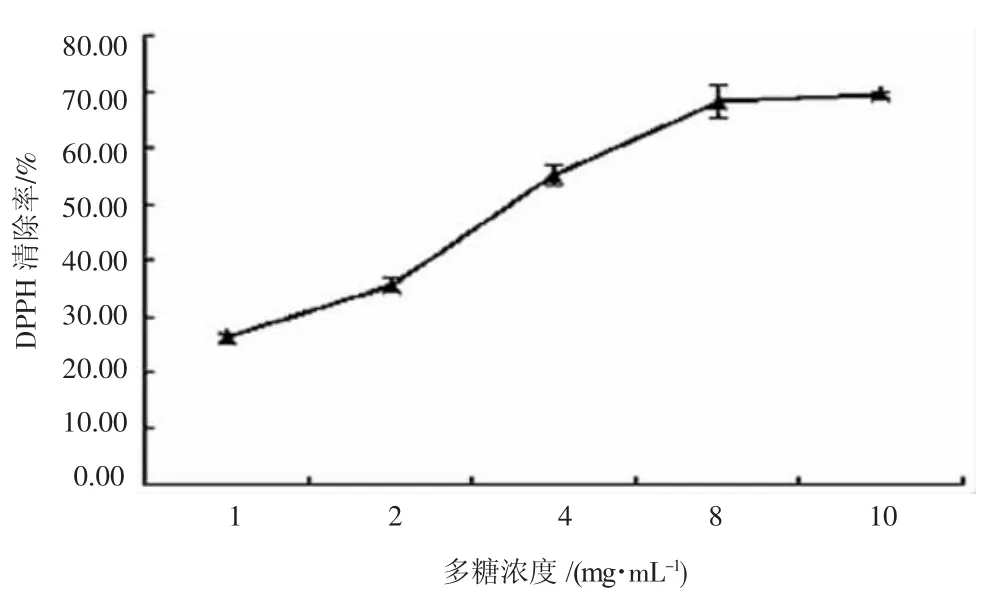
图3 IPCM对DPPH的清除活性Fig.3 Scavenging activity of IPCM to DPPH
3 讨论
蛹虫草菌丝体液体发酵周期短、产量大、质量高,能在较短时间内获得大量的发酵产物菌丝体,从而克服子实体栽培时的不足,如生长周期长、难以人工控制、效率较低等。本实验利用合成培养基进行蛹虫草菌丝体液体发酵,是区别于多数研究者采用半合成或天然培养基的实验方法[15-17]。天然成分固然有利于促使菌丝体大量繁殖和合成更多的多糖,但往往最终提取的多糖活性物质可能受到这些原料中复杂成分的干扰。笔者使用蔗糖作为唯一碳源,可明确后续提取的多糖是由菌丝体自身合成,进行多糖活性物质的提取及开展后续的活性评价实验研究亦符合研究目的。
机体内羟基自由基(·OH)、超氧阴离子自由基(O2-·)等与多种疾病相关,已成为医学界的共识,如机体衰老、免疫失调、动脉粥样硬化、恶性肿瘤等[18]。因此,开发天然抗氧化剂清除机体自由基对于相关疾病的防治意义重大。
蛹虫草子实体是提取多糖的重要来源,研究表明子实体多糖具有较强的体外和体内抗氧化活性[19,20]。菌丝体是子实体生长的前期阶段,同样可产生诸如多糖类的活性物质。本文通过3种自由基清除实验证实了蛹虫草菌丝体多糖具有良好的体外抗氧化活性,这为蛹虫草液体发酵培养菌丝体的开发利用提供了理论基础。然而蛹虫草菌丝体多糖在生物体内是否可以真正起到预期的抗氧化效果,还需进一步深入探究。当前,蛹虫草子实体已被开发成多种功能性食品,在改善人体机能,促进人体健康方面发挥重要作用。通过液体发酵培养获得的蛹虫草菌丝体亦可在增强机体抗氧化作用、延缓衰老领域有一定的应用价值。
[1]陈娜.灵芝菌液态发酵及其多糖抗氧化活性研究[D].广州:华南理工大学,2012.
[2]盛伟,方晓阳,吴萍.白灵菇、杏鲍菇、阿魏菇多糖体外抗氧化活性研究[J].食品工业科技,2008(5):103-105.
[3]吕喜茹,郭亮,常明昌,等.姬松茸粗多糖抗氧化作用[J].食用菌学报,2010,17(1):69-71.
[4]游育红,林志彬.灵芝多糖肽的抗氧化作用 [J].药学学报,2003,38(2):85-88.
[5]Li N,Li L,Fang JC,et al.Isolation and identification of a novel polysaccharide-peptide complex with antioxidant,antiproliferative and hypoglycaemic activities from the abalone mushroom[J].Bioscience reports,2012,32(3):221-228.
[6]Liu J,Jia L,Kan J,et al.In vitro and in vivo antioxidant activity of ethanolic extract of white button mushroom (Agaricus bisporus) [J].Food and Chemical Toxicology,2013(51): 310-316.
[7]曾宏彬,宋斌,李泰辉.蛹虫草研究进展及其产业化前景[J].食用菌学报,2011,18(2):70-74.
[8]桂仲争,滕国琴,贾俊强,等.蛹虫草食药用开发价值[J].中国食物与营养,2012,18(30):70-73.
[9]Rao YK,Fang SH,Wu WS,et al.Constituents isolated from Cordyceps militaris suppress enhanced inflammatory mediator’s production and human cancer cell proliferation[J].Journal of Ethnopharmacology,2010,131(1):363-367.
[10]Lee JS,Hong EK.Immunostimulating activity of the polysaccharides isolated from Cordyceps militaris[J].International Immunopharmacology,2011,11(1):1226-1233.
[11]孙晓雪,孙卫东,史德芳,等.仙人掌多糖提取过程中脱蛋白方法的研究 [J].天然产物研究与开发,2007(19):117-119.
[12]陈健,耿安静,徐晓飞.香菇多糖的过氧化氢脱色工艺研究[J].食品工业科技,2010(3):293-295.
[13]张惟杰.糖复合物生化研究技术(第2版)[M].杭州:浙江大学出版社,1999.
[14]Xu X,Wu Y,Chen H.Comparative antioxidative characteristics of polysaccharide-enriched extracts from natural sclerotia and cultured mycelia in submerged fermentation of Inonotus obliquus[J].Food Chemistry,2011,127 (1):74-79.
[15]李春丽,刘晓兰,陈慧鑫.蛹虫草深层培养产菌丝体及胞外多糖的初步研究 [J].农产品加工,2010,2(1):22-26.
[16]房天琪,邱芳萍,王长周,等.蛹虫草菌丝体液体培养工艺的研究 [J].长春工业大学学报:自然科学版,2011,32(1):83-87.
[17]罗巍,刘东波,吴郑武,等.蛹虫草液态发酵过程中有效成分的动态积累变化 [J].食品与发酵工业,2011,37(10):96-99.
[18]MARX JL.Oxygen free radicals linked to many diseases[J]. Science,1987,235 (4788):529-531.
[19]张杰,孙源.超声提取蛹虫草多糖及其抗氧化活性分析[J].食品科技,2013,38(5):203-207.
[20]陈慧婵,裴斐,杨文建,等.金针菇、香菇和蛹虫草对小鼠体内抗氧化酶活性的影响 [J].食品科学,2014,35(1):219-223.
Antioxidant Activity of Intracellular Polysaccharides from Cordyceps militaris Mycelium in vitro
ZHANG Ming-long1,JIAO Chun-wei1,XIE Yi-zhen1,2,LIANG Hui-jia1,ZHANG Song3
(1.Guangdong Yuewei Edible Fungi Technology Co.Ltd.,Guangzhou 510663,China; 2.Guangdong Institute of Microbiology,Guangdong Academy of Sciences,Guangzhou 510663,China; 3.School of Life Sicence,South China Normal University,Guangzhou 510631,China)
In this study,after submerged fermentation of Cordyceps militaris through shake flask culture,mycelium of C.militaris was obtained.By a series of extraction procedures,such as degreasing,concentration,alcohol precipitation,deproteinization,decolorizatio and dialysis,IPCM(intracellular polysaccharides from C.militaris)were prepared via vacuum freeze-drying. Antioxidant activity of IPCM was evaluated by three experiments including scavenging activity of superoxide and hydroxyl radicals and DPPH.The results showed IPCM had certain activity of scavenging superoxide,hydroxyl radicals and DPPH.Among these radicals,scavenging activity to DPPH was highest relatively.As increasing of IPCM concentration,scavenging activity became stronger,with dose-effect relationship.IC50of scavenging rate for these three radicals were 7.01 mg·mL-1,19.90 mg·mL-1and 3.51 mg·mL-1,respectively.IPCM can excert nice antioxidant activity in vitro.
Cordyceps militaris;mycelium;polysaccharides;radicals;antioxidation
S646.9
A
1003-8310(2015)02-0066-04
10.13629/j.cnki.53-1054.2015.02.017
粤港关键领域重点突破项目(2012A080107001);国家科技成果转化资金项(2013GB2E000360);广州市科技惠民专项(2014Y2-00130)。
张命龙(1986-),男,硕士,工程师,主要从事食药用真菌功能活性成分研究及相关产品开发方面研究。E-mail:zhangminglong69@126.com
**通信作者:谢意珍(1975-),女,硕士,研究员,主要从事食(药)用真菌的研究开发方面工作。E-mail:Jiao19800205@126.com
2014-12-28
