Talin:细胞黏附动力学过程的关键蛋白
2015-12-22李思锐罗孝勇郭向荣
李思锐,孙 阳,罗孝勇,郭向荣
(湖南师范大学生命科学学院分子细胞实验室,中国长沙 410081)
恶性肿瘤是当今严重威胁人类生命的重大疾病之一,转移是恶性肿瘤致死的最主要原因.大多数癌症患者在确诊时,肿瘤细胞已启动转移级联中的一个或多个步骤.恶性肿瘤细胞的转移是指从原发部位浸润性生长、穿透细胞外基质进入脉管(淋巴管或血管)、渗出脉管、在转移部位生长、增殖[1-2].各种细胞,包括肿瘤细胞,其转移机制是大体相同的,有很大的相似性和保守性,均为一个相互依存的多步骤循环过程[3-4]:A.细胞在趋化因子的刺激下,形成前、后极性(polarity);B.在迁移细胞前部,由肌动蛋白聚合而形成片状伪足、线状伪足的突起(protrusion);C.跨膜受体-整合素与胞内骨架蛋白连接,形成大小不等的黏附斑点(focal adhesion),从而连接胞外基质与胞内肌动蛋白.当细胞运动时,这些黏附可作为牵引位点;D.细胞尾部的黏附解体和尾部牵缩(rear retraction),细胞向前移动.阐明细胞转移的分子机制,是正确理解癌症转移、与寻找有效的治疗措施的前提和基础.
1 细胞黏附的动力学过程
细胞黏附,作为细胞转移多步骤循环过程的重要环节,是指细胞与胞外基质的物理相互作用,涉及跨膜糖蛋白受体家族-整合素(integrin),肌动蛋白细胞骨架和一系列胞质蛋白[5-6].整合素在结构上为一杂二聚体,由一个α 亚基与一个β 亚基组合而成,分别具有结合配基的胞外区域,单一跨膜区域和胞内区域,但仅β亚基的胞内区域有与信号分子的结合位点.当其胞外区域与胞外配基,如纤粘蛋白(fibronectin)等结合后,导致整合素聚合成簇及胞内区域的构象变化,尽管其胞内区域本身不具有酶活性,但成簇的整合素可激活黏附斑激酶FAK,使其397 位的酪氨酸磷酸化,与Src 激酶的SH2 区域结合,Src 磷酸化衔接蛋白或细胞骨架蛋白,如talin,paxillin,vinculin 等,从而使酪氨酸激酶、细胞骨架蛋白,通过FAK 的SH2,SH3 或富含脯氨酸区域,在整合素的β 胞内区域相互结合形成细胞黏附,并与肌动蛋白细胞骨架相联,使肌动蛋白微丝重组,形成应激纤维(stress fibers).这些新生的黏附(nascent adhesion),逐渐长大,形成直径1 μm 大小的圆形结构即复合斑(focal complex).复合斑作为质膜扩展的牵引点,传递推动力.当黏附长成稳定结构,变得更大,更成熟时,即形成2 μm 宽,3~10 μm 长的所谓黏附斑(focal adhesion)[7-8].Focal complex 为小的黏附,位于细胞前沿片状伪足、线状伪足的末端,可稳定片状、线状伪足,传递推动力,促进细胞迁移;focal adhesion 为大的黏附,通常位于细胞尾部应激纤维的末端,与胞外基质紧密附着,抑制细胞迁移[9].它们的分子组成相同,在成熟度上有差异.
在迁移细胞尾部,可观察到黏附斑的解体(focal adhesion disassembly),即黏附的释放,使尾部收缩;但在细胞前沿,黏附斑的解体同时伴随着新的黏附斑形成,因而称为黏附斑的转换(focal adhesion turnover).细胞黏附不仅建立了肌动蛋白细胞骨架与胞外基质的紧密联系,同时一系列结构蛋白与调节蛋白组成的蛋白复合物,构成了控制细胞转移的信号通路的网络系统[10].
2 Talin 在细胞黏附形成中的作用
最新研究表明,有超过180 种蛋白参与黏附的形成,这些蛋白或为结构蛋白,如衔接蛋白或骨架蛋白,直接或间接联接整合素β 亚基的胞内区域与胞内肌动蛋白;或为调节蛋白,如激酶和信号蛋白,调控黏附相关蛋白间相互作用和信号转导[11-12].图1[9]描述了参与黏附形成的主要蛋白间的相互作用,可以看出,仅talin,filamin 和α-actinin,既与整合素也与肌动蛋白直接联接.研究表明,与filamin 和α-actinin 相比,talin 蛋白,由于其结构以及与其他蛋白的相互作用,在黏附的形成和解体的动力学过程中,具有至关重要的作用.在敲除了talin 基因的胚胎干细胞中,黏附斑和应激纤维均不能形成[13].
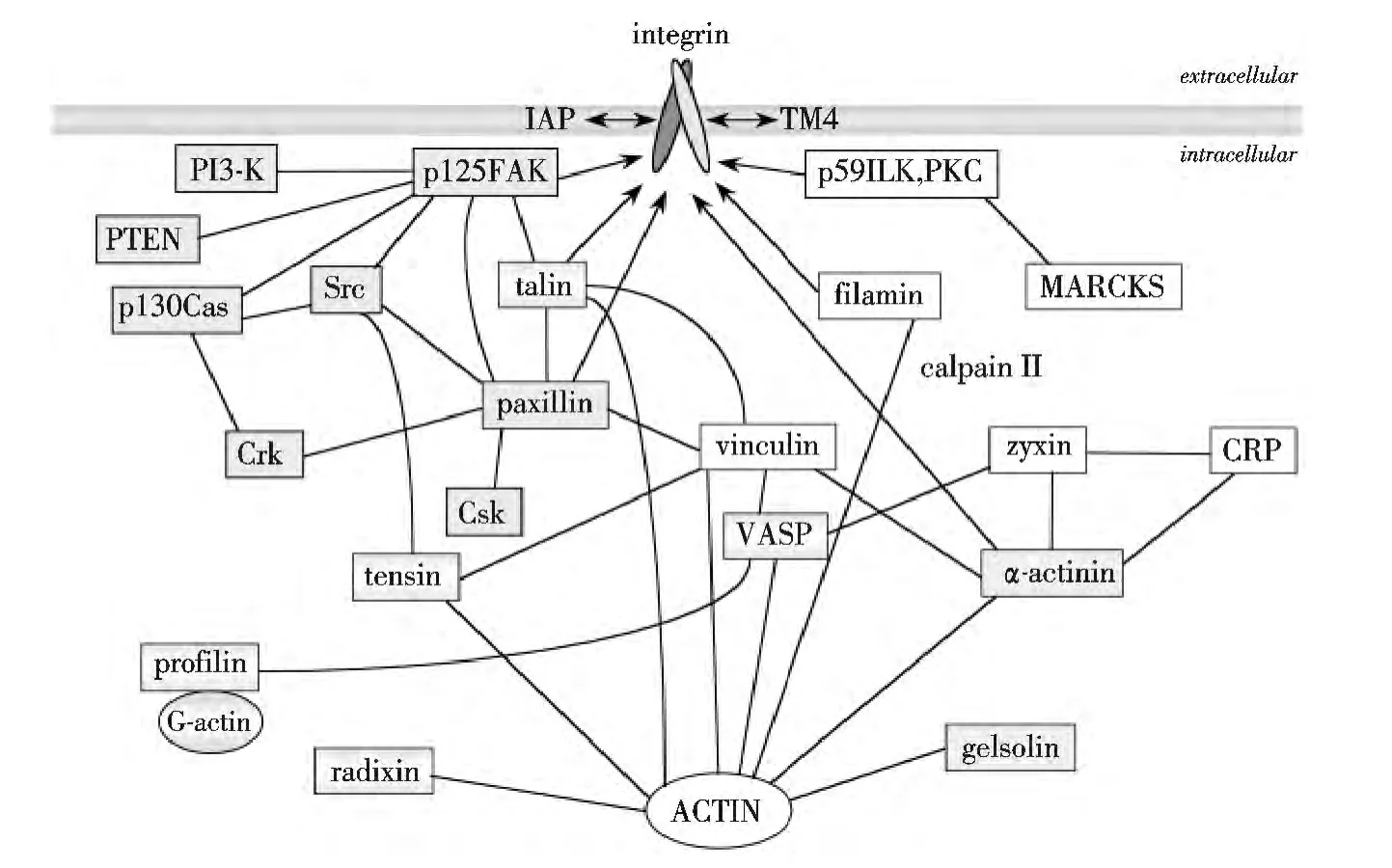
图1 细胞黏附中主要组成蛋白间的相互作用Fig.1 Interactions of main adhesion components in cell adhesion
Talin 基因有两个亚型,talin1、talin2,其编码的蛋白有74%的相似性[14].目前,对talin2 的了解较少.在结构上,talin1 为一包含2 541 个氨基酸,270 000 的蛋白大分子[15].其全长蛋白分为球形N 端头部与C 端尾部.头部通称为FERM 区域,可细分为F1,F2,F3 亚区域,其中含有整合素β 胞内区域、肌动蛋白、黏附斑激酶FAK、跨膜蛋白layilin 的结合位点.其尾部含有一个β 亚基、两个肌动蛋白和3 个骨架蛋白vinculin 结合位点.从talin 蛋白结构,可看出,其上可联接整合素β 亚基,下可联接肌动蛋白,并与其他黏附组成蛋白直接或间接联接,因而是整合细胞黏附形成、解体的动力学过程的核心蛋白.
细胞黏附的形成,是指激活成簇的整合素将黏附各组成蛋白,征集进入其β 亚基胞内区域而形成新生细胞黏附的过程.Talin 在细胞黏附形成中,主要在整合素激活与征集其他细胞黏附的组成蛋白中起重要作用.talin 与整合素β 亚基胞内区域的结合可使整合素处于激活状态[16-17].以RNA 干扰降低talin 表达可显著抑制整合素激活[18];在talin 低表达细胞中转染talin 基因,可使整合素恢复激活状态[19].其可能机制为:talin是激活整合素的关键因素——小G 蛋白Rap1A 的下游效应分子,通过talin 与整合素的直接结合,传递Rap1A 信号给整合素[19].通常,激活的整合素按顺序依次,而非同时征集细胞黏附的各组成蛋白,进入新生的细胞黏附中[20].然而,何种蛋白处于该征集过程的最上游?一直以来,公认是talin 最早进入细胞黏附中[21-22].但最近研究表明,黏附斑激酶FAK,先于talin 进入细胞黏附.将FAK 结合talin 位点E1015 突变后,在新生的细胞黏附中,有FAK 存在,但没有发现talin,表明FAK 可先于talin 进入细胞黏附.现已确认,talin处于征集过程中仅次于FAK 的第二位.FAK 需与talin 结合,将talin 征集到新生的黏附中.随后,talin 位于所有其他蛋白的上游,直接或间接与其他黏附组成蛋白相互作用,构成细胞黏附[23].
3 Talin 在细胞黏附解体中的作用
与细胞黏附的形成相比,对黏附解体的调控机制目前却还不甚明了.已知RhoA-ROCK 信号通路调控肌球蛋白收缩,使黏附斑解体[24-25].微管在dynamin 和FAK 参与下,可诱导黏附斑解体[26].但这些机制都还缺乏对具体黏附组成蛋白解体的研究.越来越多的研究表明,钙依赖型蛋白酶Calpain(calcium-dependent protease)可能是诱导黏附斑解体的更重要原因.Calpain 位于黏附斑中,主要有Calpain 1 和Calpain 2 两种亚型.一般认为,细胞前沿的黏附斑的转换,由Calpain1 完成;细胞尾部的黏附斑解体,由Calpain 2 完成[27].Calpain 2 可将组成黏附斑的所有蛋白,如整合素β1 和β3 的胞内区域,FAK,talin,paxillin,vinculin 等为底物而将其裂解,从而切断整合素与肌动蛋白细胞骨架的联结,使黏附斑解体.
Calpain 2 对talin 蛋白的切割位点为其头部L432 处,将其全长蛋白切割为头部和尾部区域.点突变L432G 可有效抑制Calpain 对talin 蛋白的裂解,从而大大增加活细胞中黏附斑的持续时间[28],促进细胞黏附.最近,在talin 尾部E2492 处,发现一新的calpain 切割位点,但由于该位点处于talin 蛋白C 末端,可能对黏附斑解体的作用有限[29].Calpain 对其他黏附组成蛋白,如paxillin,vinculin,zyxin 等的裂解,高度依赖对talin 蛋白的裂解[28],即Calpain 只有裂解talin 后,才能有效裂解其他黏附组成蛋白.由此可见,Calpain 诱导的黏附斑解体,取决于对talin 蛋白的裂解,因而Calpain 介导的talin 蛋白的裂解在黏附解体中起关键作用.
Calpain 裂解蛋白的作用机制,已基本明确[30-31].通常,Calpain 在毫摩级钙离子浓度下,可处于激活状态.但在活细胞中,很难达到此种浓度.其激活机制为,在胞外表皮生长因子(EGF)刺激下,激活MAPK 通路,最终激活ERK.ERK 磷酸化Calpain 50 位的丝氨酸,从而激活Calpain.蛋白激酶A(PKA),可磷酸化Calpain 269 位丝氨酸或379 位苏氨酸,从而抑制Calpain 的激活,可抵消ERK 对Calpain 的激活效果[32](图2[27]).
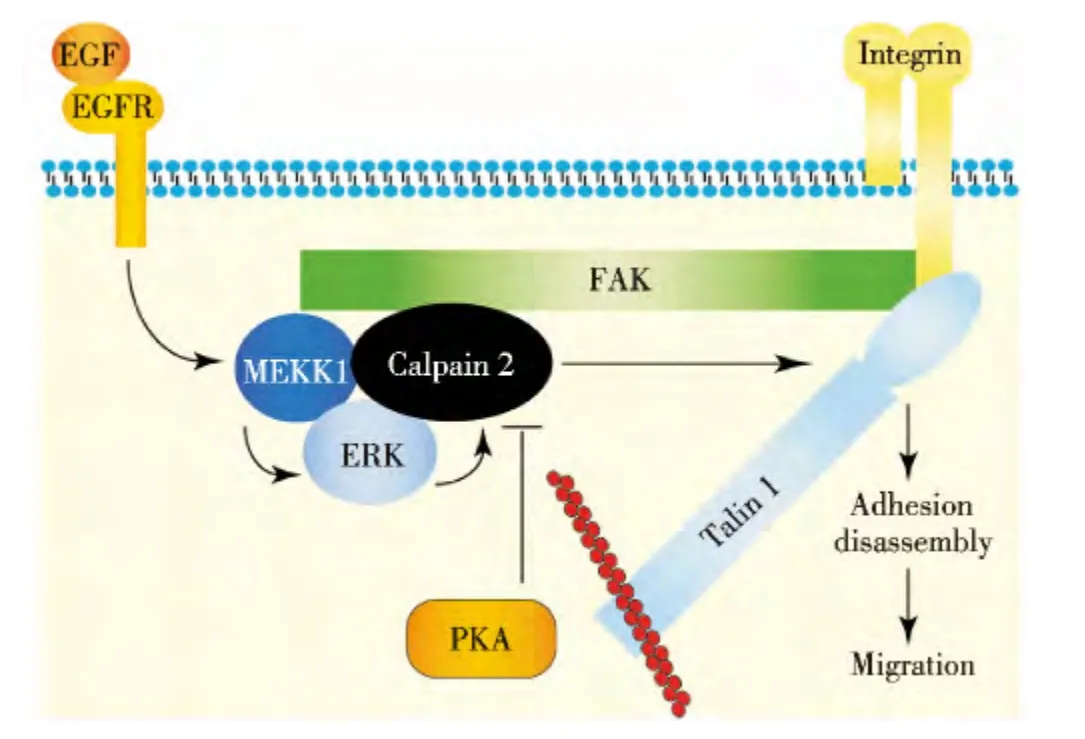
图2 Calpain 裂解蛋白的作用机制Fig.2 Mechanism of calpain-mediated proteolysis
4 Talin 与个体发育和肿瘤浸润转移的关系
由于talin 在黏附的形成、解体中的重要作用,对talin 蛋白的研究已成为细胞黏附的热点,其与个体发育和疾病的发生、发展的关系,也得到普遍关注.敲除talin1 的小鼠胚胎受精后8.5~9.5 d 由于原肠胚发育停滞,导致胚胎致死[33].在许多癌症转移病人中均存在Calpain 2 表达上调[34-35],而Calpain 2 影响细胞转移的作用主要是通过切割talin 而实现的,因而人们开始在talin 蛋白结构中寻找影响Calpain 2 活性的位点.对细胞黏附talin 头部的苏氨酸、丝氨酸质谱分析表明,talin 头部存在几个高化学计算磷酸化位点,这些位点可能控制Calpain 介导的对talin 蛋白的裂解,以及影响talin 与其他蛋白间的相互作用[15],但目前还极少有talin 与肿瘤浸润转移直接相关的研究报道.有理由相信,随着对talin 蛋白结构、功能,以及与其他蛋白间相互作用的研究,talin 可成为治疗包括癌症等与细胞转移有关疾病的有用的分子靶标.
[1]STEEG P S.Tumor metastasis:mechanistic insights and clinical challenges[J].Nat Med,2006,12(8):895-904.
[2]FRIEDL P,WOLF K.Tumour-cell and migration:diversity and escape mechanism[J].Nat Rev Cancer,2003,3:362-374.
[3]RIDLEY A J,SCHWARTZ M A,BURRIDGE K,et al.Cell migration:integrating signals from front to back[J].Science,2003,302(5651):1704-1709.
[4]VICENTE-MANZANARES M,WEBB D J,et al.Cell migration at a glance[J].J Cell Sci,2005,118:4917-4919.
[5]HOOD J D,CHERSH D A.Role of integrins in cell invasion and migration[J].Nat Rev Cancer,2002,2:91-100.
[6]GIANCOTTI F,RUOSLAHTI E.Integrin signaling[J].Science,1999,285(5430):1028-1033.
[7]WEBB D J,PARSONS J T,HORWITZ A F.Adhesion assembly,disassembly and turnover in migrating cells over and over and over again[J].Nat Cell Biol,2002,4:E97-E100.
[8]PARSONS J T,HORWITZ A R,SCHWARTZ M A.Cell adhesion:integrating cytoskeletal dynamics and cellular tension[J].Nat Rev Mol Cell Biol,2010,11:633-643.
[9]PETIT V,THIERY J P.Focal adhesions:structure and dynamics[J].Biol Cell,2000,92(7):477-494.
[10]WEBB D J,DONAIS K,WHITMORE L A,et al.FAK-Src signalling through paxillin,ERK and MLCK regulates adhesion disassembly[J].Nat Cell Biol,2004,6:154-161.
[11]ZAIDEL-BAR R,ITZKOVITZ S,MA'AYAN A,et al.Functional atlas of the integrin adhesome[J].Nat Cell Biol,2007,9:858-867.
[12]ZAIDEL-BAR Z,GEIGER B.The switchable integrin adhesome[J].J Cell Sci,2010,123:1385-1388.
[13]PRIDDLE H,HEMMINGS L,MONKLEY S,et al.Disruption of the talin gene compromises focal adhesion assembly in undifferentiated but not differentiated embryonic stem cells[J].J Cell Biol,1998,142(4):1121-1133.
[14]CRITCHLEY D R,GINGRAS A R.Talin at a glance[J].J Cell Sci,2008,121:1345-1347.
[15]RATNIKOV B,PTAK C,HAN J,et al.Talin phosphorylation sites mapped by mass spectrometry[J].J Cell Sci,2005,118:4921-4923.
[16]CALDERWOOD D A,YAN B,PEREDA J M,et al.The phosphotyrosine binding-like domain of talin activates integrins[J].J Biol Chem,2002,277:21749-21758.
[17]TADOKORO S,SHATTIL S J,ETO K,et al.Talin binding to integrin β tails:a final common step in integrin activation[J].Science,2003,302(5642):103-106.
[18]PETRICH B G,MARCHESE P,RUGGERI Z M,et al.Talin is required for integrin-mediated platelet function in hemostasis and thrombosis[J].J Exp Med,2007,204(13):3103-3111.
[19]HAN J W,LIM C J,WATANABE N,et al.Reconstructing and deconstructing agonist-induced activation of integrin α IIb β 3[J].Curr Biol,2006,16(18):1796-1806.
[20]LAUKAITIS C M,WEBB D J,DONAIS K,et al.Differential dynamics of α5 integrin,paxillin,and α-actinin during formation and disassembly of adhesions in migrating cells[J].J Cell Biol,2001,153(7):1427-1440.
[21]ZHANG X,JIANG G,CAI Y,et al.Talin depletion reveals independence of initial cell spreading from integrin ctivation and traction[J].Nat Cell Biol,2008,10:1062-1068
[22]WANG P,BALLESTREM C,STREULI C H.The C terminus of talin links integrins to cell cycle progression[J].J Cell Biol,2011,195(3):499-513.
[23]LAWSON C,LIM S T,URYU,S,et al.FAK promotes recruitment of talin to nascent adhesions to control cell motility[J].J Cell Biol,2012,196(2):223-232.
[24]CHRZANOWSKA-WODNICKA M,BURRIDGE K.Rho-stimulated contractility drives the formation of stress fibers and focal adhesions[J].J Cell Biol,1996,133(6):1403-1415.
[25]EVEN-RAM S,DOYLE A D,CONTI M A,et al.Myosin IIA regulates cell motility and actomyosin-microtubule crosstalk[J].Nat Cell Biol,2007,9:299-309.
[26]EZRATTY E J,PARTRIDGE M A,GUNDERSEN G G.Microtuble-induced focal adhesion disassembly is mediated by dynamin and focal adhesion kinase[J].Nat Cell Biol,2005,7:581-590.
[27]FRANCO S J,HUTTENLOCHER A.Regulating cell migration:calpains make the cut[J].J Cell Sci,2005,118:3829-3838.
[28]FRANCO S J,RODGERS M A,PERRIN B J,et al.Calpain-mediated proteolysis of talin regulates adhesion dynamics[J].Nat Cell Biol,2004,6:977-983.
[29]BATE N,GINGRAS A R,BACHIR A,et al.Talin contains A C-terminal calpain2 cleavage site important in focal adhesion dynamics[J].PLoS One,2012,7(4):e34461.
[30]GLADING A,CHANG P,LAUFFENBURGER D A,et al.Epidermal growth factor receptor activation of calpain is required for fibroblast motility and occurs via an ERK/MAP kinase signaling pathway[J].J Biol Chem,2000,275:2390-2398.
[31]GLADING A,BODNAR R J,REYNOLDS I J,et al.Epidermal growth factor activates m-calpain(calpain II),at least in part,by extracellular signal-regulated kinase-mediated phosphorylation[J].Mol Cell Biol,2004,24(6):2499-2512.
[32]SHIRAHA H,GLADING A,CHOU J,et al.Activation of m-calpain(calpain II)by epidermal growth factor is limited by protein kinase a phosphorylation of m-calpain[J].Mol Cell Biol,2002,22(8):2716-2727.
[33]MONKLEY S J,ZHO X,KINSTON S J,et al.Disruption of the talin gene arrests mouse development at the gastrulation stage[J].Dev Dyn,2000,219(4):560-574.
[34]CARRAGHER N O,FONSECA B D,FRAME M C.Calpain activity is generally elevated during transformation but has oncogene-specific biological functions[J].Neoplasia,2004,6(1):53-73.
[35]MAMOUNE A,LUO J H,LAUFFENBURGER D A,et al.Calpain-2 as a target for limiting prostate cancer invasion[J].Cancer Res,2003,63:4632-4640.
