骨桥蛋白OPN在哺乳动物生殖上的作用及在生猪生产应用上的展望
2015-12-22陈志林冯美莹卫恒习张守全
叶 超,陈志林,冯美莹,卫恒习,张守全
(华南农业大学动物科学学院,广州 510642)
骨桥蛋白OPN在哺乳动物生殖上的作用及在生猪生产应用上的展望
叶 超,陈志林,冯美莹,卫恒习,张守全
(华南农业大学动物科学学院,广州 510642)
骨桥蛋白(osteopontion,OPN)是细胞外基质中的一种分泌性糖基类酸性蛋白质,富含天冬氨酸、谷氨酸和丝氨酸。有研究表明,骨桥蛋白在雌性、雄性哺乳动物生殖系统中广泛表达,与哺乳动物的生殖机能息息相关。它不仅影响子宫内膜容受性的建立、胚胎的着床,且在精卵融合过程中发挥着至关重要的作用。就OPN在哺乳动物生殖上的相关作用和机理进行了综述,并对该蛋白今后在生猪生产上的应用进行展望。
骨桥蛋白;精卵融合;胚胎着床;子宫内膜容受性建立
1 OPN与雄性哺乳动物生殖
骨桥蛋白相对分子质量大小在25KD~80KD。它于1979年被Senger首次发现,在而后的几十年国内外学者相继在骨、肺、肝、膀胱、乳腺、睾丸、骨髓和蜕膜等组织结构中发现这种蛋白质。最近的研究结果表明该蛋白质参与肿瘤恶化、骨基质的矿化和吸收、组织创伤修复等生理过程,且在心血管系统、免疫系统、消化系统及泌尿系统中扮演着重要的角色。骨桥蛋白是机体内多种组织细胞均能合成并分泌的一种重要的分泌性细胞因子,其作为细胞外基质中的一种重要的非胶原蛋白,具有多种生理作用。目前研究发现,OPN蛋白在哺乳动物生殖系统中广泛存在,与雄性哺乳动物的生殖机能息息相关。
1.1 OPN在雄性哺乳动物生殖系统中的分布与表达
Killian等人[1]通过应用双向电泳和质谱技术,在具有高繁殖性能的荷斯坦公牛个体精清上发现了OPN,并初步确定OPN于荷斯坦公牛的繁殖性能有关;随后,Hammerstedt等人[2]通过双向电泳蛋白质图谱比对分析,最终确定OPN是一种与受精能力有关的蛋白。另外,OPN蛋白通过免疫印迹的方法在对马的研究上,也确定了OPN与马的繁殖力有关[3]。
Luedtke等人[4]应用免疫细胞化学的方法发现,大鼠从出生开始一直到发育成熟,其睾丸、附睾、输精管均有OPN蛋白表达。而且在睾丸组织中,OPN主要表达于精原细胞至早粗线期的精母细胞中;在附睾中,OPN主要在无纤毛细胞中表达;在附睾中,OPN蛋白的表达显现出特定区域性及特定细胞性。相比之下,公牛的OPN蛋白最早发现于牛精液中。随后有学者通过Western印迹的方法,分别在精囊、输精管壶腹部检测到OPN的表达,由于得到的OPN 分子质量与精清中的OPN 分子质量一致,故认为精清中的OPN可能来源于精囊或者输精管壶腹部[4]。Novak S[5]等人研究发现公猪的生殖系统内亦有OPN蛋白的表达。Taekyun Shin等人[6]用兔抗人OPN抗体对猪睾丸进行Western Blot检测后,发现在1日龄的公猪睾丸上只存在66kD的OPN蛋白,在6月龄的公猪睾丸上分别存在32kD和66kD的2条OPN蛋白带,同时通过免疫组织化学检测后,发现不同阶段的精母细胞上存在OPN,在支持细胞上也有少量的OPN表达,然而晚期精子细胞和成熟的精子细胞上却没有发现OPN的表达,这些发现暗示着OPN能在大多数的生殖细胞上检测到,且OPN可能参与精子的发生与形成过程。Souza等人[7]通过免疫细胞化学技术,在狗的生殖系统上也发现了OPN蛋白的表达。
综上所述,OPN广泛表达于雄性哺乳动物生殖系统中,如睾丸、附睾、前列腺、输精管等。但OPN蛋白的表达量因动物种属、动物个体甚至相同个体不同时期而不同。根据目前的研究数据显示,OPN蛋白的表达量与哺乳动物的繁殖力密切相关,但其中的具体分子机制尚需深入研究。
1.2 OPN对哺乳动物精子受精的影响
OPN蛋白含有精氨酸—甘氨酸—天冬氨酸(Arg-Gly-Asp,RGD)序列,该序列在不同物种的OPN中普遍存在,对OPN发挥黏附功能起着至关重要的作用。RGD序列为高度保守的特异性细胞黏附功能阈,该序列可特异性地与细胞表面整合素受体 αvβ、αvβ3、 αvβ5、β3等结合,参与糖蛋白与细胞间的黏附过程,引起局部黏附,改变细胞骨架,促进细胞迁移。RGD序列具有高度保守性,一旦变异或缺失将丧失其促黏附的功能[8,9]。
受精对个体的遗传基因传递起着至关重要的作用,同时也预示着一个新生命的诞生。在哺乳动物中,受精起始于精子与卵子的直接相互作用,这个过程由一系列的四旋蛋白、整合素、解离素和金属蛋白起着调控作用。而卵子上的整合素很有可能与精子OPN发生结合[10],从而介导精卵融合(图1)。但具体的精卵融合机理目前还没有研究透彻。
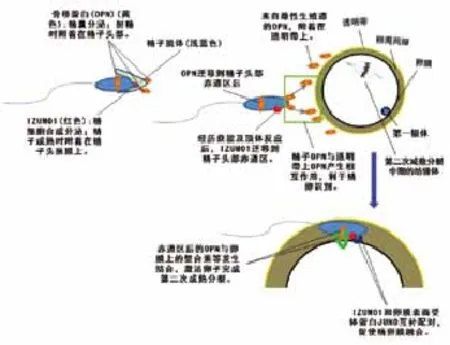
图1 骨桥蛋白OPN在受精过程中的作用
精卵融合受精是哺乳动物发育的基础,有活力的精子是受精的先决条件。在精子的运动、获能、受精、与卵子的融合、以及后期的胚胎发育等过程中,精子上的蛋白质起着至关重要的作用。如果精子上的某些蛋白缺失可造成人类生育能力下降甚至是不育[11]。根据已有的数据显示OPN蛋白与精子的活力、畸形率等息息相关。Killian等人通过抗牛OPN抗体进行对牛的体外受精实验,结果显示,被抗牛OPN抗体作用以后的精子与卵子,体外受精能力显著下降,这说明了OPN可能介导了牛精子和卵子的融合过程[12]。此外OPN在减少多精入卵上也发挥着重要的作用,Erikson等人[13]通过体外受精实验,在受精体系中加入OPN抗体后发现,精子受精率明显降低,但多精入卵率则显著升高。这点和Hao等人[14]的研究结果一致。
2 OPN在雌性哺乳动物生殖上的作用
2.1 输卵管中的OPN
输卵管内连子宫,外接卵巢。众所周知输卵管在精子获能、卵子受精、受精卵输送及早期胚胎发育中发挥着不可替代的作用。哺乳动物受精时,精子和卵子分别从相反的方向进入输卵管壶腹部,并在此完成受精过程,而在此过程中输卵管为受精过程提供适宜的环境。受精卵继续停留在输卵管内发育分裂,直至子宫内膜及子宫肌层已成熟而变得宜于受精卵着床之时,始由输卵管进入子宫腔[15]。
输卵管上皮细胞分泌物、输卵管血管渗透液、少许的腹腔液和子宫液等等构成了输卵管管液的主要成分。输卵管管液促进精子和卵子的进一步成熟、卵子受精、受精卵的早期发育与运输等过程。根据现有的资料显示,输卵管管液中存在着OPN蛋白[16]。Luedtke等人[4]2002年报道称OPN蛋白在不影响精子活力及存活率的前提下,参与调节精子获能过程及顶体反应, 从而保证了精子在与卵子接触前具有正常的受精能力。研究发现一定浓度的OPN蛋白促进精子获能、卵子受精及早期受精卵的卵裂[17,18]。但到目前为止,仍没有其他文献报道,OPN在精子获能、卵子受精等生理过程中的具体机制。
2.2 OPN参与子宫内膜容受性的建立
子宫内膜容受性是指内膜对胚胎的接受能力。在哺乳动物生殖中,只有处在一定发育阶段的胚泡与特定功能状态的子宫内膜接触才能植入,而这两特定的同步阶段称为内膜种植窗。根据生殖医学资料,内膜种植窗是受精卵定位、黏附和着床的必要条件[19,20]。通过免疫组化法研究发现整合素αvβ3 特异性地表达于内膜 的种植窗, 是目前公认的内膜容受性的标志蛋白。而整合素αvβ3正是OPN蛋白的一种受体。此外子宫内膜基因表达的检测结果也显示,子宫内膜植入窗期OPN蛋白的表达量显著增加[21]。这似乎预示着,OPN蛋白参与了子宫内膜容受性建立的过程。
在人和绵羊体内,OPN是子宫上皮腺分泌物,黏附于上皮细胞表面及孕体滋养层。并且是围种植入期维持妊娠的关键因素。在整个妊娠期,OPN蛋白对于胚胎与胎盘之间的细胞间的黏附、信号传导、迁移移动具有非常重要的作用。Greg等人[22]研究发现,在绵羊妊娠25~120 d这段时间OPN及其mRNA在绵羊子宫内的表达量发生显著变化。而在妊娠40~80 d,来源于子宫腺上皮的OPN在子宫内膜上的表达量增长了30倍。此外研究发现,在整个妊娠过程中仅分子质量为45kD的OPN连续大量表达于内膜腺上皮、孕体滋养层以及子宫-胎盘的接触面上。据目前的研究显示,45kD OPN在诱导细胞之间相互黏附和细胞迁移上要较其他分子量的OPN作用更强。
2.3 OPN对胚胎着床的作用
妊娠是一个十分复杂的过程,大致可以分为胚胎的着床与胚胎的发育。胚胎的着床过程中,OPN不仅作为细胞因子,还充当黏附因子的作用,对胚胎着床起着至关重要的作用。OPN主要是通过RGD序列与整合素等多种受体结合,参与细胞的黏附和迁移。OPN在哺乳动物的母-胚胎界面持续表达,充当类似于母体胎盘间的介质。虽然具体分子机制目前暂未清楚,但普遍学者认为,OPN在调节胚胎着床等方面的作用不可置否,极可能是胚胎-子宫微环境的重要组成部分,且参与了胎盘的形成过程,而且对于胚胎的发育成熟起着促进作用[23]。另外,在子宫内膜和胚胎上,OPN主要与它的受体αvβ3结合,造成了细胞黏附和迁移行为的开启。OPN基因及蛋白在早孕小鼠子宫内膜的动态表达规律及在子宫内膜的分布变化暗示了OPN参与胚泡着床的黏附过程。有OPN在妊娠中后期小鼠胎盘的表达和分布提示,OPN可能是影响子宫-胚胎微环境的重要组成部分,参与了胎盘形成,促进了胚胎发育成熟[24]。
总之,OPN在哺乳动物妊娠过程中主要存在以下3方面的作用:首先,在整个孕期,是影响子宫-胚胎界面细胞黏附和信号转导的组织营养物质的成分;其次是子宫内膜和滋养层细胞表达的产物,引起与胚胎侵袭相关的蜕膜化改变;最后是OPN蛋白长期在子宫和胚胎免疫细胞表达,且调控与其相关功能的细胞因子,促进小鼠胚胎的正常发育,维持妊娠过程[25]。
3 OPN在生猪生产中应用的展望
综上可知,OPN蛋白无论是在雄性哺乳动物还是雌性哺乳动物的生殖系统中都是普遍存在的,且广泛参与了整个生殖过程。虽然目前已经有了大量的证据证明这一点,但是其中的大部分的分子机制到目前还不是很清楚。研究OPN蛋白与哺乳动物生殖的关系,在人类医学方面有助于理解人类受精过程, 有助于提高辅助生殖技术的受精率和妊娠率, 减少并发症 ( 如多胎妊娠) 发生。
在畜牧学方面,目前有学者认为,高繁殖力公畜与低繁殖力公畜的精液里OPN蛋白含量存在显著性差异,但目前还没有直接的证据证明,本实验室目前正在研究OPN蛋白与公猪繁殖力的相关联系及其中的具体的分子机制。众所周知,目前生猪生产中普遍采用人工授精的方式,人工授精这种技术的应用就决定了公猪精液品质对整个生猪生产中起到至关重要作用,它在很大程度上影响了猪场的生产成绩。目前在人工授精前,一般猪场会采用肉眼观察结合显微镜下观察的方式综合评定精液品质,具体指标有精液的颜色、气味,以及精子活力,畸形率等。但是即使在这些指标都正常的情况下,各个公猪的生产成绩也是参差不齐。目前的资料显示OPN等蛋白对精卵融合,受精过程中产生至关重要的影响。如果通过实验验证,公猪精液中OPN蛋白的含量和公猪的繁殖力有直接的相关性,我们就可以做成一种简易检测试剂盒,在猪场人工授精前,通过这种试剂盒检测精液中OPN蛋白的含量高低,继而得出该精液品质的好坏。通过这样的方式,将会极大地提高猪场的生产成绩,给生猪生产带来巨大的经济效益。
[1] Killian, G J,Chapman D A,Rogowski L A. Fertility-associated proteins in Holstein bull seminal plasma[J]. Biol Reprod, 1993, 49(6):1202-1207.
[2] Amann R P,Hammerstedt R H.Detection of differences in fertility[J].J Androl, 2002,23(3):317-325.
[3] Brandon CI, Heusner G L,Caudle A B,et al.Two-dimensional polyacrylamide gel electrophoresis of equine seminal plasma proteins and their correlation with fertility[J]. Theriogenology,1999,52(5): 863-873.
[4] Cancel A M,Chapman D A, Killian G J.Osteopontin localization in the Holstein bull reproductive tract[J]. Biol Reprod, 1999,60(2): 454-460.
[5] Nova S,Ruiz-Sánchez A,Dixon W T, et al. Seminal plasma proteins as potential markers of relative fertility in boars[J]. J Androl, 2010,31(2):188-200.
[6] Kim S,Shin T.Immunohistochemical study of osteopontin in boar testis[J]. J Vet Sci,2007,8(2): 107-110.
[7] Souza F F, Chirinéa V H, Martins M I M, et al. Osteopontin in seminal plasma and sperm membrane of dogs[J]. Reprod Domest Anim, 2009,44 Suppl 2: 283-286.
[8] Perrien D S,Brown E C,Aronson J,et al. Immunohistochemical study of osteopontin expression during distraction osteogenesis in the rat[J]. J Histochem Cytochem, 2002, 50(4):567-574.
[9] Nakamura M,Oka M,Iizuka N,et al. Osteopontin expression in chronic pancreatitis[J].Pancreas,2002,25(2):182-187.
[10] Klinovska K,Sebkova N,Dvorakova-Hortova K.Spermegg fusion:a molecular enigma of mammalian reproduction[J].Int J Mol Sci,2014,15(6): 10652-10668.
[11] Frapsauce C,Pionneau C,Bouley J,et al. Proteomic identification of target proteins in normal but nonfertilizing sperm[J].Fertil Steril,2014,102(2):372-380.
[12] Lin C,Tholen E, Jennen D,et al. Evidence for effects of testis and epididymis expressed genes on sperm quality and boar fertility traits[J]. Reprod Domest Anim, 2006,41(6):538-543.
[13] Erikson D W,Way1 A L,Chapman D A,et al.Detection of osteopontin on Holstein bull spermatozoa, in cauda epididymal fluid and testis homogenates, and its potential role in bovine fertilization[J].Reproduction, 2007,133(5): 909-917.
[14] Hao,Y,Mathialagan N,Walters E, et al. Osteopontin reduces polyspermy during in vitro fertilization of porcine oocytes[J].Biol Reprod,2006,75(5):726-733.
[15] 杨利国.动物繁殖学[M].北京:中国农业出版社,2008:3.
[16] Gabler C,Chapman D A,Killian G J.Expression and presence of osteopontin and integrins in the bovine oviduct during the oestrouscyclej].Reproduction,2003,126(6): 721-729.
[17] Goncalves R F,Wolinetz C D, Killian G J.Influence of arginine-glycineaspartic acid (RGD), integrins (alphaV and alpha5) and osteopontin on bovine sperm-egg binding, and fertilization in vitro[J]. Theriogenolo gy,2007,67(3):468-474.
[18] Monaco E,Bianca Gasparrini,Boccia L,et al. Effect of osteopontin (OPN) on in vitro embryo development in cattle[J].Theriogenology,2009,71(3):450-457.
[19] 马彩虹,陈贵安,韩劲松,等.骨桥蛋白和整合素在子宫内膜异位症中的表达[J]. 中国生育健康杂志,2006,17(6):355-358.
[20] 何荣环,张爱青,吴琰婷.子宫内膜骨桥蛋白mRNA表达与不明原因不孕的关系[J].浙江预防医学,2006,18(6):12-14,17.
[21] 史文静,韩西群,邓 卿,等.骨桥蛋白及其受体异常表达在子宫内膜异位症中的作用[J].解剖学研究,2011,33(3):169-171,175.
[22] Johnson G A,Burghardt R C,Joyce M M,et al.Osteopontin is synthesized by uterine glands and a 45-ku cleavage fragment is localized at the uterine-placental interface throughout ovine pregnancy[J]. Theriogenology,2003,126(3):521-529.
[23] Garlow J E,Ka H,Johnson G A,et al.Analysis of osteopontin at the maternal-placental interface in pigs [J]. Biol Reprod,2002(66):718-725.
[24] Apparao K B C, Illera M J, Beyler S A, et al. Regulated expression of osteopontin in the periimplantation rabbit uterus [J]. Biol Reprod,2003(68):1484-1490.
[25] 冉静.OPN在妊娠小鼠子宫和胎盘的表达规律及意义[D].重庆:重庆医科大学,2006:1-52.
2015-06-11)
国家杰出青年科学基金。通讯作者:张守全。
