球囊扩张式支架治疗症状性椎动脉颅内段狭窄临床观察
2015-12-22柳文科杨霄鹏
柳文科 杨霄鹏
郑州大学第二附属医院神经内科 郑州 450014
球囊扩张式支架治疗症状性椎动脉颅内段狭窄临床观察
柳文科 杨霄鹏△
郑州大学第二附属医院神经内科 郑州 450014
目的 探讨Apollo球囊扩张式支架治疗症状性椎动脉颅内段粥样硬化狭窄安全性和有效性。方法 自2010-07—2014-03 36例连续的椎动脉颅内段粥样硬化狭窄患者在我院接受apollo支架成形术,所有患者病变狭窄程度≥70%、伴有狭窄病变相关的卒中或短暂性脑缺血发作并且对侧椎动脉均存在闭塞性病变。患者临床基本资料、术前术后的脑血管造影、围手术期结果、临床及影响学随访结果均被回顾性分析。结果 36例患者均成功置入支架,平均狭窄率由术前的(82.3± 5.1)%改善到术后即刻的(15.2±5.4)%。围手术期(30d内)出现2例(5.6%,2/36)出血卒中和1例(2.8%,1/36)短暂性脑缺血发作(TIA);2例出血性卒中均为蛛网膜下腔出血,发生于术中,其中1例(2.8%,1/36)死亡;1例TIA发生于术后第3天,考虑支架内血栓形成,给予治疗后症状消失。29例(80.6%,29/36)获得临床随访,平均随访时间(24.2±8.3)月,1例(3.4%,1/29)随访过程中出现后循环小卒中,3例(10.3%,3/29)出现后循环TIA,2例非卒中相关死亡。24例(66.7%,24/36)完成影像随访,平均随访时间(9.9±8.3)月,5例(20.8%,5/24)出现再狭窄,其中3例(60.0%,3/5)为症状性再狭窄,3例均接受再次血管内治疗。结论 Apollo球囊扩张式支架治疗症状性椎动脉颅内段粥样硬化狭窄围手术期并发症发生率低,远期疗效显著。
动脉粥样硬化;椎动脉;支架;狭窄
颅内椎动脉狭窄是引起后循环缺血的重要原因[1],WASID研究[2]显示,椎动脉颅内段狭窄引起的后循环缺血尽管经过严格的抗栓治疗年卒中率仍达到7.8%;近期的研究[3-4]也显示,经过强化药物治疗联合近乎理想化的血管危险因素控制方案,椎动脉颅内段狭窄2a累积卒中率仍达到10%,支架组也因为较高的围手术期并发症发生率而使得最终结果不优于药物组。Apollo支架是专用于颅内血管的国产支架,既往研究[5]也显示了较好的临床效果,本研究回顾性分析应用Apollo支架治疗症状性椎动脉颅内段粥样硬化狭窄的临床资料,探讨中国人群中椎动脉颅内段狭窄患者药物联合支架成形术治疗的安全性和长期临床疗效。
1 资料与方法
1.1 一般资料 自2010-07—2014-03我院共完成椎动脉颅内段Apollo支架成形术36例,伴有同侧椎动脉颅外段狭窄或基底动脉狭窄的病例已被排除在外,所有36例患者均为单侧椎动脉颅内段严重狭窄而对侧椎动脉闭塞或先天发育纤细,术前均经有经验的神经病学专家评估,确认其症状可能与病变椎动脉颅内段狭窄病变相关。所有患者术前均签署知情同意书,术前均经DSA证实病变狭窄程度在70%~99%且对侧椎动脉存在闭塞或严重狭窄病变。狭窄度的测量按照WASID研究的测量标准[6]。末次事件为短暂性脑缺血发作(transient ischemic attack,TIA)的患者手术时间距离末次发作均>24h,而末次事件为小卒中的患者手术时间距离末次发作均>7d。
入组患者中男24例,女12例,平均年龄(62.6±10.1)岁,年龄41~82岁;术前症状表现为TIA者21例(58.3%),卒中15例(41.7%),其中术前表现有头晕者33例(91.7%),听力障碍者4例(11.1%),吞咽困难者2例(5.6%),言语障碍者7例(19.4%),肢体功能障碍者11例(30.6%),共济障碍者3例(8,3%),有视物障碍者11例(30.6%);其中病变累及椎基底回合处者11例。动脉粥样硬化危险因素有:高血压29例(80.6%),糖尿病17例(47.2%),高血脂20例(55.6%),有吸烟史12例(33.3%);狭窄长度≥10mm者6例(16.7%),5~10mm者22例(61.1%),<5mm者8例。末次事件距离手术时间(15.3± 7.9)d。
1.2 手术方法 所有手术均在全麻下进行,全身肝素化,术中凝血时间维持在250~300s。股动脉入路,置入6F动脉鞘,常规使用6F导引导管或长鞘,将导管头置于椎动脉颈段以远,行3D造影选择最佳工作角度,使用路径图模式,在微导管配合下将0.014in(1in=2.54cm)微导丝通过狭窄段,导丝头置于大脑后动脉较平直的血管。Apollo支架(上海微创)沿微导丝送至狭窄段,对位准确后使用50%对比剂缓慢充盈球囊至6atm(1atm=101.325kPa),回抽造影剂后造影观察血管即刻改善情况。支架直径选择为小于狭窄两端正常血管直径,长度要求完全覆盖狭窄段并且略长于狭窄段。即刻造影观察残余狭窄及远端血管分支,残余狭窄≤30%、远端血管未见减少可撤出微导丝及指引导管。
1.3 围手术期管理 术前双抗血小板:氯吡格雷(75mg/d)和拜阿司匹林(100mg/d)至少3d。术前2h静脉应用尼莫地平。支架成形术后即刻行CT扫描排除脑出血;自然中和肝素;继续使用尼莫地平1~3d,将血压控制在基础血压下限。排除出血者术后给予低分子肝素4 000~6 000U/12h皮下注射3d,术后双抗血小板6月后改口服拜阿司匹林100mg/d长期服用,同时控制其他动脉粥样硬化危险因素。
1.4 临床及影像学随访 观察围手术期30d内所有卒中、死亡及TIA发作情况。术前、术后即刻及出院前进行mRS 及NIHSS评分,出院后1、3、6月对患者神经系统进行临床评估,术后12月及以后每年进行临床随访,随访过程中对怀疑有卒中复发的患者行头颅CT或MRI检查;术后6个月进行影像学随访。本组再狭窄的定义为支架内或远近端5mm内狭窄超过50%且绝对管腔丢失超过20%[7]。
2 结果
2.1 围手术期情况 36例患者均成功实施支架成形术,平均狭窄率由术前的(82.3±5.1)%改善到术后即刻的(15.2±5.4)%。围手术期(30d内)2例(5.6%,2/36)发生出血卒中和1例(2.8%,1/36)TIA;2例出血性卒中均为蛛网膜下腔出血,发生于术中,1例术中球囊扩张释放支架后造影发现大量造影剂外溢,考虑血管破裂,再次进行球囊封堵同时中和肝素,出血停止,但因出血量较大,术后24h内死于脑疝;1例支架释放后造影发现少量造影剂外渗,未特殊处理,观察10min再次造影未见造影剂外溢,术后即刻CT显示少量蛛网膜下腔出血,麻醉清醒后患者仅有轻微头痛,给予对症治疗,出院时患者未遗留任何神经功能缺失症状;另1例(1.1%)患者术后3d内多次出现一过性意识障碍并肢体无力,每次持续时间均未超过30min,查头颅CT未见颅内出血迹象,考虑支架内血栓形成,给予抗凝、抗血小板、扩容等治疗后症状未再次发作,患者未遗留任何神经功能缺失症状。2例术后出现穿刺部位血肿形成,自然吸收后痊愈。
2.2 临床随访结果 29例(80.6%,29/36)获得临床随访,平均随访(24.2±8.3)月(8~42个月),1例(3.4%,1/29)随访过程中出现后循环小卒中,3例(10.3%,3/29)出现后循环TIA,2例非卒中相关死亡。随访过程中再发卒中的患者症状轻微,经过康复治疗恢复良好;3例后循环TIA再发的患者均为再发眩晕症状,考虑后循环缺血所致;2例非卒中相关死亡的患者均为高龄患者,年龄均>75岁。
2.3 影像学结果 24例(66.7%,24/36)完成影像随访,平均随访(9.9±8.3)月(5~32个月),其中DSA复查16例(66.7%),CTA复查8(33.3%),典型病例见图1A~D;5例(20.8%,5/24)出现再狭窄,其中3例(60.0%,3/5)为症状性再狭窄,3例均接受再次血管内治疗,该3例患者均再次进行单纯球囊扩张,无手术并发症发生。
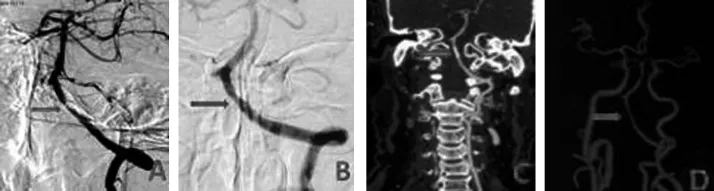
典型病例:患者,男,74岁,发作性头晕2月,加重1周;既往高血压20a,冠心病10a,规律口服阿司匹林治疗无效,头颅MRI未见后循环梗死,考虑后循环TIA,行DSA检查发现右侧椎动脉闭塞,左侧椎动脉V4段局限重度偏心性狭窄(A),置入3mm×8mm Apolio支架一枚,术后即刻显示狭窄明显改善(B),术后患者头晕症状未再故发作,术后13月复出头颈部CTA显示支架内通畅,未见再狭窄(C、D)
3 讨论
症状性颅内椎动脉粥样硬化狭窄是引起后循环缺血性卒中发生和复发的重要原因,目前的治疗主要是抗栓、他汀类药物、降压药物联合生活方式的调整[8],抗栓治疗仍有较高卒中发生率,在WlSID试验[9]中,平均随访1.8a,阿司匹林治疗组卒中、脑出血和死亡发生率高达15%,华法林组残疾率和死亡发生率更高(28%);而近期的SAMMPRIS研究[4]结果显示,最佳的药物治疗2a累积卒中率10%。对于伴有对侧椎动脉闭塞或严重狭窄的症状性椎动脉颅内段狭窄患者,支架成形术是药物治疗基础上的一种补充治疗手段,围手术期并发症一直是人们所关心的问题。一项比较自膨式支架和球扩式支架的大样本、多中心的回顾性分析[10]结果显示颅内椎动脉支架成形术围手术期并发症发生率4.1%,SAMMPRIS研究[11]中36例椎动脉颅内段支架成形术30d内出血性卒中3例(8.3%),缺血性卒中3例(8.3%),而本研究中使用Apollo球囊扩张式支架治疗椎动脉颅内段狭窄36例中仅3例(8.3%)出现并发症,而仅1例(2.8%,1/36)出现严重并发症,另外2例患者未遗留永久神经功能缺失。本研究结果与Jiang等[12]的回顾性研究结果一致。
本组结果围手术期并发症发生率较低,笔者认为:本组中患者末次缺血性事件距离手术时间较长,避免在粥样硬化斑块不稳定期进行介入操作,可能在一定程度上减少了栓塞事件的发生率[13]。相比基底动脉而言细小穿支较少,这可能是穿支并发症少的原因。支架成形术球囊扩张过程中过度改变主干动脉造成穿支扭转撕裂可能是颅内出血发生的主要原因[14],选择球囊过大或者狭窄钙化较重可能是血管破裂的原因,本组1例发生血管破裂考虑可能与过分追求影像学完美而选择较大直径的支架所致。本组病例中所有责任血管对侧椎动脉均存在闭塞或发育不良,因此责任血管的严重狭窄可能导致远端基底动脉供血不足从而导致后循环的低灌注缺血及发生动脉-动脉的栓塞事件,支架成形术一方面增加血流灌注[15],另一方面支架将粥样硬化斑块贴服与血管壁,减少了不稳定斑块的移动从而降低发生动脉-动脉栓塞事件的风险[16]。本组研究中29例获得临床随访,在平均随访24.2月期间仅有1例(3.4%)发生小卒中,无致死、致残性卒中发生,对缺血性卒中的远期预防效果可能优于强化药物治疗。而本组远期非缺血性卒中相关性死亡2例,而2例均为年龄75岁以上的高龄老人,这也提示我们对于预期寿命不长的高龄患者在选择治疗方案的时候应加以充分评估。
ISR发生率是评价支架成形术远期效果的重要指标,同时也是支架术后卒中复发的重要原因[17-20]。有学者认为,ISR的机制可能是支架与血管壁之间产生的炎性反应导致的内膜过度增生[19-20]。多中心Wingspan注册研究[17-18]显示,前循环、年轻患者支架术后更容易发生ISR,认为年轻患者前循环再狭窄的发生机制可能不同于老年人的动脉粥样硬化,而更类似于烟雾病的表现。而本研究症状性再狭窄的比例较高(60.0%),一方面由于这组研究数据中影像随访率较低(66.7%)可能存在选择性偏倚,另一方面这个结果也提示在中国人群中椎动脉颅内段支架内再狭窄可能更常见动脉粥样硬化性质而非单纯的内膜增生。
总之,本研究的结果显示椎动脉颅内段Apollo支架成形术围手术期并发症发生率低,远期对缺血性卒中的预防效果显著。但本研究仅仅回顾了Apollo支架治疗症状性椎动脉颅内段的效果,并未将其与自膨式支架或单纯球囊扩张以及单纯强化药物治疗进行对比,因此对于症状性椎动脉颅内段的动脉粥样硬化狭窄的治疗效果孰优孰劣还需要前瞻性、随机、多中心的对比研究加以验证。
[1]Caplan LR.Vertebrobasilar disease[J].Adv Neurol,2003,92:131-140.
[2]The Warfarin-Aspirin Symptomatic Intracranial Disease(WASID)Study Group.Prognosis of Patients With Symptomatic Vertebral or Basilar Artery Stenosis[J].Stroke,1998,29(7):1389-1392.
[3]Chimowitz MI,Lynn MJ,Derdeyn CP,et al.Stenting versus aggressive medical therapy for intracranial arterial stenosis [J].N Engl J Med,2011,365(11):993-1 003.
[4]Derdeyn CP,Chimowitz MI,Lynn MJ,et al.Aggressive medical treatment with or without stenting in high-risk patients with intracranial artery stenosis(SAMMPRIS):the final results of a randomised trial[J].Lancet,2014,383(9914):333-341.
[5]Jiang WJ,Xu XT,Jin M,et al.Apollo stent for symptomatic atherosclerotic intracranial stenosis:study results[J].AJNR Am J Neuroradiol,2007,28(5):830-834.
[6]Samuels OB,Joseph GJ,Lynn MJ,et al.A Standardized M-ethod for Measuring Intracranial Arterial Stenosis[J].AJNR Am J Neuroradiol,2000,21(4):643-646.
[7]Fiorella D,Levy EI,Turk AS,et al.Target lesion revaseularization after wingspan:assessment of safety and durability[J]. Stroke,2009,40(1):106-110.
[8]Goldstein LB,Bushnell CD,Adams RJ,et al.Guidelines for the primary prevention of stroke:aguideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2011,42(2):517-584.
[9]Kasner SE,Lynn MJ,Chimowitz MI,et al.Warfarin Aspirin S-ymptomatic Intracranial Disease trial Investigators.Warfarin vs Aspirin for Symptomatic Intracranial stenosis:subGroup analyses from WASID[J].Neurology,2006,67(7):1 275-1 278.
[10]Jiang WJ,Cheng Ching E,Abou Chebl A,et al.Multicenter analysis of stenting in symptomatic intracranial atherosclerosis [J].Neurosurgury,2012,70(1):25-30.
[11]Fiorella D,Derdeyn CP,Lynn MJ,et al.Detailed Analysis of Periprocedural Strokes in Patients Undergoing Intracranial Stenting in Stenting and Aggressive Medical Management for Preventing Recurrent Stroke in Intracranial Stenosis(SAMMPRIS)[J].Stroke,2012,43(10):2 682-2 688.
[12]Jiang WJ,Xu XT,Du B,et al.Long-term outcome of elective stenting for symptomatic intracranial vertebrobasilar stenosis [J].Neurology,2007,68(11):856-858.
[13]Gray WA,Yadav JS,Verta P,et al.The CAPTURE registry:predictors of outcomes in carotid artery stenting with embolic protection for high surgical risk patients in the early post-approval setting[J].Catheter Cardiovasc Interv,2007,70(7):1 025-1 033.
[14]Jiang WJ,Du B,Leung TW,et al.Symptomatic intracranial stenosis:cerebrovascular complications from elective stent placement[J].Radiology,2007,243(7):188-197.
[15]Tang CW,Chang FC,Chern CM,et al.Stenting versus medical treatment for severe symptomatic intracranial stenosis[J]. AJNR Am J Neuroradiol,2011,32(5):911-916.
[16]Purandare N,Voshaar RC,Morris J,et al.Asymptomatic spontaneous cerebral emboli predict cognitive and functional decline in dementia[J].Biol Psychiatry,2007,62(4):339-344.
[17]Levy EI,Turk AS,Albuquerque FC,et al.Wingspan in-stent restenosis and thrombosis:incidence,clinical presentation,and management[J].Neurosurgery,2007,61(3):644-650.
[18]Turk AS,Lew EI,Albuquerque FC,et al.Influence of patient age and stenosis location on wingspan in-stent restenosis[J]. AJNR Am J Neuroradiol,2008,29(1):23-27.
[19]Schwartz RS,Huber KC,Murphy JG,et al.Restenosis and the proportional neointimal response to coronary artery injury:results in a porcine model[J].J Am Coll Cardiol,1992,19(2):267-274.
[20]Hoffmann R,Mintz GS,Dussaillant GR,et al.Patterns and mechanisms of in-stent restenosis:a serial intravascular ultrasound study[J].Circulation,1996,94(6):1 247-1 254.
(收稿2014-07-06)
R743.1
A
1673-5110(2015)06-0039-03
△通讯作者:杨霄鹏,博士,硕士研究生导师,副教授
