金线莲多糖提取工艺研究
2015-12-22潘晓丽郑小香马玉芳黄一帆
李 萍,潘晓丽,郑小香,李 健,马玉芳,黄一帆
(福建农林大学中西兽医结合与动物保健福建省高校重点实验室,福建福州350002)
金线莲(Anoectochilus roxburghii(wal1.)Lind1.)又称花叶开唇兰、金丝草、金蚕、金不换、乌人参、金线入骨消等,是兰科开唇兰属的一种多年生草本植物。金线莲以全草入药,在民间被视为珍稀名贵药材,其药用价值倍受人们青睐,有“药王”之称。其味甘、性平,具有清热凉血、祛风利湿、强心利尿、固肾、平肝等功效[1-2]。多糖(polysaccharides)是生物体内普遍存在的一类生物大分子物质,广泛存在于动物、植物和微生物细胞中,具有抗肿瘤、抗病毒、降血糖、抗炎、抗氧化以及免疫调节等功能[3-4]。Hsieh等研究表明金线莲水提物能够调节炎症细胞浸润和过敏反应及调节T细胞亚群等[5];Yang等研究发现金线莲水提物可以防止骨质流失[6]和益生肠道菌群的作用[7];Cui等研究表明金线莲水提物具有降血糖[8]、抗肿瘤以及免疫调节活性[9];刘青等通过试验证明金线莲多糖在体外试验中有清除自由基及抗氧化作用[10]。综上所述,金线莲广泛的药理活性很可能与其高含量的多糖有关。林丽清等研究表明金线莲粗多糖生药量为37.45%[11]。目前已有许多关于金线莲多糖提取工艺研究[12-13],如赵保发等以乙醇回流过的药渣为材料,分别用响应面法和正交试验法对金线莲多糖提取工艺进行研究[13];李德华等以金线莲水溶性多糖含量为指标,用正交试验法对煎煮过程中水的用量、浸提时间、提取次数进行考察[14]。但考虑到煎煮过程中高温对多糖会有一定的破坏作用,且从金线莲全草中提取金线莲多糖工艺研究鲜有报道,因此,对金线莲多糖提取工艺进行研究具有重要的意义。该研究拟以金线莲全草为试验对象,以粗多糖提取率作为评价指标,采用正交试验设计从浸提温度、浸提时间、料液比3个方面优化金线莲多糖的提取工艺,为金线莲多糖的进一步开发利用提供数据借鉴。
1 材料与方法
1.1 材料
1.1.1 试剂。金线莲(购自福建南靖),D-葡萄糖标准品(购自福建省药检所),无水乙醇、丙酮、乙醚、苯酚、浓硫酸等均为国产分析纯。
1.1.2 仪器。电子天平(梅特勒-托利多仪器上海有限公司);纯水机(Milli-Q);数显恒温水浴锅(国华电器有限公司);SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);旋转蒸发器(上海亚荣生化仪器厂);恒温水浴锅(上海亚荣生化仪器厂);冷冻离心机ALLEGRA X-22R(Beckman,USA);TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);真空干燥箱(上海一恒科学仪器有限公司)。
1.2 方法
1.2.1 金线莲多糖提取工艺。金线莲全草→干燥→粉碎→蒸馏水浸提→抽滤→浓缩→醇沉→离心→复溶→多糖溶液(供试样品)。
1.2.2 金线莲多糖提取。精确称取金线莲粉末1.0 g于锥形瓶中,加入一定体积的蒸馏水,置水浴锅中,浸提一定时间后抽滤,残渣用少许蒸馏水洗涤2次,合并滤液,旋转蒸发仪浓缩至100 ml,取2 ml加入8 ml无水乙醇,过夜,离心(3 000 r/min,15 min),沉淀用蒸馏水复溶后于100 ml容量瓶中定容,得金线莲多糖供试溶液。
1.2.3 金线莲粗多糖提取率的测定。金线莲多糖的测定采用苯酚—硫酸法[15]。
1.2.3.1 苯酚溶液的配制。取苯酚5.0 g,溶于一定体积的水中,并定容至100 ml棕色容量瓶中,摇匀,即得5%苯酚溶液,转移至棕色瓶中避光,冷藏。
1.2.3.2 葡萄糖标准溶液的配制。将100 mg的D-葡萄糖标准品加蒸馏水溶解,并定容于100 ml容量瓶中,得浓度为1 mg/ml的葡萄糖标准溶液。
1.2.3.3 葡萄糖标准曲线的制作。分别取1 mg/ml葡萄糖标准溶液 1、2、3、4、5、6、7、8 ml于100 ml容量瓶中,蒸馏水定容。精密吸取蒸馏水或上述供试液2.0 ml于试管中,分别加入5%苯酚溶液1.0 ml,摇匀,沿管壁迅速加入浓硫酸5.0 ml,混匀,置沸水浴中加热15 min。冷却至室温后,在490 nm波长处测吸光度,以吸光度(y)为纵坐标、葡萄糖浓度(x)为横坐标进行线性回归分析,得出回归方程,并做出标准曲线[16-17]。
1.2.3.4 金线莲多糖提取率的计算。金线莲多糖提取率=100%。
1.2.4 单因素试验。浸提温度采用 60、70、80、90、100 ℃ 5个水平,浸提时间采用1、2、3、4、5 h 5个水平,料液比采用1∶10、1∶20、1∶30、1∶40、1∶50 分别进行单因素试验。
1.2.5 正交试验[18]。在上述单因数试验的基础上,选定三因素三水平作正交试验,优选出金线莲水溶性多糖提取的最佳工艺。
2 结果与分析
2.1 葡萄糖标准曲线 从图1可以看出,葡萄糖在490 nm处,10~70 μg/ml范围内与吸光度呈良好的线性关系,拟合方程为 A=0.013 9C -0.014 4,相关系数 R2=0.998 7。
2.2 单因素对多糖提取率的影响
2.2.1 浸提温度对金线莲多糖提取率的影响。从不同浸提温度对金线莲粗多糖提取率的影响(图2)可以看出,60~90℃间随着温度的升高,金线莲粗多糖的得率不断增加,在90℃时达最大,但在100℃时又略有下降,故浸提温度以90℃为宜。
2.2.2 浸提时间对金线莲多糖提取率的影响。从图3可以看出,浸提时间在1~4 h时,金线莲多糖的提取率逐渐增高,在4 h时金线莲多糖的提取率最高,在5 h时略有下降。说明浸提时间并不是越久越好,且以4 h为宜。
2.2.3 料液比对金线莲多糖提取率的影响。由料液比对金线莲多糖提取率的影响(图4)可见,料液比在1∶20时多糖提取率最高,为最适料液比。
2.3 正交试验设计优化金线莲粗多糖提取工艺 在上述单因素试验的基础上,浸提温度、浸提时间和料液比3个因素各选取3个水平制定因素水平表(表1)。按此正交表安排试验,以多糖得率作为衡量提取效率的指标,对金线莲多糖的提取工艺进行优化。为了提高试验的可靠性,每一条件下均做重复试验3次(n=3),测定结果取其平均值供统计分析用。

表1 正交试验因素水平表
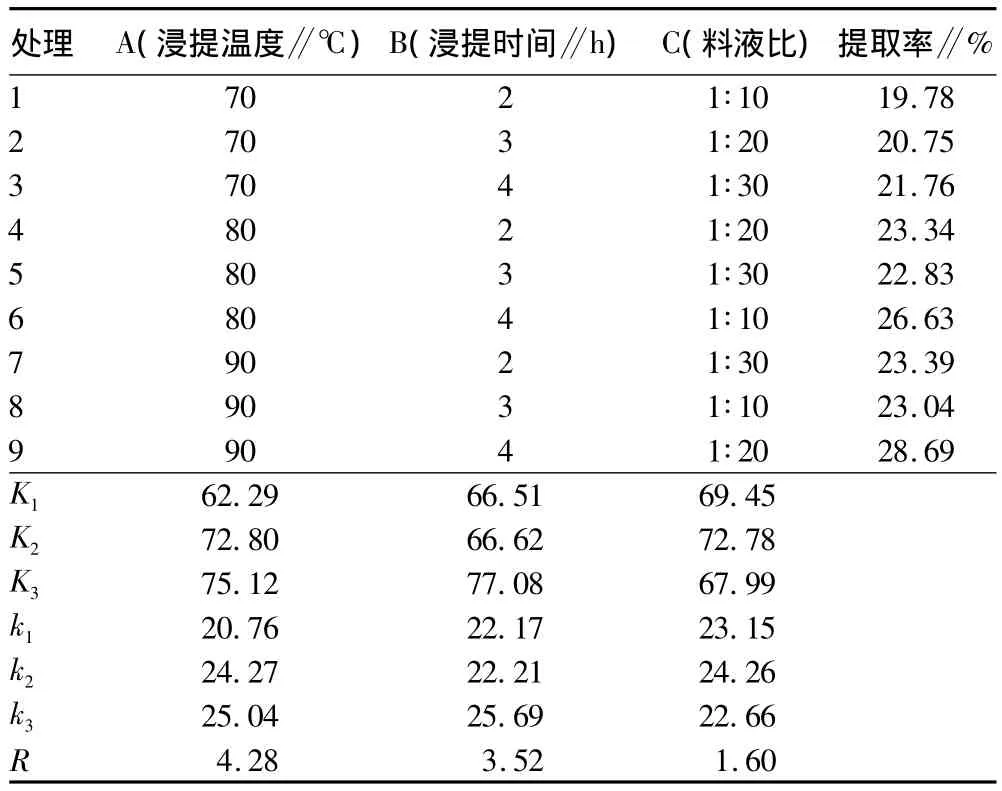
表2 正交试验结果及分析
正交试验极差分析(表2)显示,3个因素对金线莲多糖提取率影响的主次顺序为浸提温度>浸提时间>料液比,金线莲多糖提取的最佳工艺为浸提温度90℃、浸提时间4 h、料液比1∶20;验证试验显示,在此条件下,3次试验的提取率平均值为28.47%。
由正交试验的方差分析结果(表3)可见,温度对金线莲多糖提取率的影响差异性显著,且影响最大,其次是浸提时间,这与上述的极差分析结果一致。时间和料液比对金线莲多糖提取率的影响不大,差异不显著。
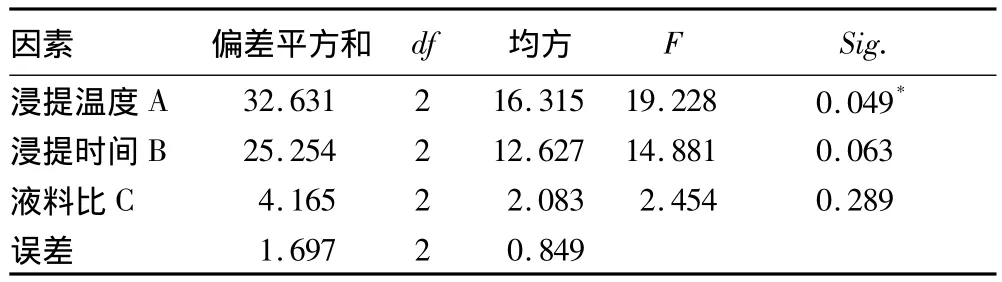
表3 正交试验方差分析
3 结论与讨论
单因素试验结果表明,对浸提温度进行考察发现,随着温度的增高,金线莲粗多糖的得率呈上升趋势,在90℃时达最大,但在100℃时又略有下降,可能是由于高温破坏了部分多糖的结构,从而使金线莲粗多糖提取率下降,故浸提温度以90℃为宜;对浸提时间进行考察发现,浸提时间在1~4 h时,金线莲粗多糖的提取率逐渐增高,而在5 h时略有下降,说明浸提时间并不是越久越好,且以4 h为宜;对料液比进行考察发现,料液比在1∶20时多糖提取率最高,表明水过多或过少均会影响多糖的溶出,故料液比以1∶20为宜。
正交试验结果表明,金线莲多糖提取的最佳工艺条件为浸提温度90℃、浸提时间4 h、料液比1∶20;验证试验显示,在此条件下,3次试验的提取率平均值为28.47%。这与单因素试验结果一致,证明试验结果可靠。通过该试验的研究,优化了金线莲多糖的提取工艺,不仅提高了金线莲原材料的利用率,也为金线莲多糖生理活性方面的研究奠定了基础,具有十分重要的意义。
此外,此次试验所测得的金线莲粗多糖的提取率较某些文献中报道的提取率偏高[19-22]。这与金线莲的产地、培养时间等不同有关。陈晓兰等研究表明不同产地金线莲根茎和叶中多糖的含量有所不同[19]。黄瑞平等研究发现不同月龄金线莲多糖的含量有所不同[20];金线莲在移栽培养5个月时,多糖含量最高[21];组培金线莲样品中的多糖远高于野生金线莲样品[22];林丽清等研究表明金线莲粗多糖生药量为37.45%,精制金线莲多糖生药量也可达 27.14%[11]。
[1]张红艳,潘馨.金线莲化学成分及药理活性研究进展[J].海峡药学,2009,21(1):82 -84.
[2]王建明,王松良,詹巧杰,等.金线莲组织培养的条件优化研究[J].中国现代中药,2013,15(1):45 -49.
[3]方积年,丁侃.天然药物——多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007(5):338 -347.
[4]聂少平,黄丹菲,殷军艺,等.食物中多糖组分的结构表征与活性功能研究进展[J].中国食品学报,2011(9):46 -57.
[5]HSIEH C C,HSIAO H B,LIN W C.A standardized aqueous extract of Anoectochilus formosanus modulated airway hyperresponsiveness in an OVA-inhaled murine model[J].Phytomedicine,2010,17:557 -562.
[6]YANG L C,WU J B,LU T J,et al.The prebiotic effect of Anoectochilus formosanus and its consequences on bone health[J].British Journal of Nutrition,2013,109:1779 -1788.
[7]YANG L C,LIN W C,LU T J.Characterization and prebiotic activity of aqueous extract and indigestible polysaccharide from Anoectochilus formosanus[J].Journal of Agricultural And Food Chemistry,2012,60:8590 -8599.
[8]CUI S H,YU J,ZHANG X H,et al.Antihyperglycemic and antioxidant activity of water extract from Anoectochilus roxburghii in experimental diabetes[J].Experimental and Toxicologic Pathology,2013,65:485 -488.
[9]TSENG C C,SHANG H F,WANG L F,et al.Antitumor and immunostimulating effects of Anoectochilus formosanus Hayata[J].Phytomedicine,2006,13:366 -370.
[10]刘青,刘珍伶,周娟.金线莲多糖的体外抗氧化活性[J].华侨大学学报:自然科学版,2010(6):718 -720.
[11]林丽清,黄丽英,钟添华,等.金线莲多糖的分离纯化与含量测定[J].中国医院药学杂志,2007,27(8):1037 -1039.
[12]余杰,崔仕超,张晓辉,等.响应面分析法优化金线莲多糖提取过程的研究[J].汕头大学学报:自然科学版,2009,24(4):55 -60.
[13]赵保发,张志信.金线莲多糖提取工艺的研究[J].云南师范大学学报:自然科学版,2008,28(4):60 -63.
[14]李德华,黄巧文.金线莲多糖提取工艺研究[J].海峡药学,2007,19(6):26 -27.
[15]贺寅,王强,钟葵.响应面优化酶法提取龙眼多糖工艺[J].食品科学,2011(2):79-83.
[16]李粉玲,蔡汉权,林杰.超声波法提取凤凰茶多糖的研究[J].中国酿造,2011(10):104-107.
[17]常泽,申湘忠.超声波法提取甜瓜多糖的工艺研究[J].江苏农业科学,2011,39(3):398 -400.
[18]李巧云,居红芳,翟春.五味子粗多糖提取工艺的研究[J].食品科学,2004,25(5):105 -109.
[19]陈晓兰,黄丽英,黄丽萍,等.不同产地金线莲根茎和叶中多糖含量对比[J].分析测试技术与仪器,2012,18(3):135 -139.
[20]黄瑞平,黄颖桢,陈菁瑛,等.不同月龄金线莲多糖和总黄酮含量的比较[J].热带生物学报,2012,3(2):174 -176.
[21]蒋元斌,李健,马玉芳,等.福建金线莲和台湾金线莲不同采收期多糖的变化[J].福建农林大学学报:自然科学版,2014(2):124-127.
[22]龚秀会,许敏,董鸿竹,等.不同基原金线莲植物的化学成分比较研究[J].安徽农业科学,2012,40(36):17530 -17531,17607.
