3个芍药品种对低温的生理响应及抗寒性评价
2015-12-22于晓南
王 琪,于晓南
(1.天津城建大学建筑学院,天津300384;2.北京林业大学园林学院,北京100083;3.国家花卉工程技术研究中心,北京100083)
芍药(Paeonia lactiflora Pall.)为芍药科芍药属的多年生宿根草本植物,是我国的传统名花,其品种多样,花色各异,在寒冷地区的园林应用中具有良好前景。
目前,关于芍药属植物抗寒性方面的研究多集中于牡丹组,而对芍药的抗寒生理研究存在大量空白。金研铭等[1]对由菏泽引种至沈阳的7个牡丹品种进行抗寒性分析,认为电导法、牡丹体内的束缚水含量及束缚水/自由水比值都能很好地鉴别不同品种的抗寒性。岳桦等[2]对引入黑龙江地区的10个紫斑牡丹品种在自然越冬期间的相对电导率、丙二醛含量等生理生化指标进行研究,发现10个品种经过低温锻炼后,丙二醛含量和可溶性糖含量呈不同程度的增加。鞠志新[3]以牡丹组3个品种群的12个品种为试材进行自然越冬和人工模拟低温胁迫试验,发现越冬期间枝条的脯氨酸含量、可溶性多糖含量、生长期叶片膜透性(相对电导率)可以作为牡丹抗寒性的参考指标。
以3个芍药品种的地下芽与根为试材,笔者测定了不同低温条件下它们的相对电导率、丙二醛等生理指标,利用主成分分析和隶属函数法对3个芍药品种的抗寒性进行排序和科学评价,为寒冷地区引种和生产应用提供理论基础。
1 材料与方法
1.1 试验材料 选用北京市小汤山国家花卉工程技术研究中心苗圃自2009年引种栽培以来生长正常的3个芍药品种,即‘粉玉奴’、‘Monsieur Jules Elie’和‘Pink Hawaiian Coral’。在2011年10月,将已去除地上部分的各品种芍药从原苗圃中挖出并清洗、分株,每株有5~8个强壮的地下芽,并将根修剪至15~20 cm长,去除小根、烂根等。选择生长一致的芍药,每个品种30株,种植于小汤山苗圃的同一地块中,种植深度(坑深)在25~30 cm间。各植株在自然条件下冷藏至12月中旬(日平均气温稳定在0℃左右)。每个品种随机选择9株,且小心挖出,从每株芍药上采集3个地下芽(自芽的根部切下),另外自根尖起切取最大直径在1.5 cm左右、长5 cm的根,每株采取3条根,采后用锡箔纸分别包封好,立即回到实验室进行处理。用流水将地下芽和根冲洗干净后,再用去离子水漂洗3遍,并用滤纸吸干水分。每个品种随机选择21个地下芽和21条根,将各品种的试验材料均分成7份后分别放入自封塑料袋中进行不同温度的低温胁迫处理。
1.2 试验设计与方法 降温仪器选择奥地利SY-LAB公司生产的IceCube 14S型号程控降温仪。以仪器内部温度4℃为起始,将试验材料放入仪器。以0.02℃/min的速度下降,下降到0℃后保持5 h,然后每个品种取出1份;仍以0.02℃/min的速度降温,下降到-6℃后保持5 h;每个品种再各取出1份,以此类推。试验设置处理温度梯度为0、-6、-12、-18、-24、-30、-36 ℃。在取出的试验材料中,将各品种的地下芽分别放入4℃冰箱中解冻8 h后再取出,用于测定相对电导率;将根贮藏于液氮中,用于测定丙二醛含量、可溶性糖含量、脯氨酸含量、可溶性蛋白含量、SOD活性。
1.3 指标测定与计算
1.3.1 地下芽的质膜相对透性测定。质膜相对透性一般采用电导率法测定。电导率法作为鉴定植物抗寒性的主要方法之一,其用于根系测定时误差往往较大[4]。芍药不同于同科的牡丹等木本植物,在自然环境下越冬时只存留肉质根和地下芽两部分。芍药的地下芽与其第2年的生长息息相关,并且受年龄、切片厚度等的影响较小。因此,该试验采用地下芽进行相对电导率的测定。
从4℃冰箱中取出各芍药品种的地下芽,分别将芽层层剥开,弃掉芽根部的附属物和最外层鳞片,用滤纸擦干、切碎混匀后测定相对电导率[5]。
1.3.2 根的生理指标测定。芍药根的丙二醛(MDA)含量采用硫代巴比妥酸(TBA)显色法测定;可溶性糖含量采用蒽酮比色法测定;脯氨酸含量采用酸性茚三酮显色法测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定[5-6]。
1.4 数据处理 利用SPSS18.0软件进行3个芍药品种抗寒生理指标平均值、标准差、各品种间统计学差异的计算以及各指标的相关性分析、主成分分析。利用隶属函数法对3个芍药品种的抗寒性进行综合评价[7]。
2 结果与分析
2.1 低温胁迫下地下芽的相对电导率变化 由表1可知,随着温度的下降,除了‘Pink Hawaiian Coral’地下芽的相对电导率以-6℃为转折点呈现先小幅下降再升高,其他2个品种的相对电导率都一直呈升高的趋势,并且从低温胁迫开始,各品种的相对电导率变化逐渐加快,而随着温度的进一步降低,相对电导率的变化逐渐变缓,差异也逐渐不显著。这与绝大多数植物在低温胁迫条件下相对电导率所呈现的“S”型曲线趋于一致。

表1 低温胁迫下3个芍药品种地下芽的相对电导率%
2.2 低温胁迫下根的生理变化 丙二醛作为细胞膜脂过氧化的最终产物,被认为可以反映植物在冷应激条件下的生理状态。由图1可知,随着温度的下降,‘粉玉奴’与‘Pink Hawaiian Coral’丙二醛含量都呈先增加再减少然后增加的变化趋势,而‘Monsieur Jules Elie’则呈现“M”型的双峰现象。除‘Monsieur Jules Elie’的丙二醛含量在-24℃达到最高值外,其他2个品种则都在-36℃达到峰值。
由图2可知,随着温度的下降,3个芍药品种根的可溶性糖含量变化较复杂,但是总体上都呈增加的趋势。可溶性糖的积累对植物抗寒有重要作用,由此可知‘Monsieur Jules Elie’的抗寒能力相对较强。
脯氨酸的积累有助于增强植物的抗性。由图3可知,3个芍药品种根的脯氨酸含量在0~-18℃的降温过程中都有所下降。随着温度下降到-30~-36℃,除‘Pink Hawaiian Coral’外,其他2个品种的脯氨酸含量都有所上升,但与0℃时相比仍然较低。
由图4可知,‘Monsieur Jules Elie’可溶性蛋白含量以-6℃为转折点呈现出先减少再增加的趋势,‘粉玉奴’和‘Pink Hawaiian Coral’的可溶性蛋白含量则随温度的下降呈先升高再降低然后升高的趋势。尽管3个品种的可溶性蛋白含量变化表现不一,但经过低温胁迫后均有所增加。
超氧化物歧化酶一直被认为是植物保护膜结构的主要抗氧化剂之一,其活性的提高可以减少逆境对植物的伤害。由图5可知,3个芍药品种根的超氧化物歧化酶活性均随着温度的下降而呈先升高再降低然后升高的趋势,并且均在-12℃达到各自的超氧化物歧化酶活性最高值。
2.3 不同芍药品种的抗寒性综合评价 一些研究已经证实,相对电导率与植物的抗寒性呈相关性。当植物在经受低温胁迫时,植物的抗寒性越差,其相对电导率越高[8-10]。因此,首先通过对不同低温下6个抗寒指标的相关性进行分析,再将与相对电导率在0.05水平和0.01水平相关的指标提取出来用于主成分分析,最后利用隶属函数法对3个芍药品种的抗寒性进行综合评价。
2.3.1 抗寒指标的相关性分析。对3个芍药品种的各项抗寒生理指标进行简单相关分析。由表2可知,相对电导率与丙二醛含量、可溶性糖含量和可溶性蛋白含量均呈显著正相关(P≤0.01),与脯氨酸含量、超氧化物歧化酶活性则呈显著负相关(P≤0.01);其他指标间也呈现一定的相关性。由此可见,各指标间所提供的信息会有一定的重叠和疏漏,用多个生理指标进行抗寒性综合评价是必要的。

表2 3个芍药品种的抗寒指标相关性分析
2.3.2 抗寒指标权重的确定。根据相关性分析的结果,对与相对电导率极显著相关的可溶性糖含量、可溶性蛋白含量、脯氨酸含量、丙二醛含量和超氧化物歧化酶活性5个生理指标进行主成分分析。根据表3中各指标的贡献率确定权重,结果见表4。
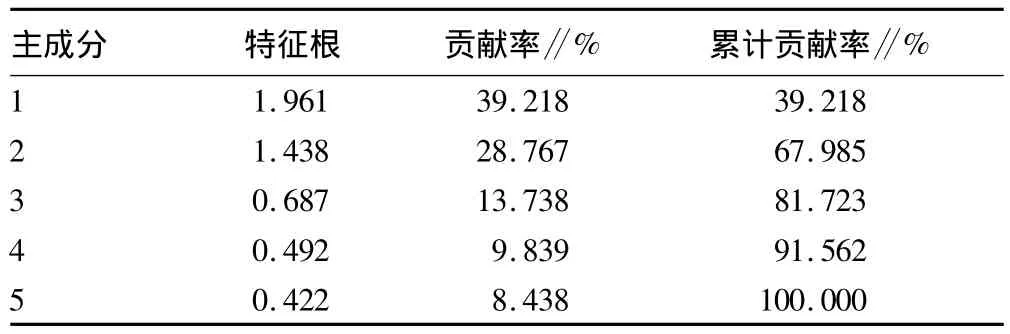
表3 3个芍药品种抗寒性指标的特征根及相应贡献率
2.3.3 抗寒指标的隶属度及综合指数值。根据3个芍药品种抗寒性相关指标的隶属度值(表5),再对各指标进行合成,计算出3个芍药品种的抗寒性综合指数(表6)。根据表中抗寒性综合指数的大小,得出3个芍药品种的抗寒性强弱排序为‘Monsieur Jules Elie’>‘粉玉奴’>‘Pink Hawaiian Coral’。

表4 3个芍药品种抗寒性指标的负荷量和权重
3 结论与讨论
研究表明,低温胁迫引发了芍药体内一系列的生理生化反应。以3个芍药品种地下芽的相对电导率与根的5个生理指标之间的相关性为基础,通过提取相关性较强的指标进行主成分分析,结合隶属函数法,最终对3个芍药品种的抗寒性进行比较。根据综合指数,可知‘Monsieur Jules Elie’抗寒性最强,‘粉玉奴’次之,‘Pink Hawaiian Coral’最弱。

表5 3个芍药品种抗寒性指标的隶属度值
‘Pink Hawaiian Coral’地下芽的相对电导率从0℃到-30℃几乎始终与其他2个品种有显著差异(P≤0.05),并且在-24℃时率先达到50%,可以推测其抗寒能力比其他2个品种更弱。在冷驯化过程中一些植物相容性物质的积累被认为是其自身的一个低温保护机制[11-12]。丙二醛、可溶性碳水化合物、蛋白质和游离脯氨酸可能参与降低细胞液冰点、预防由冻害引发细胞脱水所造成的质壁分离等活动[13-14]。研究还表明,3个芍药品种根的可溶性糖含量和可溶性蛋白含量随着温度的降低大致呈增加趋势,其中各芍药品种根的可溶性蛋白含量变化不一致。这与任丽[15]对4个牡丹品种根的研究结果相一致,说明芍药属植物肉质根的可溶性蛋白含量随温度降低的变化规律不明显。脯氨酸含量则与大部分植物抗寒性结果不同。研究表明,脯氨酸含量与植物体内溶液的渗透势密切相关[16]。额外产生的脯氨酸可以提高植物的抗渗透胁迫[17],但渗透调节并不只依赖一种物质完成。除了脯氨酸,它还可能涉及其他有机相容物质和诸如K+一类的无机离子[18]。与在植物体的其他器官作用相比,该机制在根的作用更加复杂。艾琳等[19]就发现5个葡萄品种根系的脯氨酸含量随温度的降低而下降。芍药具有变态的肉质根,从0℃至-18℃的各芍药品种根的脯氨酸含量下降很可能是由各种原因综合造成的。由于迄今为止人们对芍药根的生理生化研究较少,这种现象的具体作用机制还有待进一步研究。一般认为,通过增加SOD活性可以加强保护细胞膜结构的作用。试验中的‘Pink Hawaiian Coral’和‘粉玉奴’的SOD活性一直较低,可以推测出二者的抗氧化系统较弱,抵御胁迫能力较差。

表6 3个芍药品种抗寒性综合指数和排名
前人的研究结果表明,从国外引种的芍药切花品种(包括试验中的‘Monsieur Jules Elie’和‘Pink Hawaiian Coral’)在北京的气候条件下均可以正常生长、开花,并且保持较高的观赏价值[20-21]。孙菊芳等[22]从美国引种栽培 13个芍药与牡丹的组间杂种,发现它们可以在北京的气候条件下正常生长。但是,研究中作为组内亚组间杂种后代品种的‘Pink Hawaiian Coral’是3个品种中抗寒性最差的,其亲本为Paeonia lactiflora‘Charlie's White’× P.peregrina‘Otto Froebel’,其中P.peregrina主要分布于欧洲东部和土耳其,比中国芍药分布的气候带偏南。这可能是其杂交后代不如中国芍药品种群耐寒的原因之一。另外,尽管杂种优势是影响植物抗性的一个重要因素,但抗寒性还与植物遗传性、环境作用、植物株龄等多种因素有关。
[1]金研铭,徐惠风,李亚东,等.牡丹引种及其抗寒性的研究[J].吉林农业大学学报,1999,21(2):37 -39.
[2]岳桦,李欣,任丽,等.不同紫斑牡丹品种抗寒性差异分析[J].东北林业大学学报,2009,37(5):62 -63.
[3]鞠志新.东北地区牡丹生态适应性及抗寒性研究[D].北京:北京林业大学,2011.
[4]李丙智,文建雷,张建平,等.电导法测定葡萄根系抗寒性方法的探讨[J].西北林学院学报,1993,8(3):105 -108.
[5]孔祥生,易现峰.植物生理学实验技术[M].北京:中国农业出版社,2008.
[6]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[7]王琪,于晓南.3种彩叶树对低温的生理响应及抗寒性评价[J].北京林业大学学报,2013,35(5):104 -109.
[8]董丽,黄亦工,贾麦娥,等.北京园林主要常绿阔叶植物抗冻性及其测定方法[J].北京林业大学学报,2002,24(3):70 -73.
[9]崔红,于晶,高秀芹,等.3个紫斑牡丹品种的抗寒生理特性研究[J].东北农业大学学报,2009,40(7):24 -27.
[10]赵雪梅,成仿云,唐立红,等.赤峰地区紫斑牡丹的引种与抗寒性研究[J].北京林业大学学报,2011,33(2):84 -90.
[11]ALBERDI M,CORCUERA L J.Cold acclimation in plants[J].Phytochemistry,1991,30:3177 -3184.
[12]LIVINGSTON D P.The second phase of cold hardening:freezing tolerance and fructan isomer changes in winter cereal crowns[J].Crop science,1996,36:1568 -1573.
[13]SAKAI A,LARCHER W.Frost survival of plants:Responses and adaptation to freezing stress[M].Berlin:Springer Verlag,1987.
[14]SANTARIUS K A.Freezing of isolated thylakoid membranes in complex media.VIII.Differential cryoprotection by sucrose,proline and glycerol[J].Physiologia plantarum,1992,84:87 -93.
[15]任丽.十种中原牡丹引种哈尔滨地区抗寒性研究[D].哈尔滨:东北林业大学,2009.
[16]CHU T M,ASPINALL D,PALEG L G.Stress metabolism.Ⅵ.Temperature stress and the accumulation of proline in barley and radish[J].Australian journal of plant physiology,1973,26:319 -327.
[17]KAVI K P B,HONG Z,MIAO G H,et al.Overexpression of 1-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants[J].Plant physiology,1995,108:1387 -1394.
[18]王宝山,赵可夫,邹琦.作物耐盐机理研究进展及提高作物抗盐性的对策[J].植物学通报,1997,14(S1):25 -30.
[19]艾琳,张萍,胡志成.低温胁迫对葡萄根系膜系统和可溶性糖及脯氨酸含量的影响[J].新疆农业大学学报,2004,27(4):47 -50.
[20]姚苗笛.芍药切花品种引种及繁殖研究[D].北京:北京林业大学,2009.
[21]于晓南,宋焕芝,王琪.北美新芍药品种引种适应性初报[J].林业实用技术,2011(12):50-51.
[22]孙菊芳,成仿云.芍药与牡丹组间杂种引种栽培初报[J].中国园林,2007(5):51-54.
