白酒酿造过程中塑化剂来源分析
2015-12-21马荣山王凤兰颜廷才
马荣山,韩 营,王凤兰,颜廷才,*,张 旋,蒋 玲
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.朝阳市食品药品监督管理局,辽宁 朝阳 122000;3.沈阳科新工程咨询有限公司,辽宁 沈阳 110012)
白酒酿造过程中塑化剂来源分析
马荣山1,韩 营1,王凤兰2,颜廷才1,*,张 旋1,蒋 玲3
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.朝阳市食品药品监督管理局,辽宁 朝阳 122000;3.沈阳科新工程咨询有限公司,辽宁 沈阳 110012)
为探明白酒在酿造过程中的塑化剂来源,采用气相色谱-质谱联用方法测定白酒酿造的主要原料及各个阶段产物的16 种邻苯二甲酸酯类物质的含量。结果表明,16 种邻苯二甲酸酯类物质的平均回收率和精密度分别为84.5%~107.3%、2.9%~7.3%,方法检出限在0.06~1.3 μg/kg。3 个批次的样品只检出了邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二乙酯 (diethyl phthalate,DEP)、邻苯二甲酸二异丁酯(diisobutyl phthalate,DIBP)、邻苯二甲酸二丁酯(di-n-butyl phthalate,DBP)、邻苯二甲酸二-2-乙基己酯(dioctyl pathalate,DEHP)5 种塑化剂。DMP、DBP在大渣酒头、大渣原酒、小渣酒头、渣原酒、回糟原酒中含量明显多于其他阶段。大渣酿酒阶段产生微量的DMP、DBP,小渣酿酒阶段产生微量的DEHP,产生量均未超过0.09 mg/kg,可见白酒酿造过程中产生极微量的塑化剂,在不接触塑料制品的前提下白酒酿造过程中的塑化剂主要来源于原料。
塑化剂;白酒酿造;气相色谱-质谱;来源
塑化剂又称增塑剂,应用最广的是邻苯二甲酸酯类化合物(phthalate acid esters,PAEs),广泛用于塑料工业中,研究[1-5]表明,PAEs 具有雌激素的特征及抗雄激素生物效应,其毒性是三氯氰胺的20倍,会损伤人体的肾脏、肝脏、生殖器官,长期在体内积累还可能会导致畸形、癌症、突变等作用,对人体健康已经构成危害[6-10]。Kamendulis等[11]用猕猴、鼠类和人类的原代培养肝细胞株来研究邻苯二甲酸酯类对细胞缝隙链接通讯和过氧化酶体增殖的相对影响,实验表明,邻苯二甲酸酯类可以诱导啮齿动物产生肝肿瘤。Pogribny等[12]研究发现,对饲养中的雄性大鼠喂食邻苯二甲酸二-2-乙基己酯(dioctyl pathalate,DEHP)后,会引起大鼠体内过氧化物酶体的增生,新陈代谢改变等,诱导肿瘤形成和肝细胞发生癌变。Saillenfait等[13]研究发现PAEs可引起大鼠胚胎生长缓慢,对胚胎有致畸作用。白酒行业的“塑化剂”事件更是引起了消费者的极大恐慌及关注。我国卫生部已将PAEs列入第六批“食品中可能违法添加的非食用物质”黑名单,并规定食品和食品添加剂中邻苯二甲酸二丁酯(di-n-butyl phthalate,DBP)、DEHP和邻苯二甲酸二异壬酯(diisononyl phthalate,DINP)的最大残留量分别为0.3、1.5 mg/kg和9.0 mg/kg[14]。近年来,与塑料接触的油、肉、水、酒中均检测出了PAEs[15-19]。关于白酒中PAEs的来源,有研究显示与塑料容器及塑料管道的接触会引起PAEs向白酒中迁移[20-21],但关于白酒酿造过程是否产生PAEs却鲜有研究。
本研究参考GB/T 21911—2008《食品中邻苯二甲酸酯的测定》[22]及相关文献的方法,采用气相色谱-质谱联用技术测定白酒酿造过程各部分产物中16 种PAEs的含量,探究白酒在酿造过程PAEs的来源。由于PAEs易溶于有机溶剂,在白酒中有很好的溶解性,测定前首先应除去酒精,本实验采用水浴的方法去除酒精,由于PAEs沸点很高在300 ℃左右,所以水浴去除酒精条件温和,不会造成PAEs损失。
1 材料与方法
1.1 材料与试剂
酿酒主要原料:高粱、大曲、稻壳、酿酒用水;大渣、大渣酒头、大渣原酒、大渣酒尾;小渣、小渣酒头、小渣原酒、小渣酒尾;回糟、回糟原酒;扔糟;均取自辽宁省建平县某酒厂。
16 种邻苯二甲酸酯混标溶液:邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二乙酯 (diethyl phthalate,DEP)、邻苯二甲酸二异丁酯(diisobutyl phthalate,DIBP)、DBP、邻苯二甲酸二(4-甲基-2-戊基)酯(bis(4-methyl-2-pentyl) phthalate,BMPP)、邻苯二甲酸二(2-甲氧基)乙酯(bis(2-methoxyethy) phthalate,DMEP)、邻苯二甲酸二戊酯(diamyl phthalate,DPP)、邻苯二甲酸二(2-乙氧基)乙酯(bis(2-ethoxyethyl) phthalate,DEEP)、邻苯二甲酸二己酯(di-n-hexyl phthalate,DHXP)、邻苯二甲酸丁基苄酯(butyl benzyl phthalate,BBP)、DEHP、邻苯二甲酸二(2-丁氧基)乙酯(bis(2-butoxyethl) phthalate,DBEP)、邻苯二甲酸二环己酯(dicyclohexyl phthalate,DCHP)、邻苯二甲酸二正辛酯(di-n-octyl phthalate,DNOP)、邻苯二甲酸二苯酯(diphenyl phthalate, DPhP)1 mL,质量浓度均为1 000 mg/L;正己烷(色谱纯)、丙酮(分析纯) 沈阳鼎国药业公司;实验用水均为超纯水。
1.2 仪器与设备
7890C-5975C气相色谱-质谱联用仪 美国安捷伦公司。
1.3 方法
1.3.1 标准曲线的制备
准确量取0.1 mL 1 000 mg/L混标溶液于10 mL 容量瓶中用正己烷定容配制成10 mg/L 中间液,分别取不同量的中间液配制成0.01、0.05、0.10、0.20、0.50、1.00、2.00 mg/L系列工作液,配制成的工作液储存于-10 ℃冰箱中。以PAEs的质量浓度为横坐标,特征碎片离子的峰面积为纵坐标,绘制标准工作曲线。
1.3.2 方法回收率与精密度
称取统一空白酒样,配成质量浓度为0.10、0.50 mg/L和1.0 mg/L的邻苯二甲酸酯混标溶液,每个质量浓度进行6次平行测定,计算方法回收率与精密度。
1.3.3 样品的提取
准确称取液体样品10.0 mL,于90 ℃水浴锅中除去酒精,加入4.0 mL正己烷,旋涡混匀1 min,静置分层,取上清液进行气相色谱-质谱分析。
准确称取固体样品5 g(其中高粱粉、大曲粉、稻壳(以干质量计算)、酒糟(以鲜质量计算))加适量水至50 mL振荡30 min摇匀(离心),取滤液25 mL加入5 mL正己烷,旋涡混匀1 min,静置分层,取上清液进行气相色谱-质谱分析。
1.3.4 色谱条件
色谱柱:DB-17MS 石英毛细管柱(30 m×250 μm,0.25 μm),载气为高纯氦气,流速1 mL/min,不分流进样,进样量为1 μL;进样口温度:250 ℃;色谱与质谱接口温度:280 ℃;升温程序:初始温度60 ℃,保持1 min,以20 ℃/min升温至220 ℃,保持1 min,再以5 ℃/min升温至280 ℃,保持5 min。
1.3.5 质谱条件
电离方式:电子电离源;检测方式:选择离子扫描模式;电离能量:70 eV;质量扫描范围:m/z 35~500,容积延迟时间:5 min。
2 结果与分析
2.1 定性分析
图1为0.2 mg/L标准样品16 种邻苯二甲酸酯类物质的总离子流图,16 种邻苯二甲酸酯类物质的保留时间、定量离子、定性离子及其丰度比见表1。
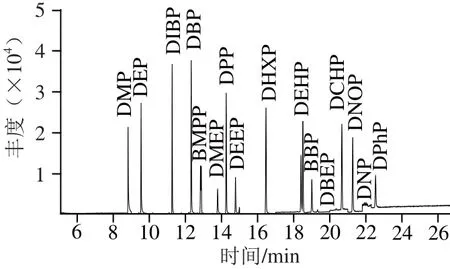
图1 标准样品中16 种邻苯二甲酸酯类物质的总离子流图Fig.1 Total lon chromatograms of 16 phthalate ester standards
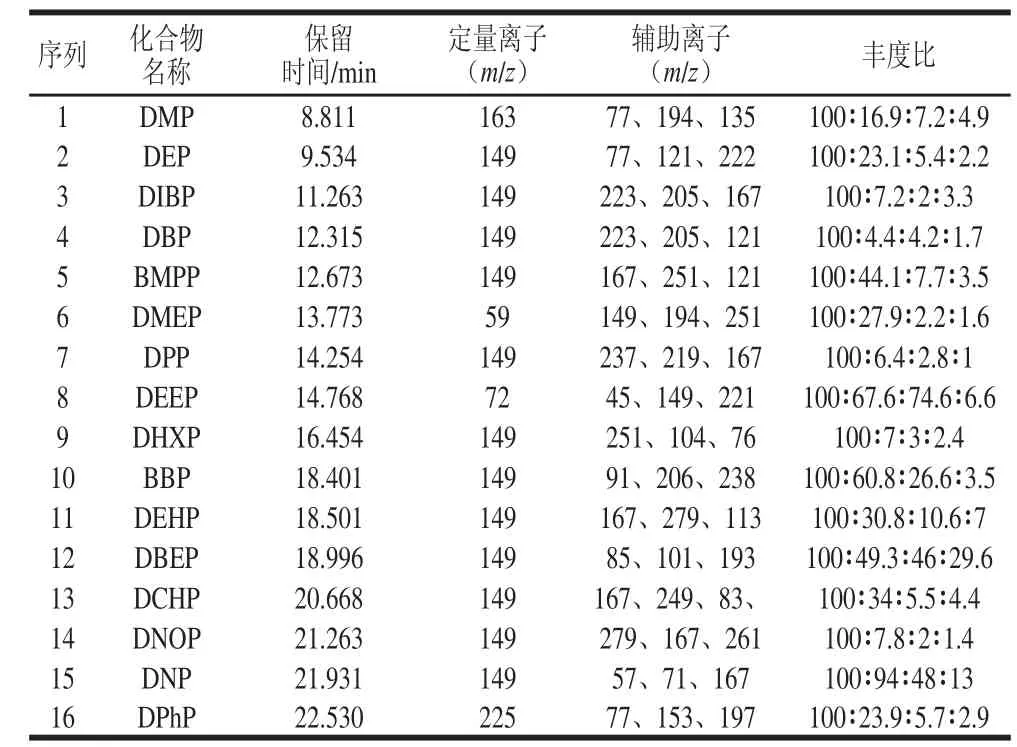
表1 16 种邻苯二甲酸酯的保留时间、定量离子、定性离子及其丰度Table1 Monitoring ions, retention times and abundance ratios of phthalate esteerrss
2.2 线性方程与方法检出限、定量限、回收率与精密度
在本实验条件下,以化合物质量浓度为横坐标,峰面积为纵坐标绘制标准曲线,各组分线性方程见表2。在质量浓度为0.01~2 mg/L范围内,各组分线性良好。方法检出限(RSN=3)、定量限(RSN=10)、回收率与精密度见表3。结果表明,平均回收率为84.5%~107.3%,相对标准偏差为2.9%~7.3%。
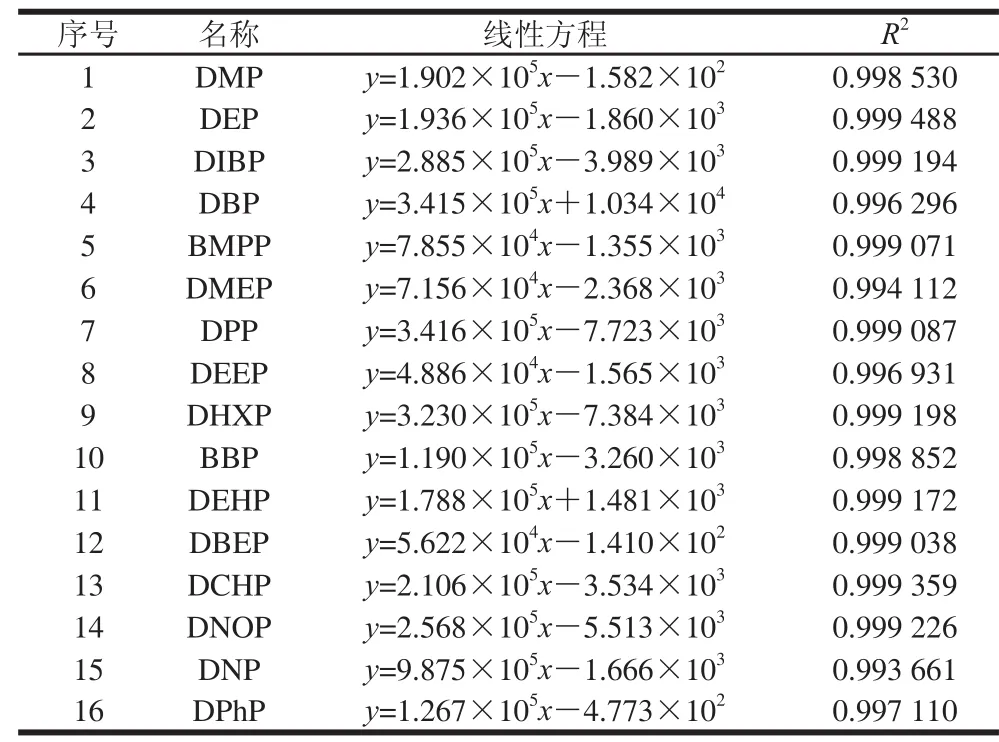
表2 16 种邻苯二甲酸酯类化合物线性方程、相关系数Table2 Linear equations with correlation coeffi cients for 16 phthalate esters
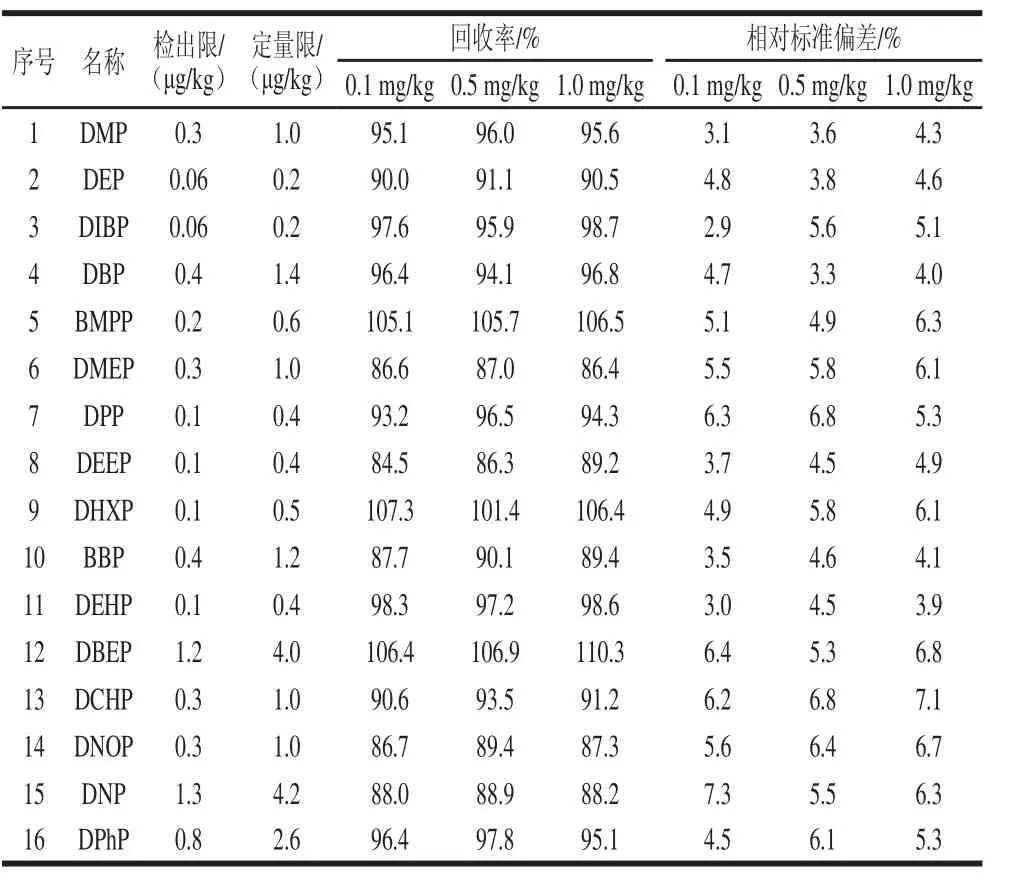
表3 方法检出限、定量限、回收率与精密度Table3 Limits of detection, limits of quantitation, spiked recoveries and relative standard deviation of the presented method
2.3 样品测定结果
2.3.1 浓香型大曲酒酿酒工艺
传统的酿酒工艺为老五甑工艺,见图2。
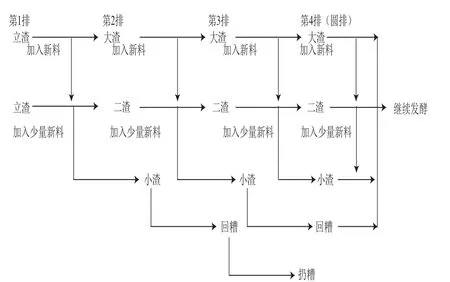
图2 老五甑工艺Fig.2 Flow chart of the traditional liquor manufacturing process “Laowuzeng”
操作要点如下:第1排:新料下窖蒸酒的称为第1排,根据甑桶的大小确定投料量,加入30%~40%填充物及约5 倍酒糟,蒸料冷却后加曲入窖发酵,立两渣料。第2排:将第1排两甑酒醅取出一部分,加入用料总数20%左右的新原料,配成一甑作为小渣,其余酒醅加入80%左右的原料配成两甑大渣,进行混烧。第3排:将第2排小渣不加新料蒸酒冷却,加曲做成回糟发酵。两甑大渣循环第2排操作,配成两甑大渣和一甑小渣。第4排:将上排的回糟酒醅,进行蒸酒后作为扔糟,两甑大渣和一甑小渣,按第3排操作配成四甑。以后按此方式循环操作,每天出窖加入新料后投入甑中为五甑料,其余四甑入窖发酵,一甑为扔糟[23]。
2.3.2 白酒酿造过程中PAEs变化趋势
按以上工艺的操作分别对酿酒主要原料:高粱、大曲、稻壳、酿酒用水以及同一批次不同发酵阶段的渣子、酒头、原酒、酒尾进行检测,进行3 个批次的检测,求取平均值。主要检出的为DMP、DEP、DIBP、DBP、DEHP五种塑化剂,其中DEP低于检测限,故本实验以DMP、DIBP、DBP、DEHP为分析对象进行研究。结果见表4和图3、4。
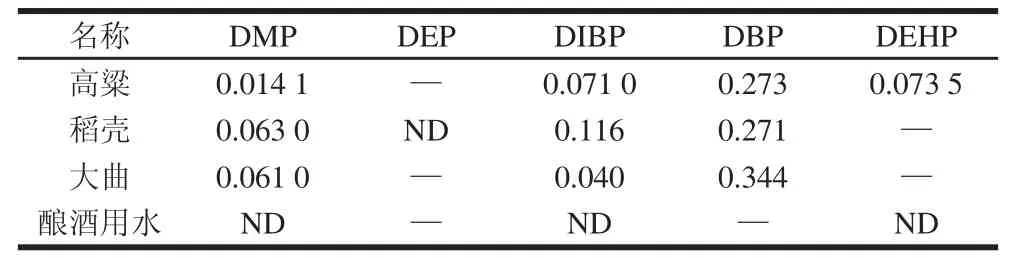
表4 酿酒主要原料中塑化剂含量Table4 Contents of phthalate acid esters in the main raw materials for producing liqquuoorr mg/kg
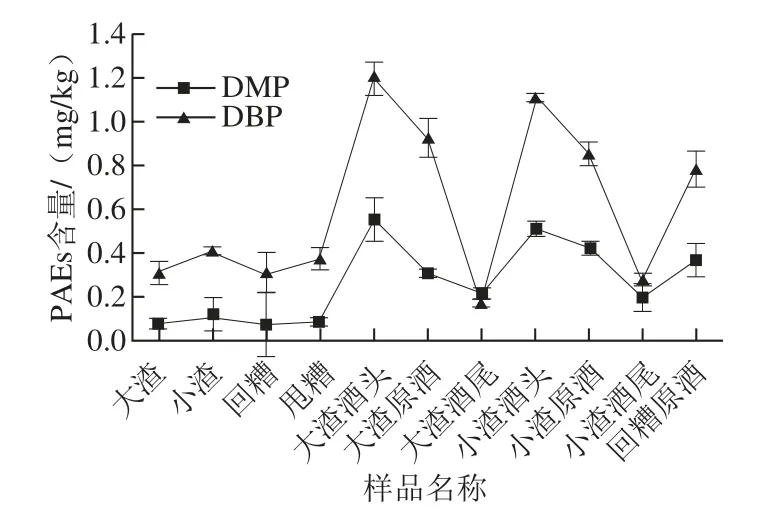
图3 样品中DMP、DBP含量变化趋势Fig.3 Changes in DMP and DBP contents of samples during the liquor manufacturing process
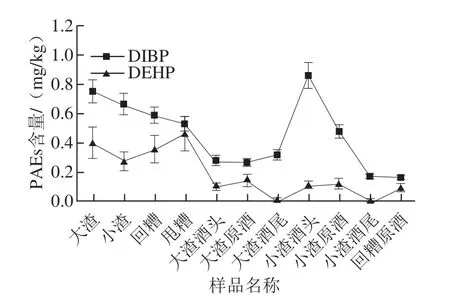
图4 样品中DIBP、DEHP含量变化趋势Fig.4 Changes in DMP and DBP contents of samples during the liquor manufacturing process
由表4可知,酿酒原料中均含有少量PAEs,其中大曲含DBP 0.344 mg/kg,已超过标准规定的0.3 mg/kg,由图3、4可以看出,在白酒酿造过程中DMP、DBP含量相对较多,且酒头、原酒中的含量明显高于其他部分,DBP在大渣酒头、小渣酒头的含量甚至超过标准的3~4 倍。PAEs易溶于乙醇致使随着乙醇的蒸出PAEs也随之蒸出,因而在酒头、原酒中PAEs含量高于酒尾。白酒酿造过程中有少量DIBP、DEHP存在均未超过0.1 mg/kg且变化范围不大。
2.3.3 白酒酿造过程中PAEs产生情况研究
酒厂实际酿酒过程中大渣和小渣的原料配比为大曲是高粱的25%,稻壳是高粱的30%,高粱与糟按1∶5配比,则在大渣、小渣中酒糟、高粱、大曲、稻壳的比为100∶20∶5∶6。回糟不配新料,加少量大曲,发酵蒸酒后为扔糟,1 000 kg回糟加25 kg大曲则回糟和大曲的比为40∶1。在接酒过程中,当酒厂实际操作酒精度数小于50°时即认为是酒尾,则此酒厂酒头、原酒、酒尾的比为1∶8∶20。酒厂实际出酒率为35%,0.5 kg高粱出0.175 kg酒,则蒸出的酒与剩余高粱的比为35∶65。根据高粱的量以及大渣、小渣中酒糟、高粱、大曲、稻壳的比可得蒸酒后剩余酒糟的量,最后算得酒和糟的比约为1∶12。由于大渣蒸酒后剩余的酒糟用来配小渣,则小渣按比例减去高粱、大曲、稻壳的量就是酒糟的量,同理小渣的糟配回糟,则回糟减去一定比例的大曲就是小渣蒸酒后剩余糟的量。酿酒过程中大渣、小渣含塑化剂分别参照公式(1)、(2)计算。由于公式前后都需要水且水中不含塑化剂或低于检出限,所以在计算过程中可忽略水。计算结果见表5。

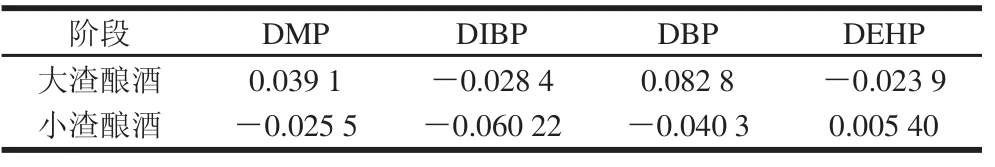
表5 白酒酿造过程含塑化剂情况Table5 PAE contents of liquor at different manufacturing stages mg/kg
白酒酿造过程产酒主要是大渣产酒和小渣产酒,回糟经过3 次发酵几乎没有多少可利用的淀粉,产生的酒很少,故不予考虑。从表5可以看出,大渣酿酒阶段产生极微量的DMP、DBP分别为0.039 1、0.082 8 mg/kg,小渣酿酒阶段产生极微量的DEHP为0.005 40 mg/kg,可见白酒原酒中的PAEs含量主要来源于原料。
3 结 论
建立气相色谱-质谱方法检测白酒酿造过程各个阶段产物及原料的16 种塑化剂含量,结果表明原料及各阶段只检出了DMP、DEP、DIBP、DBP、DEHP 5 种塑化剂,其中DEP低于检出限;DMP、DBP在大渣酒头、大渣原酒、小渣酒头、渣原酒、回糟原酒中含量较多,整个酿酒过程中检出微量DIBP、DEHP含量不超过0.1 mg/kg;白酒在大渣酿酒阶段产生微量的DMP、DBP,小渣酿酒阶段产生微量的DEHP,产生量均未超过0.09 mg/kg。可见白酒酿造过程中产生极微量的塑化剂,在不接触塑料制品的前提下白酒酿造过程中的塑化剂主要来源于原料,因此在生产白酒时一定要严把原料关。
[1] 刘红河, 黄晓群, 王晖, 等. 高效液相色谱-串联质谱法测定食品中邻苯二甲酸酯[J]. 现代预防医学, 2008, 35(1): 119-121.
[2] 赵亚辉, 王小逸, 林兴桃, 等. 邻苯二甲酸酯类化合物的体内代谢及毒性研究进展[J]. 环境与健康, 2010, 27(2): 184-186.
[3] 郭永梅. 邻苯二甲酸酯的毒性及相关限制法规[J]. 环境与健康, 2012, 37(2): 75-77.
[4] 王立鑫, 杨旭. 邻苯二甲酸酯毒性及健康效应研究进展[J]. 环境与健康杂志, 2010, 27(3): 276-278.
[5] 王红, 彭瑾, 朱宽正, 等. 白酒塑化剂危害及应对措施[J]. 中国卫生检验杂志, 2014, 24(4): 601-602.
[6] 张静, 陈会明. 邻苯二甲酸酯类增缩剂的危害及监管现状[J]. 现代化工, 2011, 31(12): 1-6.
[7] 沈霞红, 李冬梅, 韩晓冬. 邻苯二甲酸酯类胚胎生殖毒性研究进展[J].中国公共卫生, 2010, 26(9): 1115-1216.
[8] CHALES A S, DENNIS R D. The environmental fate of phtalate esters-a literature review[J]. Chemoshere, 1997, 35(4): 667-749.
[9] POSTER P M, MYLCHREEST E, CAIDO K W, et al. Effects of phthalate esters on the developing reproductive tract of male rats[J]. Hum Reprod Update, 2001, 7(3): 231-235.
[10] BONNI M, ERRANI E, ZERBINATI G, et al. Extraction and gas chromatographic evaluation of plasticizers content in food packaging fi lms[J]. Microchemical Journal, 2008, 90(1): 31-36.
[11] KAMENDULIS L M, ISENBERG J S, SMITH J H, et al. Comparative effects of phthalate monoesters on gap junctional intercellular communication and peroxisome proliferation in rodent and primate hepatocytes[J]. Journal of Toxicology and Environmental Health A, 2002, 65: 569-588.
[12] POGRIBNY I P, TRYNDYAK V P, BOUREIKO A, et al. Mechanisms of peroxisome proliferator induced DNA hypomethylation in rat liver[J]. Mutat Research, 2008, 644(1/2): 17-23.
[13] SAILLENFAIT A M, LANGONNE I, LEHEUP B. Effects of mono-nbutyl phthalate on the development of rat embryos: in vivo and in vitro observatons[J]. Pharmacol Toxicol, 2001, 89: 104-112.
[14] 卫生部. 卫生部办公厅关于通报食品及食品添加剂中邻苯二甲酸酯类物质最大残留量的函(卫办监督函(2011)511号)[S]. 2011.
[15] GUO Zhiyong, WANG Sui, WEI Dangyi, et al. Development and applicatin of a method for analysis of phthalate in ham sausages by solid-phase extraction and gas chromatography-mass spectractrometry[J]. Meat Science, 2010, 84(3): 484-490.
[16] 蔡艳, 赵家青, 贺小雨, 等. 食用油中邻苯二甲酸酯和己酸酯的GC-MS定量分析与迁移特性研究[J]. 食品科学, 2014, 35(12): 191-195. doi: 10.7506/spkx1002-6630-201412039.
[17] 章勇, 张蓓蓓, 赵永刚, 等. 液相色谱/串联质谱法测定水中邻苯二甲酸酯类化合物[J]. 分析实验室, 2014, 33(3): 303-307.
[18] 杨悠悠, 谢云峰, 田菲菲, 等. 常见食品中邻苯二甲酸酯类增塑剂含量及食品包装材料中邻苯二甲酸酯类增塑剂迁移量的测定[J]. 色谱, 2013, 31(7): 674-678.
[19] 应全红, 王霓, 白德奎, 等. 白酒中塑化剂GC-MS检测方法的研究[J].中国酿造, 2013, 32(11): 136-138.
[20] 李楠, 李秀萍, 郑平, 等. 白酒中塑化剂产生时空关系的研究[J]. 轻工科技, 2014(4): 1-2.
[21] 苗宏健, 梁栋, 鲁杰, 等. 气相色谱-串联质谱法测定白酒中18 种邻苯二甲酸酯[J]. 中国食品卫生杂志, 2014, 26(3): 249-253.
[22] 国家质量监督检验检疫总局 GB/T 21911—2008 食品中邻苯二甲酸酯的测定[S]. 北京: 中国标准出版社, 2008.
[23] 马荣山, 张广新. 白酒酿造及新型白酒工艺学[M]. 沈阳: 沈阳出版社, 2005: 102-103.
Source Analysis of Phthalate Acid Esters during Liquor Manufacturing Process
MA Rongshan1, HAN Ying1, WANG Fenglan2, YAN Tingcai1,*, ZHANG Xuan1, JIANG Ling3
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China; 2. Chaoyang City Liaoning Province Food and Drug Administration, Chaoyang 122000, China; 3. Shenyang Ke Xin Engineering Consulting Co. Ltd., Shenyang 110012, China)
The objective of this study was to investigate the source of 16 phthalate acid esters by gas chromatography-mass spectrometry (GC-MS) and to detect the contents of phthalate acid esters in the main raw materials and products during the liquor manufacturing process. The results showed that the average recoveries and precision of 16 phthalate acid esters were in ranges of 84.5%-107.3% and 2.9%-7.3%, respectively, with limits of detection between 0.06 and 1.3 μg/kg. Five phthalate acid esters were detected in three batches of samples including dimethy phalate (DMP), diethyl phthalate (DEP), di-n-butyl phthalate (DBP), diisobutylphthalat (DIBP) and dioctyl pathalate (DEHP). The contents of both DMP and DBP at the initial and middle stages of distillation were higher than at the late stage. The fi rst fermentation stage produced small amounts of DMP and DBP. The second fermentation stage produced a small amount of DEHP, and each of the products did not exceed 0.09 mg/kg. Thus, the liquor manufacturing process produced trace amounts of phthalate acid esters. They were mainly derived from the raw materials.
phthalate acid esters; liquor manufacturing process; gas chromatography-mass spectrometry (GC-MS); source
TS262.3
A
1002-6630(2015)20-0242-05
10.7506/spkx1002-6630-201520047
2014-12-08
沈阳市科技局计划项目(F13-184-9-00)
马荣山(1960—),男,副教授,学士,主要从事食品生物技术研究。E-mail:marongshan5099@163.com
*通信作者:颜廷才(1978—),男,副教授,博士,主要从事果品蔬菜深加工与活性物质提取研究。
E-mail:ytc126127@163.com
