人参多糖提取工艺优化及其组成分析
2015-12-21张艳荣樊红秀刘鸿铖王大为
张艳荣,樊红秀,刘鸿铖,张 颖,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
人参多糖提取工艺优化及其组成分析
张艳荣,樊红秀,刘鸿铖,张 颖,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
以超临界脱脂、脱皂苷后的人参渣为原料,采用超临界辅助热水浸提法提取人参多糖,采用正交试验确定提取人参多糖的最佳工艺条件。结果表明:在萃取压力30 MPa、萃取温度80 ℃、萃取时间1.5 h、物料粒度0.20 mm、原料-夹带剂比例1∶2.5(g/mL)时,人参多糖提取率为(38.03±1.43)%,多糖纯度为(54.71±2.16)%,与热水浸提法相比,提取率和纯度分别提高了16.15%和13.44%。采用高效液相色谱法和高效凝胶渗透色谱法对人参多糖中的单糖组成和多糖平均分子质量进行分析,发现人参多糖含有较多的葡萄糖以及少量的半乳糖、阿拉伯糖,且超临界辅助热水浸提法中这3 种单糖的含量均显著高于热水浸提法。超临界辅助热水浸提法与热水浸提法提取的人参多糖重均分子质量分别为123 847 u和127 016 u,但是超临界辅助热水浸提法的人参多糖中多糖种类多于热水浸提法。
超临界辅助热水浸提法;人参多糖;组成分析
人参是我国传统的名贵中药材,自2012年种植人参被批准为新资源食品以来,人参越来越成为科研工作者的宠儿[1-2]。人参经超临界CO2萃取出人参油和皂苷后,剩余的人参渣中仍含有40%左右的多糖成分,而且物料没有受有机溶剂污染和热变性,仍是提取活性多糖的良好来源。研究[3-4]表明,人参多糖具有增强人体免疫功能、抗肿瘤、抗血栓、抗病毒等作用,在食品保健和医药方面都有很大的开发前景。
目前,人参多糖的提取方法有热水浸 提法、超声波提取法、微波提取法[5]等。热水浸提法工艺简单,成本低,能够适应工业生产的需要[6]。但此法提取时间长,工序繁杂,一般只能提取细胞壁外多糖,对细胞壁内多糖作用不明显,影响多糖的提取效率及生物活性[7]。超临界CO2萃取技术是一门新型提取分离技术,具有操作方便、萃取速率快、选择性强、无毒性等特点。由于超临界CO2流体既有与液体相近的密度,又有与气体相当的高渗透力和低黏度,可以和样品充分地接触。加入夹带剂(如乙醇、水等)可以改善分子质量较大、极性较强的物质的提取效率,使得多糖等强极性物质的超临界CO2萃取成为可能[8-10]。虽然利用超临界CO2萃取技术提取植物多糖的已有报道,但还未见应用于人参多糖的提取。
本研究以超临界脱脂脱皂苷后的人 参渣为原料,采用超临界辅助热水浸提法提取人参多糖,采用高效液相色谱(high performance liquid chromatography,HPLC)法和高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)法分析人参多糖的单糖组成和平均分子质量。通过与传统热水浸提法进行对比,筛选出一种人参多糖提取率与有效成分含量均相对较高的方法,为实现人参加工副产物的综合利用以及人参多糖的研究和开发利用提供一种新思路。
1 材料与方法
1.1 材料与试剂
超临界脱脂脱皂苷后的人参渣 实验室自制;CO2(含量为99.9%,食品级) 长春氧气厂;乙腈(色谱纯) 美国Fisher Scientific公司;L-阿拉伯糖、L-鼠李糖、D-葡萄糖、D-甘露糖、D-木糖、D-半乳糖标准品德国Dr.Ehrenstorfer公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HA121-50-02超临界萃取装置 江苏南通华安超临界萃取有限公司;GB1302电子精密天平 梅特勒-托利多仪器(上海)有限公司;FZ102微型植物粉碎机天津市泰斯特仪器有限公司;600 HPLC仪(配有蒸发光检测器(ELSD 2000ES))、515 HPLC仪(配有410示差折光检测器) 美国Waters公司;DZKW-4电子恒温水浴锅 北京市中兴伟业仪器有限公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 超临界辅助热水浸提法提取人参多糖
称取过一定孔径筛的原料50 g,加入一定比例的水作夹带剂,混合均匀,装入2 L萃取釜中。通过往复泵把CO2打入到萃取釜中,使萃取釜中的压力达到预设值,同时通过循环水系统给萃取釜加热,使温度达到预设值,当温度和压力达到设定值之后,关闭往复泵,在一定时间内保持萃取釜内的温度和压力不变,以便超临界流体和物料混合均匀,使得多糖成分最大限度地从物料中溶出,即静态萃取阶段。
当达到萃取时间后,取出料筒,将超临界处理后的原料置于1 L烧杯中。加入500 mL蒸馏水,100 ℃浸提80 min,间歇搅拌,用0.125 mm(120 目)尼龙布过滤,滤液减压浓缩至100 mL,加入3 倍体积的95%乙醇溶液,置于4 ℃冰箱中静置过夜,离心(3 800 r/min, 10 min),收集沉淀,沉淀用无水乙醇洗涤2 次,然后加适量水溶解,透析,收集透析液,真空干燥,得到白色固体粉末,即为人参多糖固体。称质量,人参多糖提取率计算见下式:
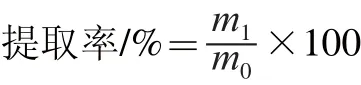
式中:m1为人参多糖的质量/g;m0为原料的质量/g。
1.3.1.1 单因素试验
以人参多糖提取率为考察指标,分别对静态萃取中的萃取压力、萃取温度、萃取时间、夹带剂用量和物料粒度5 个因素进行单因素试验。设定萃取压力为30 MPa、萃取温度为80 ℃、萃取时间为1.5 h、物料粒度为0.30 mm、原料-夹带剂比例为1∶2.5(g/mL)。固定其他因素不变,研究某因素对人参多糖提取率的影响。各因素水平为:萃取压力分别为15、20、25、30 MPa;萃取温度分别为50、60、70、80、90 ℃;萃取时间分别为0.5、1.0、1.5、2.0、2.5 h;原料-夹带剂比例分别为1∶1.0、1∶1.5、1∶2.0、1∶2.5、1∶3.0(g/mL);物料粒度分别为0.90、0.45、0.30、0.20 mm。
1.3.1.2 正交试验设计
在单因素试验的基础上,固定原料-夹带剂为1∶2.5(g/mL),热水浸提条件不变,选择适当的水平对萃取压力、萃取温度、萃取时间和物料粒度这4 个因素进行L9(34)正交试验,确定最佳工艺条件,其因素水平设计如表1所示。
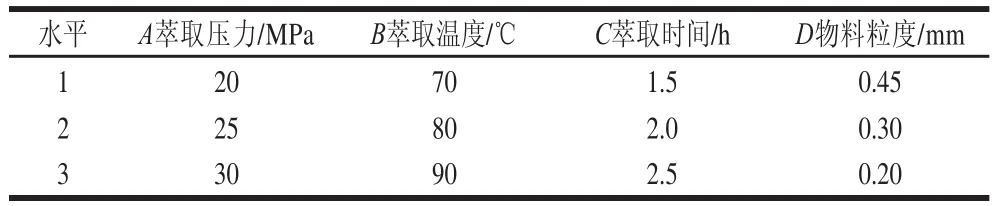
表1 正交试验因素与水平表Table1 Factors and levels used in orthogonal array design
1.3.2 热水浸提法提取人参多糖
参考Zhang Xu等[11]的方法,称取50 g过0.30 mm孔径筛的超临界脱脂脱皂苷后人参粉,按料液比1∶20(g/mL)加入蒸馏水,在100 ℃水浴中提取4 h,用120 目尼龙布过滤,如此浸提3 次。合并滤液,继续方法1.3.1节中的操作,直至得到人参多 糖固体。
1.3.3 指标测定
1.3.3.1 人参多糖纯度的测定
采用苯酚-硫酸法,以葡萄糖为标准绘制标准曲线,于490 nm波长处测定吸光度,根据标准曲线计算、并经换算因子校正得到人参多糖样品中的多糖纯度,实验中测得人参多糖的换算因子为f=2.346(n=5)。
1.3.3.2 HPLC测定人参多糖水解产物的单糖组成
(1)色谱条件
色谱柱:Ultimate Diol二醇基柱(4.6 mm×250 mm, 5 μm 100 Å);检测器:蒸发光检测器(ELSD 2 000 ES);流动相为乙腈-水(75∶25,V/V);流速1.0 mL/min;柱温85 ℃;检测器温度35 ℃。
(2)单糖对照品的配制与线性关系考察
精密称取一定量的L-阿拉伯糖、L-鼠李糖、D-葡萄糖、D-甘露糖、D-木糖、D-半乳糖标准品混合,用超纯水溶解并定容,得到混标溶液(L-阿拉伯糖0.270 mg/mL、L-鼠李糖0.459 mg/mL、D-葡萄糖0.514 mg/mL、D-甘露糖0.303 mg/mL、D-木糖0.330 mg/mL、D-半乳糖0.223 mg/mL)。分别精密吸取混合标准溶液5、10、15、20、25 μL进样,测定各单糖对照品的出峰时间,色谱峰面积的对数为纵坐标(Y),以标准品进样量(μg)的对数为横坐标(X)绘制标准曲线,计算线性回归方程(表2)。

表2 单糖标准品的线性回归方程、相关系数和线性范围Table2 Linear equations with correlation coeffi cients and linear ranges of six monosaccharides
(3)样品的制备与测定
取适量人参多糖固体,配制成5%的水溶液,采用Sevag法重复3 次以去除蛋白成分,得到的溶液在200~500 nm波长处进行紫外光谱扫描,发现在260~280 nm波长范围内没有蛋白质吸收峰,除蛋白结束。水相合并后减压浓缩,加入95%乙醇溶液沉淀,收集沉淀,经乙醇洗涤、真空干燥后得脱蛋白后的人参多糖。
精确称取15 mg脱蛋白后人参多糖,加入2 mL 2 mol/L的三氟乙酸溶液,封管后于100 ℃烘箱中水解10 h。冷却至室温,水解液用0.1 mol/L NaHCO3溶液中和至pH 7,真空干燥后,残渣加入蒸馏水溶解并定容至1 mL,过0.22 μm滤膜,得供试样品液,将供试样品液稀释50 倍,按照方法1.3.3.2节的色谱条件重复进样3 次,每次10 μL。
1.3.3.3 HPGPC测定人参多糖的平均分子质量
色谱条件:使用515型HPLC仪,UltrahydrogelTM500色谱柱(7.8 mm×300 mm)和410示差折光检测器,流动相为0.1 mol/L NaNO3溶液,流速0.5 mL/min,柱温和检测器温度均为35 ℃,进样量为20 μL。称取脱蛋白后人参多糖样品用流动相配成2 mg/mL的溶液,经0.22 μm的滤膜过滤后,用上述的HPLC条件进行分析,记录色谱图,采用GPC软件计算样品的平均相对分子质量。
1.3.4 数据分析
每组实验在相同的条件下平行3 次,以降低实验操作过程所产生的误差,数据均以±s表示,利用SPSS 16.0方差分析对组间和组内差异进行比较,P<0.05时为差异显著,P<0.01时为差异极显著。
2 结果与分析
2.1 超临界辅助热水浸提法单因素试验结果
2.1.1 萃取压力对人参多糖提取率的影响
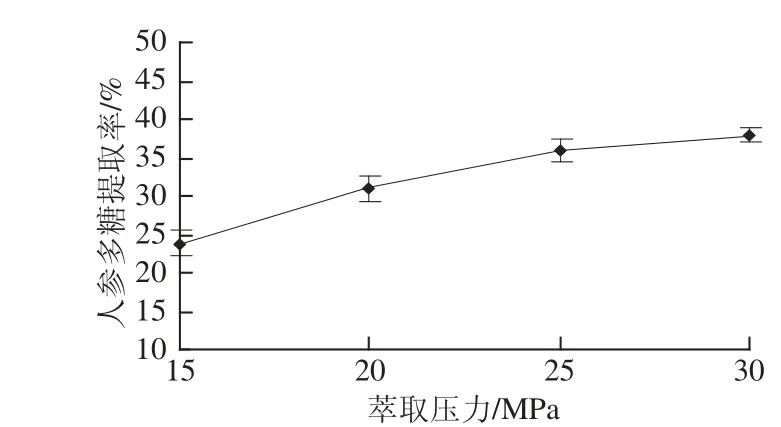
图1 萃取压力对人参多糖提取率的影响Fig.1 Effect of extraction pressure on the yield of ginseng polysaccharides
由图1可知,在萃取压力为15~30 MPa范围内,人参多糖的提取率随着萃取压力的升高而增大。这是由于压力的升高可使超临界流体密度增大,有利于多糖在超临界流体中的溶解,加快提取速率[12-13];同时,压力的增大也会促进基质的溶胀,从而大大加快了有效成分向外扩散的速率,促进萃取过程中的传质;此外,在较高的萃取压力下,组织发生形变、疏松,细胞壁被破坏[14],细胞壁通透性提高,使多糖溶出性增强。由于本试验设置的最大允许压力为30 MPa,所以选择萃取压力为30 MPa。
2.1.2 萃取温度对人参多糖提取率的影响
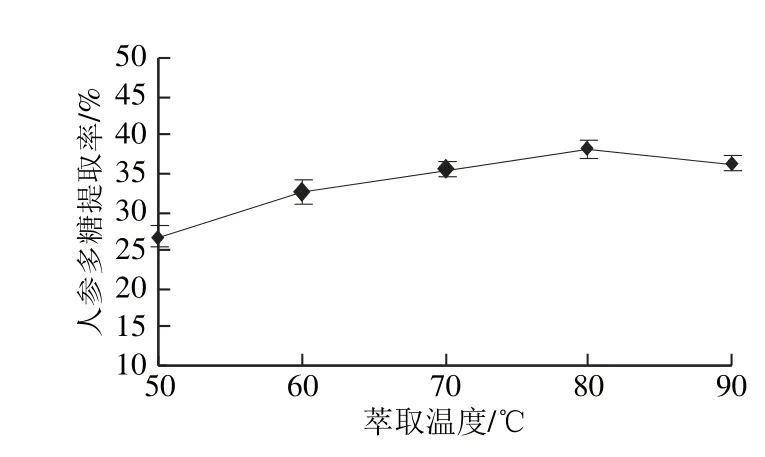
图2 萃取温度对人参多糖提取率的影响Fig.2 Effect of extraction temperature on yield of ginseng polysaccharides
由图2可知,当萃取温度小于80 ℃时,随着萃取温度的升高,人参多糖的提取率呈现上升的趋势,这是由于萃取温度的升高会使溶质的饱和蒸汽压升高,多糖溶解度增大。此外,萃取温度对植物细胞的结构也有一定影响,在较高的萃取温度条件下,植物细胞会发生膨胀、软化,细胞壁的硬度降低,孔径增大,使其中的多糖更容易被提取出来[15];而高于80 ℃时,提取率随着萃取温度的上升而下降,这是因为温度升高导致超临界流体密度的降低占据了主导地位,溶解能力下降[16-17]。因此,选择萃取温度为80 ℃。
2.1.3 萃取时间对人参多糖提取率的影响
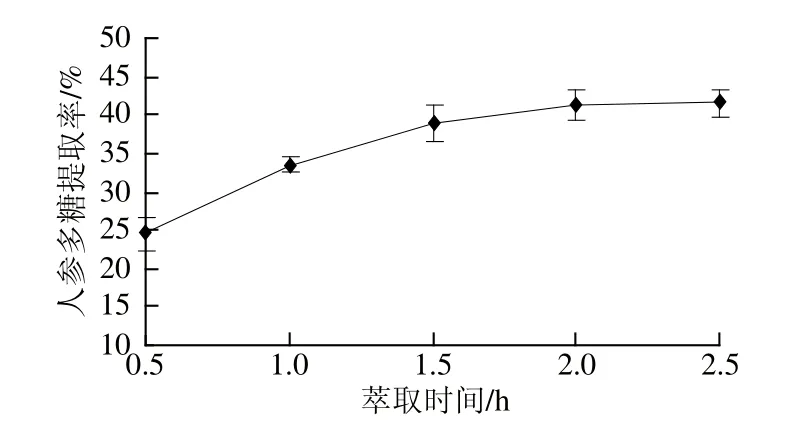
图3 萃取时间对人参多糖提取率的影响Fig.3 Effect of extraction time on yield of ginseng polysaccharides
由图3可知,随着萃取时间的延长,人参多糖的提取率呈逐渐增加的趋势,当萃取时间超过2.0 h时,继续延长萃取时间,提取率增加不显著。这是由于随着时间的延长,物料与超临界流体和夹带剂的接触时间延长,人参多糖可以充分地溶出[18]。而萃取时间超过2.0 h时,由于超临界流体和夹带剂已能完全渗入到基质当中,多糖充分溶出,故提取率增加不大。而萃取时间过长也会造成生产周期增长、耗能增加,因此综合考虑,选择萃取时间为2.0 h。
2.1.4 夹带剂用量对人参多糖提取率的影响
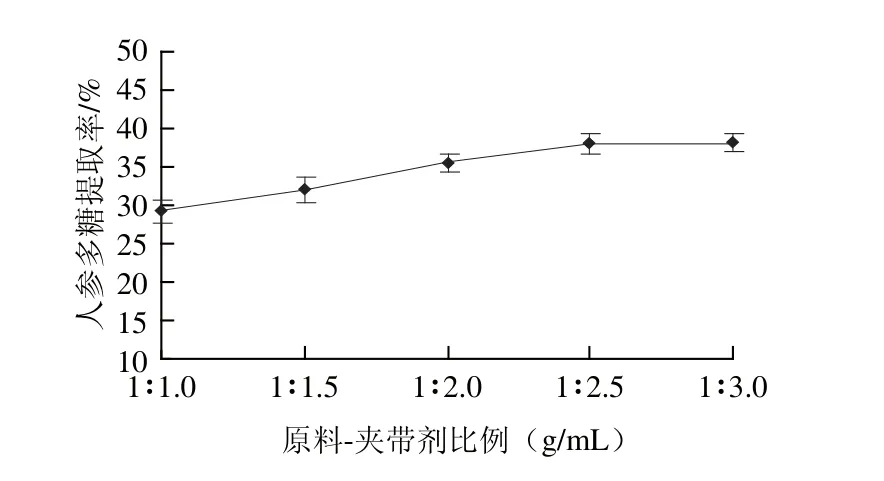
图4 原料与夹带剂比例对人参多糖提取率的影响Fig.4 Effect of ratio of material to entrainer on the yield of ginseng polysaccharides
由图4可知,人参多糖提取率随着夹带剂用量的增加而增加;当原料-夹带剂比例为1∶2.5(g/mL)时,人参多糖提取率达到最高,表明采用水作为夹带剂有利于人参多糖的提取。这是因为水既对多糖有较好的溶解性,又对基质具有较好的溶胀作用,使物料结构疏松,多糖的溶出阻力降低[19-20]。此外,加入水也会增大超临界流体的极性,提高对溶质的溶解性及选择性。继续增加夹带剂用量时,多糖提取率显著变化,且夹带剂用量过大会在装料中易发生液体溢出现象[21],因此,选择原料-夹带剂比例为1∶2.5(g/mL)。
2.1.5 物料粒度对人参多糖提取率的影响
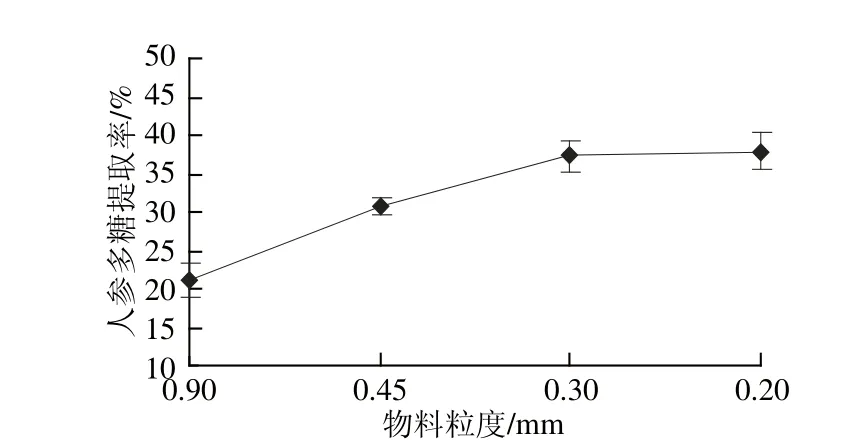
图5 物料粒度对人参多糖提取率的影响Fig.5 Effect of raw material particle size on the yield of ginseng polysaccharides
由图5可知,物料粒度大于0.3 mm时,人参多糖提取率随着粒度的减小而显著提高;物料粒度小于0.3 mm时,提取率随着粒度的减小增加不明显。这是因为物料粒度越小,多糖与超临界流体和夹带剂的接触面积大幅度增加,缩短了多糖从物料内部扩散到流体相的路径,减小了内部扩散阻力。但粒度过细不仅会增加物料加工的难度,而且由于原料粒度过细可能会使超临界萃取设备的管道发生堵塞,降低多糖的萃取提取率。因此,最佳的物料粒度选用0.3 mm。
2.2 正交试验设计及结果
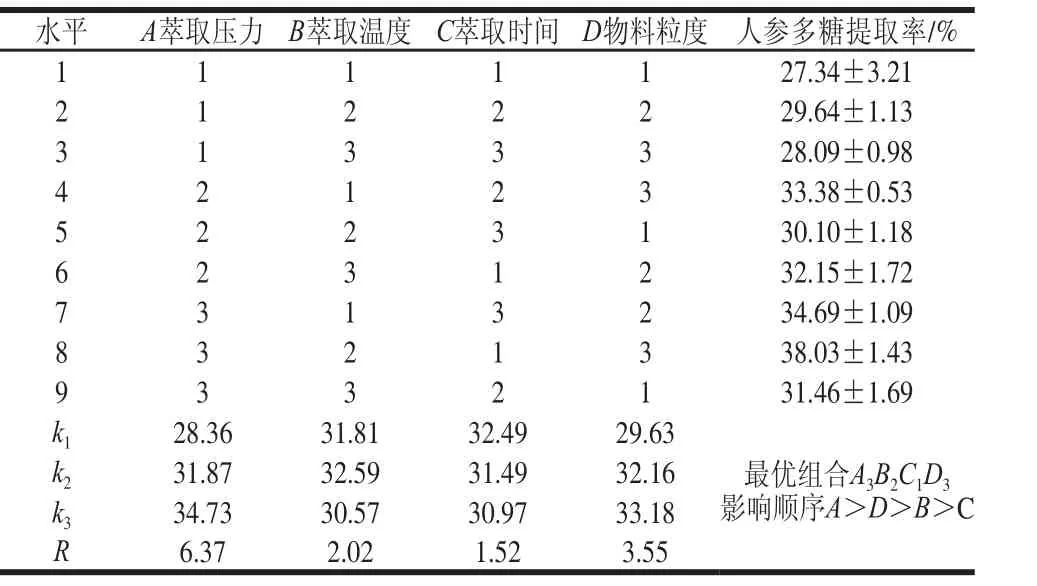
表3 L9(34)正交试验结果Table3 Results of L9(34) orthogonal array design and range analysis
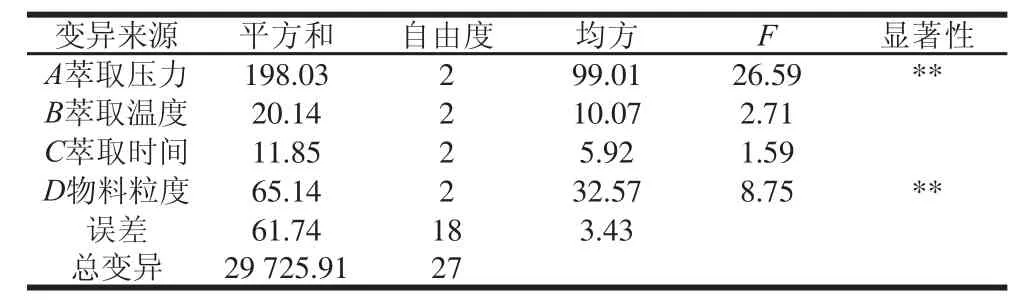
表4 正交试验方差分析结果Table4 Results of analysis of variance for orthogonal array design
根据表3中的R值可以得出,各因素对人参多糖提取率的影响程度依次为A>D>B>C,即萃取压力的影响最大,次之为物料粒度,再次为萃取温度和萃取时间。由表4的方差分析结果可知,萃取压力和物料粒度对提取率的影响达到极显著水平(P<0.01),而萃取温度和萃取时间对提取率影响不显著(P>0.05),这一结果与极差分析结果一致。最优方案为A3B2C1D3,即萃取压力30 MPa、萃取温度80 ℃、萃取时间1.5 h、物料粒度0.20 mm。在此条件下人参多糖的提取率为(38.03±1.43)%。
2.3 提取方法的比较
2.3.1 不同提取方法对人参多糖提取率及多糖纯度的影响
分别采用超临界辅助热水浸提法的最优工 艺以及热水浸提法提取人参多糖,计算提取率,并对 获得的人参多糖进行多糖纯度的测定,结果如表5所示。超临界辅助热水浸提法的人参多糖的提取率和纯度比热水浸提法分别高16.15%和13.44%,并且差异显著(P<0.05)。提取时间方面,超临界辅助热水浸提法仅用了热水浸提法的1/4左右。这是由于超临界流体具有较高的溶解能力和扩散性能,可以 和物料充分接触,有利于提取的高效性和强选择性。而且超临界流体的穿透作用可使细胞壁脆性增强,通透性提高,有利于人参多糖的溶出性和分散性,因而能有效提高提取率[22]。
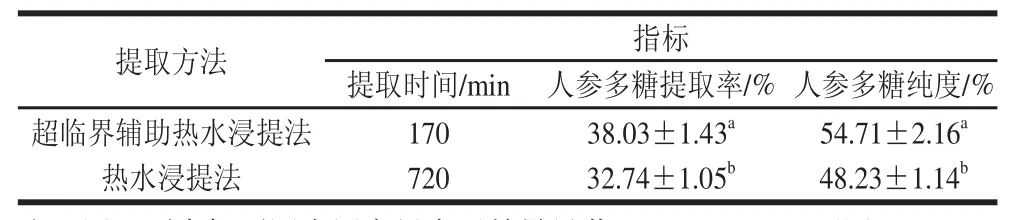
表5 不同提取方法对人参多糖提取率和多糖纯度的影响Table5 Effects of different extraction methods on the yield and purity of ginseng polysaccharides
2.3.2 HPLC分析不同提取方法对人参多糖水解产物中单糖组成的 影响
利用HPLC技术对超临界辅助热水浸提法和热水浸提法提取的人参多糖酸水解液进行分析研究,单糖标准液色谱图见图6,两种方法的多糖水解产物的HPLC图见图7,单糖含量的分析结果如表6所示。
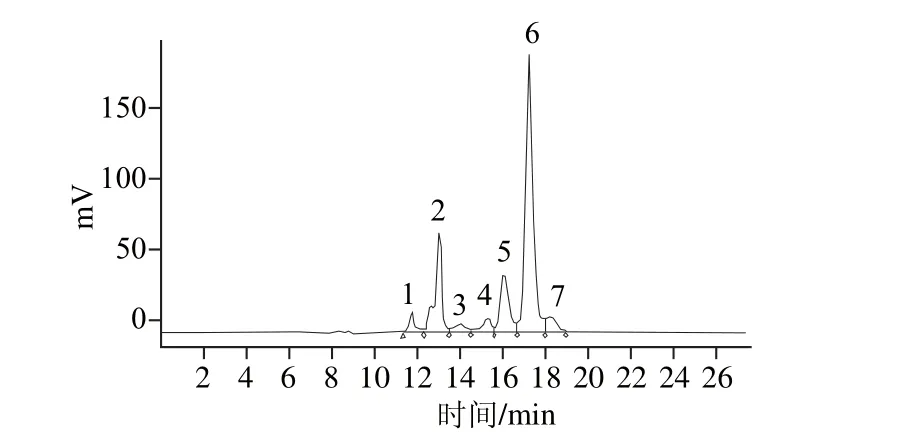
图6 混合标准单糖色谱图Fig.6 Chromatograms of mixed monosaccharide standards
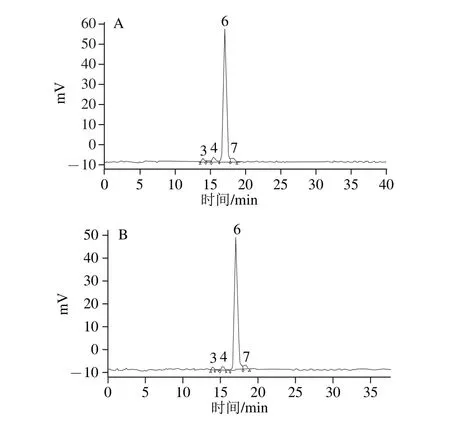
图7 超临界辅助热水浸提法(A)和热水浸提法(B)提取人参多糖的单糖组成色谱图Fig.7 Chromatograms of monosaccharide composition of ginseng polysaccharides extracted by supercritical fl uid assisted hot water extraction (A) and hot water extraction (B)

表6 HPLC测定结果Table6 Monosaccharide composition of ginseng polysaccharides determined by HPLC %
由表6可 以看出,采用超临界辅助热水浸提法和热水浸提法提取的人参多糖的单糖组成相似,均含有较多的葡萄糖,以及少量的半乳糖、阿拉伯糖,表明这两种方法提取的人参多糖主要由淀粉样葡聚糖和果胶成 分构成。研究[6]表明,人参淀粉样葡聚糖和人参果胶具有免疫调节、抗肿瘤以及降血糖等功效,是人参多糖中的重要活性成分。此外,超临界辅助热水浸提法中葡萄糖、半乳糖和阿拉伯糖的含量(质量分数)均显著高于热水浸提法(P<0.05)。由此可见,超临界辅助热水浸提法不仅省时、高效,而且能一定程度上提高了活性成分的提取率。
2.3.3 HPGPC分析不同提取方法对人参多糖平均分子质量的影响
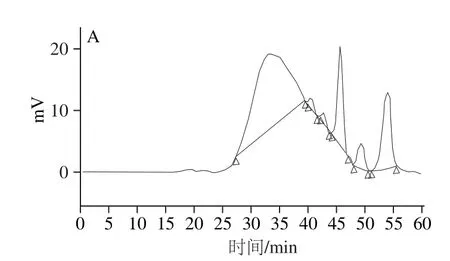
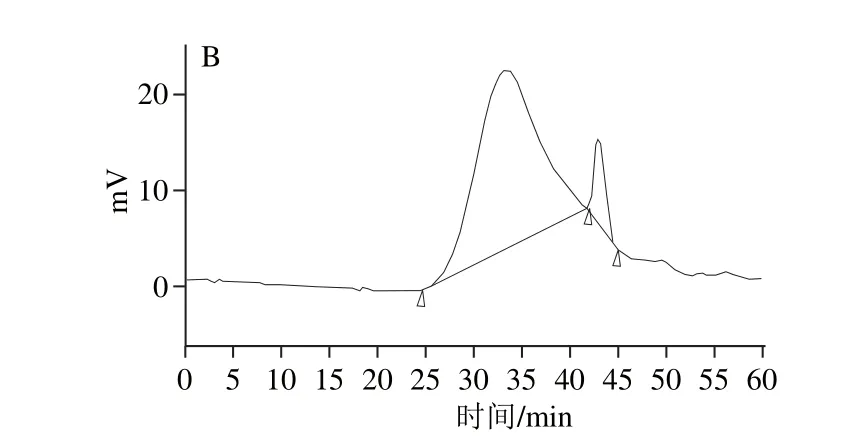
图8 超临界辅助热水浸提法(A)和热水浸提法(B)提取人参多糖的GPC 色谱图Fig.8 GPC chromatogram of ginseng polysaccharides extracted by supercritical fluid assisted hot water extraction (A) and hot water extraction (B)
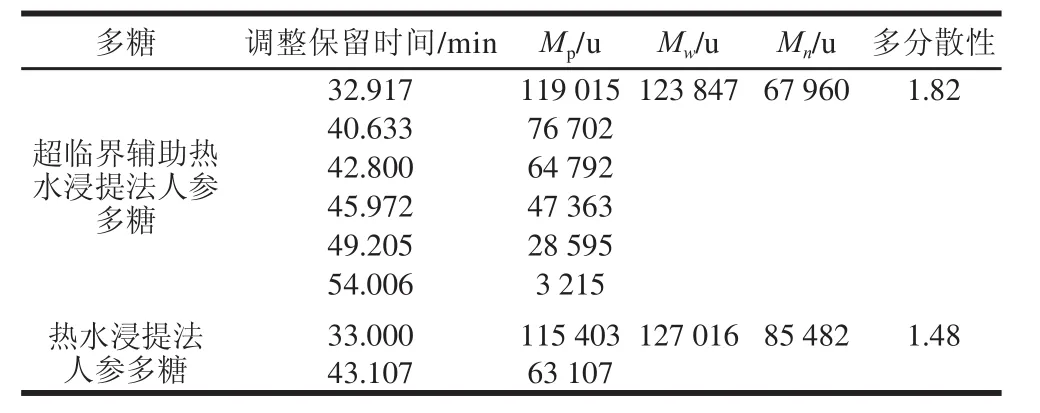
表7 GPC测定结果Table7 Results of GPC analysis
如图8所示,超临界辅助热水浸提法和热水浸提法提取的人参多糖GPC色谱峰均分布较宽,对称性差,说明这2 种方法提取的人参多糖均由多种多糖混合而成。如表7所示,超临界辅助热水浸提法提取的人参多糖的峰位分子质量(Mp)从左到右依次为119 015、76 702、 64 792、47 363、28 595、3 215 u,通过GPC软件计算得到其重均分子质量(Mw)为123 847 u,数均分子质量(Mn)为67 960 u,多分散性1.82;热水浸提法提取的人参多糖的峰位分子质量(Mp)从左到右依次为115 403、63 107 u,通过GPC软件计算得到其重均分子质量(Mw)为127 016 u,数均分子质量(Mn)为85 482 u,多分散性1.48。对比2 种提取方法可以看出,超临界辅助热水浸提法提取的人参多糖的Mw、Mn都小于热水浸提法,这可能是由于超临界辅助热水浸提过程中,人参多糖在高温、高压的作用下发生了降解。而超临界辅助热水浸提法提取的人参多糖的多分散性大于热水浸提法,表明超临界辅助热水浸提法提取的人参多糖GPC色谱峰分布比后者更宽,该法提取的人参多糖中所含的多糖种类比后者多,这是由于超临界流体具有较高的溶解能力和穿透作用,有利于充分溶出细胞壁内的人参多糖。
3 结 论
本研究首次将超临界萃取技术应用于人参多糖的提取工艺中,采用超临界静态萃取技术处理超临界脱脂脱皂苷后的人参渣,得到的物料再用热水浸提。研究了静态萃取中萃取压力、萃取温度、萃取时间、夹带剂用量和物料粒度5 个因素对提取工艺的影响,并通过正交试验优化得出了超临界萃取的最佳工艺参数为:萃取压力30 MPa、萃取温度80 ℃、萃取时间1.5 h、原料-夹带剂比例(g/mL)1∶2.5、物料粒度0.20 mm。此工艺条件下所得的人参多糖提取率为(38.03±1.43)%,多糖纯度为(54.71±2.16)%,与热水提取法相比,提取率和纯度分别提高了16.15%和13.44%,而在时间上,超临界辅助热水浸提法仅用了热水浸提法的1/4左右。HPLC测定结果显示,超临界辅助热水浸提取法的人参多糖中葡萄糖、半乳糖、阿拉伯糖的含量均显著高于热水浸提法。HPGPC测定结果显示,超临界辅助热水浸提法提取的人参多糖的重均分子质量、数均分子质量都小于热水浸提法,但是超临界辅助热水浸提法提取的人参多糖中所含的多糖种类比热水浸提法多。
本研究所采用的超临界辅助热水浸提法和热水浸提法相比较,在提取时间和多糖提取率上具有显著的优势,克服了传统工艺提取时间长、重复过程多、水资源消耗大、提取效率低的缺点,而且多糖中有效成分的提取率也有一定程度的提高,表明超临界辅助热水浸提法是一种快速高效的新型提取方法,对人参多糖的工业生产应用具有一定的参考意义。
[1] WANG Ying, JIANG Ruizhi, LI Guirong, et al. Structural and enhanced memory activity studies of extracts from Panax ginseng root[J]. Food Chemistry, 2010, 119: 969-973.
[2] 梁海艳. 人参多糖对乳酸菌发酵特性的影响及应用[D]. 长春: 吉林大学, 2013.
[3] JIAO Lili, WANG Debin, ZHANG Xiaoyu, et al. Characterization and immunostimulating effects on murine peritoneal macrophages of oligosaccharide isolated from Panax ginseng C.A.Meyer[J]. Journal of Ethnopharmacology, 2012, 144: 490-496.
[4] PEAK I B, MOON Y, KIM J, et al. Pharmacokinetics of ginseng saponin metabolite compound K in rats[J]. Biopharm Drug Dispos, 2006, 27(1): 39-45.
[5] 吴琼, 代永刚, 邹险峰, 等. 正交试验优化微波辅助提取人参根茎和人参须多糖[J]. 食品科学, 2012, 33(24): 156-159.
[6] 张旭. 人参多糖的系统分析及其免疫活性研究[D]. 长春: 东北师范大学, 2009.
[7] 李坚. 破壁灵芝孢子中多糖的提取、纯化及其抗氧化的研究[D]. 长沙: 湖南农业大学, 2010.
[8] 任美玲, 吕兆林, 欧阳呓林, 等. 气相色谱柱前衍生化测定竹叶多糖超临界CO2提取物[J]. 食品科学, 2012, 33(6): 215-219.
[9] SANTOS S A O, VILLAVERDE J J, SILVA C M, et al. Supercritical fluid extraction of phenolic compounds from Eucalyptus globulus Labillbark[J]. The Journal of Supercritical Fluids, 2012, 71(1): 71-79.
[10] 赵丛枝, 苑社强, 王磊, 等. 响应面法优化超临界CO2提取无花果多糖工艺[J]. 中国食品学报, 2013, 13(7): 46-52.
[11] ZHANG Xu, YU Li, BI Hongtao, et al. Total fractionation and characterization of the water-soluble polysaccharides isolated from Panax ginseng C. A. Meyer[J]. Carbohydrate Polymers, 2009, 77: 544-552.
[12] NISHA A, SANKAR K U, VENKATESWARAN G. Supercritical CO2extraction of Mortierella alpina single cell oil: comparison with organic solvent extraction[J]. Food Chemistry, 2012, 133(1): 220-226.
[13] 任美玲. 竹叶多糖的提取制备及生物活性研究[D]. 北京: 北京林业大学, 2012.
[14] 陈瑞战. 超高压提取人参皂苷工艺及机理研究[D]. 长春: 吉林大学, 2005.
[15] 罗登林, 要萍, 刘建学, 等. 超临界CO2静态膨胀-动态循环萃取灵芝孢子油[J]. 农业工程学报, 2008, 24(11): 256-259.
[16] 李红茹, 李淑芬, 段宏泉, 等. 超临界流体萃取雷公藤中有效成分的工艺优化[J]. 天津大学学报, 2007, 40(3): 269-274.
[17] GAVA A F, SZARKA S, SIMANDI B, et al. Supercritical fluid extraction of Alnus glutinosa (L.) Gaertn[J]. The Journal of Supercritical Fluids, 2012, 61: 55-61.
[18] 李红茹. 超临界流体在中药雷公藤制剂中的应用及其溶解度的理论研究[D]. 天津: 天津大学, 2008.
[19] 侯彩霞. 柴胡药用成分的超临界CO2萃取工艺及模型研究[D]. 天津:天津大学, 2007.
[20] 赵宋亮. 超临界CO2萃取都昌菊三七生物碱的工艺及分离研究[D].南昌: 南昌大学, 2008.
[21] 唐韶坤. 超临界二氧化碳萃取葡萄籽中食用及药用成分的工艺和模型研究[D]. 天津: 天津大学, 2003.
[22] 曲帅. 人参有效活性成分的提取分离及含量测定[D]. 长春: 吉林大学, 2013.
Optimization of Extraction Process of Ginseng Polysaccharides and Monosaccharide Composition Analysis
ZHANG Yanrong, FAN Hongxiu, LIU Hongcheng, ZHANG Ying, WANG Dawei*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Ginseng roots were defatted by supercritical fl uid extraction, treated to remove ginsenosides and extracted by a supercritical fl uid assisted hot water extraction method to obtain gin seng polysaccharides. The optimal c onditions for the extraction of ginseng polysaccharides were determined by orthogonal array experiments. The results showed that when the extraction process was conducted on sampl es pulverized to a particle size of 0.20 mm at 80 ℃ and 30 MPa for 1.5 h with a raw material to entrainer of 1:2.5 (g/mL), the yield and purity of ginseng polysaccharides were (38.03 ± 1.43)% and (54.71 ± 2.16)%, respectively, increased by 16.15% and 13.44% compared to those obtained with the traditional hot water ext raction method, respectively. Monosaccharide composition and mean molecular mass of ginseng polysaccharides were analyzed by high performance liquid chromatography (HPLC) and high performance gel permeation chromatography (HPGPC). The results showed that there were a large quantity of glucose and small quantities of galactose and arabinose. Th e contents of the three monosaccharides obtained with supercritical fl uid assisted hot water extraction were signifi cantly higher than those obtained wi th hot water ex traction. The average m olecular mass of ginseng polysaccharides extracted by supercritical fl uid assisted hot water extraction and hot water extraction were 123 847 and 127 016 u, respectively. More polysaccharide species in ginseng roots were extracted by supercritical fl uid assisted hot water extraction than by hot water extraction.
supercritical fl uid assisted hot water extraction; ginseng polysaccharides; compositional analysis
TS201.1
A
1002-6630(2015)20-0037-06
10.7506/spkx1002-6630-201520007
2015-04-24
吉林省教育厅“十二五”科学技术研究项目(吉教科合字2013第53号);长春市科技计划项目(长科技合2013183,13NK12)
张艳荣(1965—),女,教授,博士,研究方向为粮食、油脂与植物蛋白工程。E-mail:xcpyfzx@163.com
*通信作者:王大为(1960—),男,教授,博士,研究方向为粮食、油脂与植物蛋白工程。E-mail:xcpyfzx@163.com
