间苯氧基苯甲酸分子印迹膜的电化学聚合制备及其应用
2015-12-21戴芳芳郭雪霞张宇昊
戴芳芳,周 瑶,马 良,2,3,*,郭雪霞,张宇昊,2,5
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400716;3.农业部柑桔产品质量安全风 险评估实验室(重庆),重庆 400712;4.农业部规划设计研究院,北京 100125;5.西南大学 国家食品科学与工程实验教学示范 中心,重庆 400715)
间苯氧基苯甲酸分子印迹膜的电化学聚合制备及其应用
戴芳芳1,周 瑶1,马 良1,2,3,*,郭雪霞4,张宇昊1,2,5
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400716;3.农业部柑桔产品质量安全风 险评估实验室(重庆),重庆 400712;4.农业部规划设计研究院,北京 100125;5.西南大学 国家食品科学与工程实验教学示范 中心,重庆 400715)
研究间苯氧基苯甲酸快速准确的检测方法可为环境中间苯氧基苯甲酸监 测以 及拟除虫菊酯农药代谢物的生态 风险评价提供技术支持。本实验以邻氨基酚为功能单体,以间苯氧基苯甲酸为模板分 子,采用循环伏安法在玻碳电极表面聚合形成可用于检测间苯氧基苯甲酸的分子印迹膜, 结 合电化学技术用于水中间苯氧基苯甲酸的检测研究,30 s可对间苯氧基苯甲酸完成响应,在2.00~1 1.00 mg/L质量浓度范围内,分子印迹膜的响应电流变化值与间苯氧基苯甲酸质量浓度呈线性关系,线性方程为y=0.29x+2.16,相关系数为0.99,方法的检出限为1.47 mg/L;对加标水样进行检测,回收率在92.00%~101.00%之间。
间苯氧基苯甲酸;环境污染物;分子印迹膜;电化学
间苯氧基苯甲酸(3-phenoxybenzoic acid,3-PBA)是一种常用于拟除虫菊酯类农药和染料生产的重要化学原料,也是大多数拟除虫菊酯类农药的主要代谢物质。3-PBA可以和雌激素受体结合,显示拟雌激素活性[1],也可以抑制雄激素活性,显示抗雄激素活性[2-3],从而干扰人类及动物内分泌功能,给生态系统带来严重危害。3-PBA在土壤中的半衰期长达180 d,比大多数拟除虫菊酯类杀虫剂的半衰期(约30 d)长[4-7],且其迁移速率快,对土壤的生产能力、土壤微生物生态平衡造成严重影响。残留在土壤中或漂浮在大气中的3-PBA通过降雨沉降和径流进入地表水和地下水,对水源造成严重污染,通过水中的迁移,进而危害人畜安全[8]。加强对水中3-PBA的检测可以有效监测水中3-PBA的含量,防止3-PBA污染水源,保障人畜的饮水安全。
目前3-PBA的检测方法主要包括气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)[9-10]法、液相色谱-质谱法[11]、免疫分析法[12-13]等,且多集中在对尿液和土壤样品的检测,这些方法检测灵敏度高、检测结果准确,但前处理过程存在处理复杂、耗时长、分 析成本高等不足。本实验以3-PBA为研究对象,研究制备分子印迹膜,建立了一种简单、快速、经济的基于分子印迹膜的电化学检测技术,用于水中3-PBA的快速检测,为3-PBA的快速检测提供了一种简便的产品和处理方法。
1 材料与方法
1.1 材料与试剂
间苯氧基苯甲酸 德国Sigma化学试剂公司;邻氨基酚(o-aminophenol,OAP) 阿拉丁试剂(上海)有限公司;铁氰化钾(不小于99.5%) 天津市大茂化学试剂厂;氯化钾(不小于99.5%)、氢氧化钠 成都市科龙化工试剂厂;甲醇、二氯甲烷、乙腈 天津市四友精细化学品有限公司;高氯酸(70%~72%) 天津政成化学制品有限公司;硫酸(95%~98%) 重庆科试化学有限公司;残杀威、久效磷、乐果 南京红太阳集团;Al2O3粉(粒径1.0、0.3、0.05 μm) 武汉高仕瑞联科技有限公司;所用试剂均为分析纯;实验用水为二次蒸馏水。
背景液:pH 6的5 mmol/L铁氰化钾和0.1 mol/L氯化钾(1∶1,V/V)混合溶液。
1.2 仪器与设备
CHI610E电化学工作站、CHI104型工作电极(直径为3 mm的玻碳盘电极)、CHI150型饱和甘汞参比电极、CHI115型铂丝对电极(铂丝规格37 mm×0.5 mm)上海辰华仪器有限公司;Elix10纯水仪 法国Millipore公司;KQ-50超声清洗机 昆山超声仪器有限公司;PHS-25型号pH计 上海仪电科学仪器股份有限公司;CJ78-1磁力搅拌器 上海将任实验设备有限公司。
1.3 方法
1.3.1 玻碳电极的预处理[14]
将玻碳电极依次用粒径1.0、0.3、0.05 μm的Al2O3抛光粉悬浊液在Microcloth抛光布上进行打磨、抛光,抛光后先用二次蒸馏水洗去表面污物,再在二次蒸馏水中超声2~3 min,重复2~3 次,直至得到一个平滑光洁的电极表面。将处理干净的玻碳电极作为工作电极,置于10 mL背景液中扫描得到循环伏安图,其中扫描速率为50 mV/s,扫描范围为-0.1~0.6 V,观察可逆峰电位差,若峰电位差大于90 mV,应用蒸馏水冲净电极表面后,重复之前的步骤进行抛光,直至可逆峰电位差小于90 mV。
1.3.2 3-PBA分子印迹聚合膜(molecularly imprinted membrane,MIM)的制备
称取4×10-4mol OAP溶于2 mL 0.5 mol/L的高氯酸溶液中,用0.5 mol/L的氢氧化钠溶液调节其pH值至6.0,加入0.05 mol/L 3-PBA乙腈溶液2 mL,用乙腈定容至10 mL制得聚合液。将聚合液超声5 min,氮吹除氧10 min。将处理好的3个电极体系(玻碳电极为工作电极、铂丝电极为辅助电极,饱和甘汞电极为参比电极)浸入电解池中,于-0.2~1.2V电位范围内,以50 mV/s的扫描速率扫描15圈聚合得到嵌有3-PBA模板的不导电聚合膜。
将电聚合后的工作电极下端置于0.5 mol/L硫酸-乙腈(4∶1,V/V)混合溶液中磁力搅拌洗脱12 h以除去聚合膜中的模板分子,得到具有3-PBA分子空穴的MIM。非分子印迹膜的制备除在电聚合液中不加模板分子3-PBA外,其余步骤与MIM的制备完全相同。
1.3.3 电化学检测方法
1.3.3.1 电极导电性测定
参照栾崇林等[15]的方法。用循环伏安(cyclic voltammetry,CV)法作导电性检测:电位范围为-0.1~0.6 V,扫描速率为50 mV/s。
1.3.3.2 电化学定量测定
用背景电流比CV法低、灵敏度比CV法高的差分脉冲伏安(differential pulse voltammetry,DPV)法作定量分 析,DPV的条件[15]为:电位范围-0.1~0.6 V,电位增量为0.004 V,振幅为0.05 V,脉冲宽度为0.05 s,采样宽度为0.0167 s。
定量测量步骤参照Liu Yating等[16]的方法:将1.3.2节中制备的印迹电极浸入pH 6的5 mmol/L铁氰化钾和0.1 mol/L氯化钾(1∶1,V/V)的背景液中,测定溶液的还原峰电流I0,然后将其浸入含一定质量浓度3-PBA的待测溶液中,富集30 s后取出,二次蒸馏水冲洗,N2干燥,再浸入背景液中,测定其还原峰电流Ix,以峰电流变化ΔI=(I0-Ix)作为电极对该浓度3-PBA的响应值。
1.3.4 MIM的再生
将测试后的印迹电极浸入25 mL 0.5 mol/L硫酸-乙腈混合液(4∶1,V/V)中磁力搅拌下洗脱15 min后,用二次蒸馏水洗净,室温干燥后即可用1.3.3.2节法对3-PBA再次进行测定。
2 结果与分析
2.1 功能单体的选择
3-PBA(图1a)由一个二苯醚和一个羧基组成,采用含氨基、羧基的功能单体可以与模板分子3-PBA中的羧基、苯环形成氢键、π-π键等作用力,形成分子印迹膜,常用的功能单体有苯胺及 其衍生物等。由于MIM对模板分子的识别主要依靠它与模板分子之间在化学基团以及三维空间结构上的相互匹配,其选择性与模板分子和功能单体之间相互作用的数量、强度以及模板分子的形态、刚性有关。苯胺具有氨基活性功能团(图1b),OAP作为苯胺的衍生物具有氨基和酚烃基两种活性功能团(图1c),能与模板分子3-PBA中的羧基通过氢键形成更多的结合位点[17],从而提高识别灵敏性;此外,OAP在酸性、中性和碱性溶液中都能形成聚合膜[18-19],形成的聚邻氨基酚膜在酸性、中性和碱性溶液中都不溶解[20],可用于复杂化学环境中的目标物质检测,因此本研究选择OAP作为功能单体。
图1 1 3-PBA(a)、苯胺(b)、bOAP(c)结构式Fig.1 Structures of 3-PBA (a), aniline (b) and OAP (c)
2.2 聚合方法的选择
分子印迹膜的制备方法主要有光聚合法、热聚合法和电聚合法。光聚合法和热聚合法制备的膜具有膜厚难控制,印迹位点不易形成和制备时间长等不足,而电聚合膜具有膜厚可控、对电极表面形状要求低、易实现自动化、制备时间短等优点[21]。故本实验选用电聚合法中常用的循环伏安法制备聚合膜,制备过程简单快速。
2.3 分子印迹膜的电聚合过程
图2为按1.3.2节方法制备MIM时的循环伏安图。膜的形貌结构与电解液阴离子、浓度及电位控制有关[22]。从CV图看出,扫描从起始电位起正向进行,第1圈有两个氧化峰和一个还原峰,其中位于0.424 0 V的氧化峰是OAP上烃基氧化形成的,位于0.782 1 V的氧化峰是OAP上氨基氧化形成。第2圈0.538 3 V和0.886 6 V处的氧化峰是OAP单体聚合生成二聚物形成的;第3圈时,氧化峰逐渐消失,扫描12 次后氧化还原峰基本消失,氧化电流逐渐降低,分析原因可能为玻碳电极表面的OAP分子上的羟基或氨基发生氧化后与未发生氧化的OAP分子的—OH、—NH2位点通过氢键结合生成二聚物,二聚物的氧化使得聚合进一步进行,反应最终形成了弱导电性的致密的分子印迹膜。模板分子3-PBA在聚合过程中由氢键、π-π键等作用随之嵌入OAP聚合膜的骨架中,形成了嵌有模板分子的分子印迹膜[23]。邻氨基酚电聚合过程如图3所示。

图2 3-PBA与OAP聚合过程的循环伏安图Fig.2 Cyclic voltammogram for the polymerization of 3-phenoxybenzoic acid and o-aminophenol
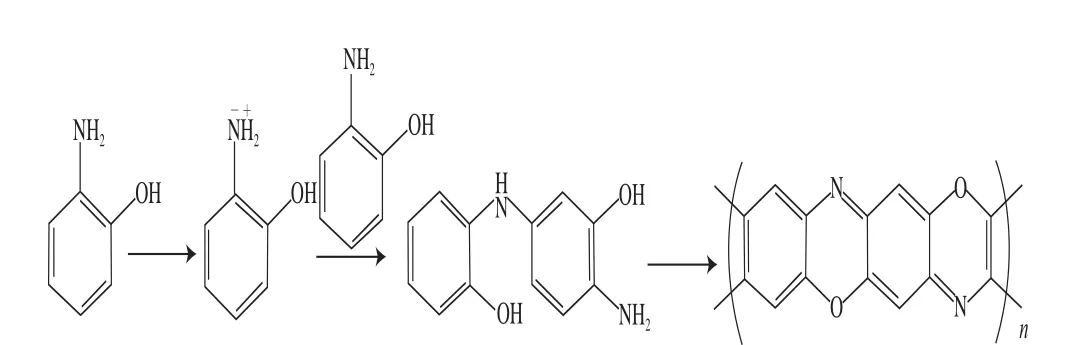
图3 聚邻氨基酚的聚合机制Fig.3 The polymerization mechanism of POAP
2.4 电极的电化学特性
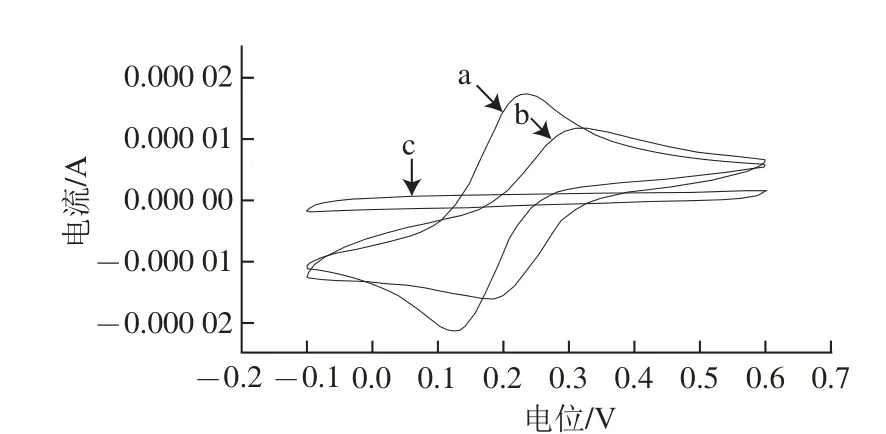
图4 铁氰化钾溶液中电极的循环伏安图Fig.4 CV curves of electrodes in K3[Fe(CN)6] solution
将裸玻碳电极、未洗脱的印迹电极和洗脱后的印迹电极置于10 mL背景液中按1.3.3.1节方法进行CV扫描,验证MIM聚合过程电极表面变化过程,结果如图4所示。[Fe(CN)6]3-在裸玻碳 电极(图4曲线a)、洗脱后的分子印迹膜电极(图4曲线b)上,均有一对明显的氧化还原峰,但分子印迹电极上得到的峰电流略小于裸电极,这是因为聚合膜致密的表面结构阻碍[Fe(CN)6]3-向电极表面扩散,[Fe(CN)6]3-只能通过印迹空穴扩散到电极表面进行氧化还原反应。而在聚合后的印迹电极(图4曲线c)上无氧化还原峰出现,是因为裸玻碳电 极(图4曲线a)表面形成的MIM阻碍了[Fe(CN)6]3-在底液和电极表面之间的电子传递,以致峰电流从a急剧降低至c。即聚合了未洗脱3-PBA的MIM电极由于膜阻碍[Fe(CN)6]3-的传递导电性弱,洗脱3-PBA后,[Fe(CN)6]3-可从印迹空穴传递,电极导电性恢复,这与用扫描电镜观察到的结果一致:在扫描电镜中可观察到MIM洗脱前为致 密的膜,而洗脱后膜上出 现许多空穴。
2.5 分子印迹膜制备条件的优化
2.5.1 聚合液pH值的影响
聚合液pH值是聚合膜形成过程的 重要影响因素,邻氨基酚在酸性溶液中能得到活性均 匀的膜[24]。实验研究了pH值分别为3.5、4.5、5.5、6.0、6.5、7.5的聚合液中所制得的MIM洗脱前后对铁氰化钾的电流响应变化,结果见图5。实验表明pH 3.5~6.0时,分子印迹膜的峰电流变化随着缓冲液pH值的增大而增大,当pH值大于6.0时分子印迹膜的峰电流变化呈下降趋势,说明聚合液pH值对聚合膜的峰电流值变化有较大影响。当pH 6.0时,洗脱前后的峰电流值变化最大,即印迹的3-PBA量最大,因此pH 6.0条件下进行印迹,可获得最多的印迹位点。
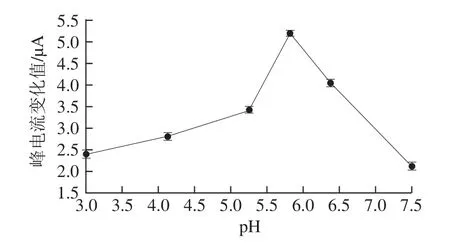
图5 聚合液pH值对分子印迹膜峰电流值变化的影响Fig.5 Effect of pH value of polymerization solution on the changes in peak current
2.5.2 功能单体和模板分子比例的影响
OAP单体与3-PBA模板分子的比例与分子印迹过程中识别 孔穴的产生关系密切,比例增大可使印迹分子进行充分预组装,但功能单体过量会使非选择性结合位点增多,且功能单体浓度过大会因自身的聚合而减少选择性结合位点数,因此适当比例的单体和模板分子对分子印迹膜的特异性、选择性具 有至关重要的影响[25]。实验研究了OAP单体与3-PBA模板的投入量比例分别为2∶1、3∶1、4∶1、5∶1时(保持3-PBA的浓度为10 mmol/L不变)所制得的MIM洗脱前后对铁氰化钾的峰电流值变化(图6),继而判断分子印迹聚合膜的性能变化。由图6可知,功能单体与模板分子比值偏低时,峰电流值变化偏小,这是由于过多的模板分子存在阻碍单体间的聚合,得到的 印迹位点少,不易形成聚合膜;而当功能单体与模板分子比值偏高时,峰电流值变化减小,这是由于单体之间的直接聚合以及印迹分子位点包埋导致洗脱后的印迹空穴数量少,不利于[Fe(CN)6]3-与电极表面之间的电子传递。当功能单体与模板分子比例为4:1时,制得的MIM洗脱后的峰电流值变化最大,制得的膜均匀、稳定且具有较好选择性,所以选定功能单体/模板分子比例4∶1作为最优比例。
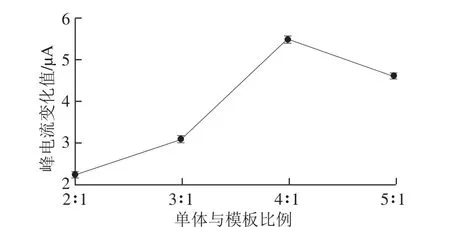
图6 单体与模板比例对 分子印迹膜峰电流值变化的影响Fig.6 Effect of monomer/template ratio on the changes in peak current
2.5.3 电聚合扫描圈数的影响
电聚合扫描圈数会影响印迹膜的厚度,从而影响电极表面识别位点的数量和聚合膜的导电性能,并最终影响印迹膜的印迹性能。本实验研究了电聚合扫描圈数为10、15、20、25时所制得的MIM洗脱12 h后对铁氰化钾的电流响应与洗脱前的差值,来推测电极表面识别位 点的数量。结果表明,扫描10圈时,聚合膜的峰电流变化小,说明电极表面可让[Fe(CN)6]3-向电极表面扩散的印迹空穴数量少,这可能是因为聚合时间过短,聚合在膜上的3-PBA较少,相应地洗脱后的空穴就较少或者是因为形成的膜较薄而不稳定(图7)。聚合15 圈制得的膜洗出的模板分子空穴最多,而20圈和25圈的电流变化值相比15 圈下降,可能是因为扫描圈数多,膜较厚,不易洗脱,从而阻碍了铁氰化钾探针分子的传质过程,因此选择扫描15 圈作为聚合扫描圈数。
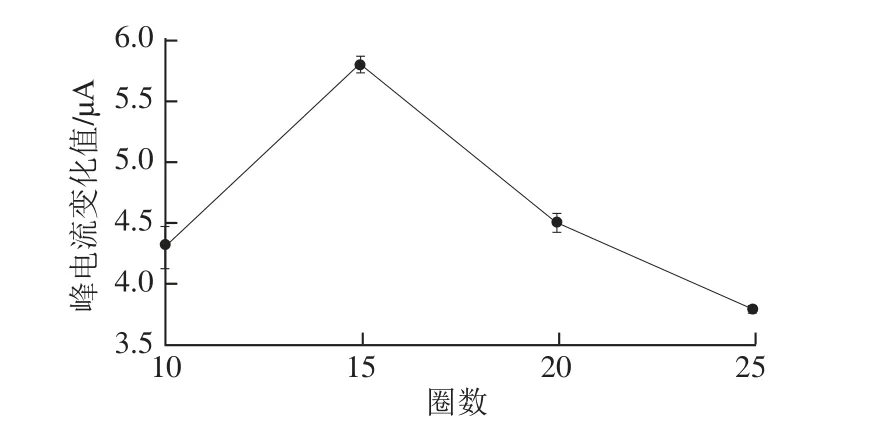
图7 扫描圈数对分子印迹膜峰电流值变化的影响Fig.7 Effect of number of scanning laps on the changes in peak current
2.5.4 洗脱溶剂、洗脱方式和洗脱时间的影响
分别用甲醇、二氯甲烷、甲醇-二氯甲烷、乙腈、乙腈与0.5 mol/L硫酸混合溶液作为洗脱溶剂,将印迹电极浸泡于磁力搅拌方式进行洗脱。将印迹电极于溶剂中浸泡磁力洗脱12 h后,于背景溶液中扫描,通过铁氰化钾峰电流的高低比较模板去除效果,模板未洗脱时,铁氰化钾无法通过不导电聚合膜到达电极表面,因此电流几乎为零。将电极在甲醇(图8曲线d)、二氯甲烷(图8曲线e)、甲醇-二氯甲烷(图8曲线f)、乙腈(图8曲线h)中浸泡12 h后,模板的去除效果均很不理想,结果如图8所示。0.5 mol/L硫酸与乙腈混合溶液(4∶1,V/V)作为洗脱溶剂时,洗脱效果最好,得到的电流响应信号最大。
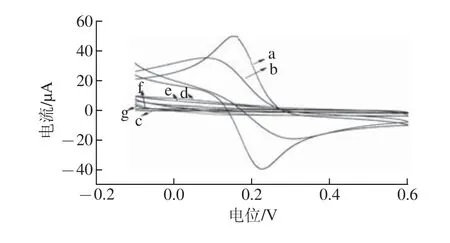
图8 印迹电极于不同洗脱剂溶液中的洗脱效果Fig.8 Effect of different elution solvents on removing the template
对洗脱液0.5 mol/L硫酸与乙腈混合溶液(4∶1,V/V)的最佳洗脱方式进行了研究,实验选择溶剂浸泡洗脱、超声洗脱和磁力搅拌洗脱3 种洗脱方式进行研究,结果表明溶剂浸泡洗脱耗时很长,浸泡洗脱24 h后电流信号仍基本为零,即洗出的模板分子少,得到的印迹空穴数量少;超声洗脱时间较短,整个洗脱过程只需10~15 min,但超声洗 脱后,将电极浸泡于间苯氧基苯甲酸标准液10 min后检测,峰电流值仍接近裸电极的电流响应值,即膜的印迹效果不好,这可能使是因为超声洗脱容易破坏印迹膜的表面结构,造成膜的破坏,减少了膜的可重复利用次数及稳定性。而聚合膜在磁力搅拌洗脱12 h后[Fe(CN)6]3-的还原峰电流值即保持恒定,其电流响应值接近裸电极的电流响应值。
2.6 分子 印迹膜的电化学分析特性
2.6.1 响应时间对膜特性影响
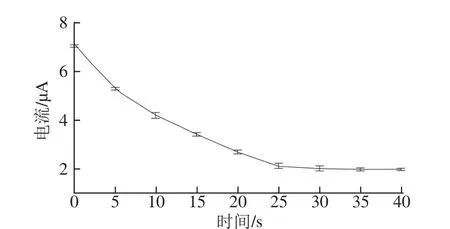
图9 铁氰化钾响应电流与吸附时间的关系Fig.9 Relationship between incubation time and response current
将洗脱了3-PBA后的印迹电极放入质量浓度为3 mg/L的3-PBA溶液中进行重吸附,结果见图9。由图9可知,在0~30 s时间范围内峰电流呈下降趋势,30 s后趋于平衡,说明随着重吸附时间延长,MIM上越来越多的分子印迹空穴被3-PBA占据,[Fe(CN)6]3-迁移到玻碳电极表面发生氧化还原的数目减少。因为3-PBA与印迹位点有完全相匹配的结构,因此MIM对3-PBA是特异性识别,响应速度极高,反应30 s后电极信号即达到稳定,因此,选定30 s为3-PBA的响应时间。
2.6.2 重复性和再生性
用研究确定的条件制备所得到印迹膜电极对3.0 mg/L的3-PBA溶液平行测定5 次考察印迹电极的重现性,相对标准偏差为1.21%。再用同一条件下制备的5只不同电极在3 mg/L的3-PBA溶液中测试不同批次间的重复性,其响应电流变化的相对标准偏差为2.8%,说明该技术制备的分子印迹膜电极重现性良好。
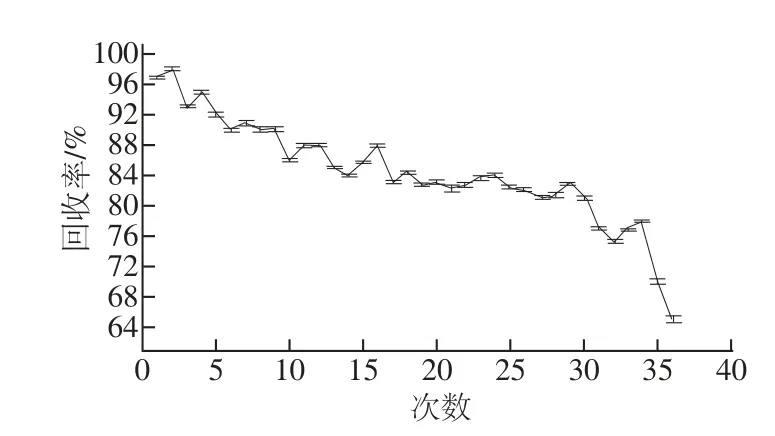
图10 分子印迹膜的再生性Fig.10 Renewability of electropolymerized molecularly imprinted fi lm
分子印迹膜的重复利用可大大降低检测成本,是优于免疫产品的一大特性。因此研究MIM电极的再生性具有重要意义。将测试过3-PBA的印迹电极进行再生-测试-再生循环处理,观察其对同一加标质量浓度3-PBA的响应情况,从图10可以发现,此印迹膜电极在连续使用30 次后,响应性降到初始值的81%。随着重复利用次数的进一步增加,膜电极响应逐渐降低。因此,研究制备的分子印迹膜可重复再生使用30次均保证回收率在80%以上。
2.6.3 选择性
由于3-PBA是拟除虫菊酯类农药的主要代谢产物之一,实验考察了其他不含3-PBA结构且代谢产物也无3-PBA的农药(不含3-PBA结构,或代谢产物无3-PBA)对分子印迹膜电极的干扰作用和MIM的选择性。本实验选取3-PBA的质量浓度为6 mg/L,对2 倍于3-PBA物质的量浓度的残杀威、乐果和久效磷3 种常用有机磷农药(代谢产物无3-PBA)进行了特异性和选择性实验。定义电流响应选择性系数为K(K=ΔI干扰物/ΔI’),其中ΔI干扰物为印迹电极对干扰物残杀威、乐果和久效磷的响应值,ΔI’为印迹电极对3-PBA的响应值。实验表明:2倍3-PBA浓度的残杀威、乐果和久效磷的K值分别为0.12、0.09、0.11,这说明不具备3-PBA结构的有机磷农药不影响3-PBA的检测,该MIM表现出对具有3-PBA结构的拟除虫菊酯类农药及其代谢产物3-PBA的良好选择性。
2.6.4 线性范围及检出限
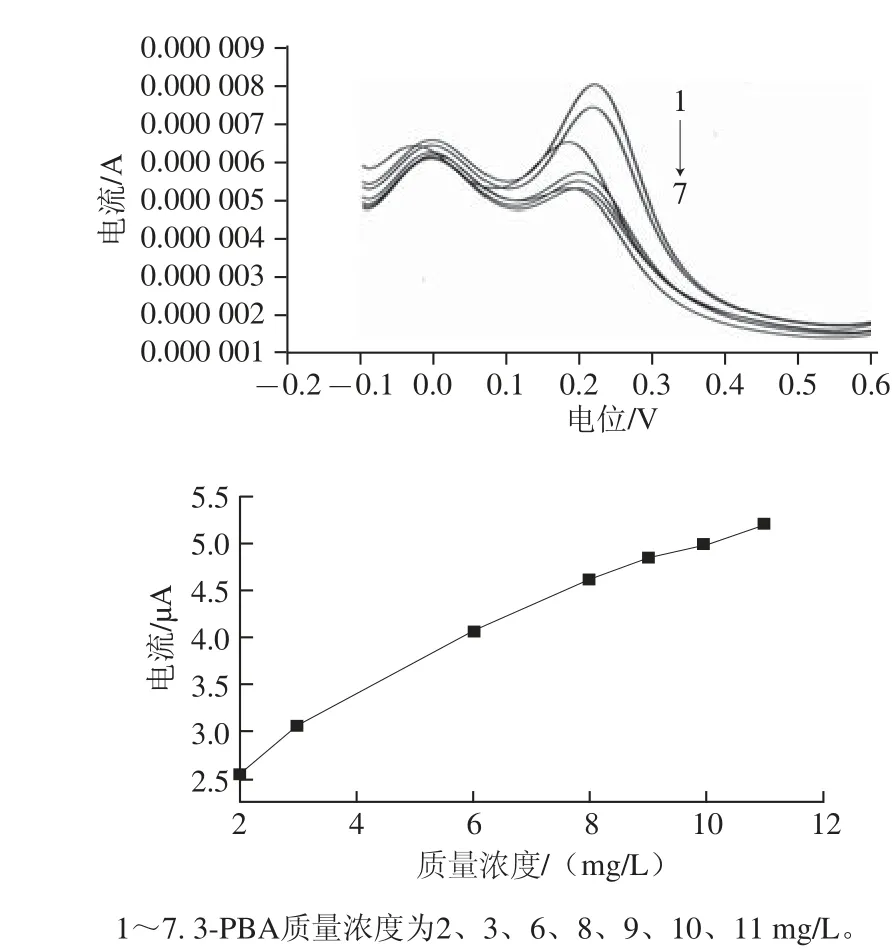
图11 分子印迹膜对不同质量浓度3-PBA的DPV响应Fig.11 DPV Response of MIM electrode to different concentrations of 3-PBA
将印迹后的工作电极浸入含一定质量浓度的3-PBA溶液中,按方法1.3.3.2节研究了MIM的检测范围,计算了方法检出限。由图11可知,随着测定液中3-PBA质量浓度的增大,[Fe(CN)6]3-离子还原峰电流逐渐减少,还原峰电流变化值呈上升趋势,在2.00~11.00 mg/L范围内,3-PBA质量浓度与MIM的响应电流变化值呈线性关系,线性方程为y=0.29x+2.16,相关系数为0.99,根据公式推算本方法检测3-PBA的检出限为1.47 mg/L,其中:xL是用该方法能检测出的3-PBA的最低检测质量浓度,即检出限;为测定时空白样品所得的背景电流还原峰值的平均值;Sb则为空白样品背景电流还原峰值的标准差。
2.7 样品分析与检测
采集农田水样3 份,分别命名为水样Ⅰ、Ⅱ、Ⅲ,按1.3.3.2节检测其中3-PBA,未检出3-PBA。
上述水样中加入3-PBA标准物进行加标回收实验,使水样Ⅰ、Ⅱ、Ⅲ中分别含3-PBA 3.00、6.00 mg/L和11.00 mg/L,用制备的MIM以1.3.3.2节对3-PBA进行测定,每个加标质量浓度平行测定3次,取平均值。结果见表1,测得的回收率为92.00%~101.00%,相对标准偏差在1.29%~2.00%之间,表明方法具有较高的准确性。
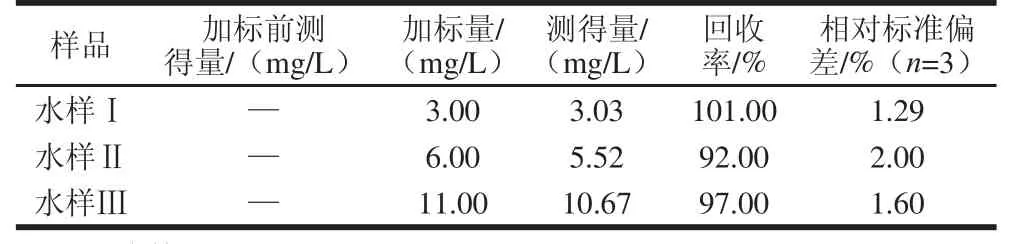
表1 水样中的加标回收率Table1 Recoveries for spiked water sample
3 结 论
本研究以间苯氧基苯甲酸3-PBA为模板分子,邻氨基酚OAP为功能单体,用循环伏安法制备合成了可用于3-PBA检测的分子印迹膜。通过对该分子印迹膜的制备过程进行了优化,发现当功能单体与模板分子比例为4∶1,聚合液pH 6.0,扫描圈数为15 圈,在0.5 mol/L硫酸与乙腈的混合溶液中(4∶1,V/V)磁力搅拌洗脱12h能得到性能较好的分子印迹膜。印迹膜具有吸附目标分子的特异性孔穴,可对3-PBA进行特异识别和监测,也可以间接监测具有3-PBA结构的拟除虫菊酯类农药及其代谢产物的含量,对有机磷农药具有抗干扰性。该MIM结合电化学检测应用于加标水样的测定,回收率92.00%~101.00%,准确度高,且MIM可再生重复利用30 次,单次再生与检测过程仅耗时20 min左右,相比GC-MS法[9-10]测定3-PBA而言,操作简单、步骤精简、时间大大缩短,可满足3-PBA快速检测的要求,但本研究方法的检出限与GC-MS等方法比有一定差距,有待进一步提高以便检测出环境中3-PBA的痕量残留,后续可开发研究相应配套使用的基于分子印迹膜的便携式电化学分析仪。
[1] SUN Hong, CHEN Wen, XU Xiaolin, et al. Pyrethroid and their metabolite, 3-phenoxybenzoic acid showed similar (anti) estrogenic activity in human and rat estrogen receptor α-mediated reporter gene assays[J]. Environmental Toxicology and Pharmacology, 2014, 37(1): 371-377.
[2] SUN Hong, XU Xiaolin, XU Lichun, et al. Antiandrogenic activity of pyrethroid pesticides and their metabolite in reporter gene assay[J]. Chemosphere, 2007, 66(3): 474-479.
[3] WIELOGÓRSKA E, ELLIOTT C T, DANAHER M, et al. Endocrine disruptor activity of multiple environmental food chain contaminants[J]. Toxicology in Vitro, 2014, 29: 211-220.
[4] ARORA D S, CHANDER M, GILL P K. Involvement of lignin peroxidase, manganese peroxidase and laccase in degradation and selective ligninolysis of wheat straw[J]. International Biodeterioration and Biodegradation, 2002, 50(2): 115-120.
[5] MCCOY M R, YANG Zheng, FU Xun, et al. Monitoring of total type Ⅱpyrethroid pesticides in citrus oils and water by converting to a common product 3-phenoxybenzoic acid[J]. Journal of Agricultural and Food Chemistry, 2012, 60(20): 5065-5070.
[6] TOPP E, AKHTAR M H. Identification and characterization of a Pseudomonas strain capable of metabolizing phenoxybenzoates[J]. Applied and Environmental Microbiology, 1991, 57(5): 1294-1300.
[7] MIYAMOTO J. The chemistry, metabolism and residue analysis of synthetic[J]. Pure and Applied Chemistry, 1981, 53(10): 1967-2002 .
[8] 秦文秀, 颜冬云, 王春光, 等. 拟除虫菊酯在底泥中的归趋及其生物效应①[J]. 土壤, 2011, 43(5): 703-709.
[9] MUDIAM M K R, CHAUHAN A, JAIN R, et al. Molecularly imprinted polymer coupled with dispersive liquid-liquid microextraction and injector port silylation: a novel approach for the determination of 3-phenoxybenzoic acid in complex biologicalsamples using gas chromatography-tandem mass spectrometry[J]. Journal of Chromatography B, 2014, 945: 23-30.
[10] KAVVALAKIS M P, TZATZARAKIS M N, ALEGAKIS A K, et a l. Development and application of GC-MS method for monitor ing of long-term exposure to the pesticide cypermethrin[J]. Drug Testing and Analysis, 2014, 6(Suppl 1): 9-16.
[11] HIROSAWA N, UEYAMA J, KONDO T, et al. Effect of DDVP on urinary excretion levels of pyrethroid metabolite 3-phenoxybenzoic acid in rats[J]. Toxicology Letters, 2011, 203: 28-32.
[12] AHN K C, GEE S J, KIM H J, et al. Immunochemical analysis of 3-phenoxybenz oic acid, a biomarker of forestry worker exposure to pyrethroid insecticides[J]. Analytical and Bioanalytical Chemistry, 2011, 401(4): 1285-1293.
[13] CHUANG J C, VANEMON J M, TREJO R M, et al. Biological mon itoring of 3-phenoxybenzoic acid in urine by an enzyme-linked immunosorbent assay[J]. Talanta, 2011, 83: 1317-1323.
[14] 董绍俊. 化学修饰电极[M]. 北京: 科学出版社 , 2003: 17-18.
[15] 栾崇林, 李铭杰, 李仲谨, 等. 胺 菊酯分子印迹电化学传感器的制备及性能[J]. 理化检验: 化学分册, 2011, 47(8): 885-893.
[16] LIU Yating, DENG Jian, XIAO Xilin, et al. Electrochemical sensor based on a poly (para-aminobenzoic acid) fi lm modifi ed glassy carbon electrode for the determination of mel amine in milk[J]. Electrochimica Acta, 2011, 56(12): 4595-4602.
[17] GONCALVES D, FARIA R C, YONASHIRO M, et al. Electrochemical oxidation of o-aminophenol in aqueous acidic medium: formation of film and soluble products[J]. Journal of Electroanalytical Chemistry, 2000, 487: 90-99.
[18] GUERRIERI A, CIRIELLO R, CENTONZE D. Permselective and enzyme-entrapping behaviours of an electropolymerized, nonconducting, poly (o-aminophenol) thin fi lm-modifi ed electrode: a critical study[J]. Biosensors and Bioelectronics, 2009, 24(6): 1550-1556.
[19] SHARMA P S, PIETRZYK-LE A, SOUZA F D, et al. Electrochemically synthesized polymers in molecular imprinting for chemical sensing[J]. Analytical and Bioanalytical Chemistry, 2012, 402: 3177-3204.
[20] 张爱强, 陈衍珍, 田昭武. 邻氨基酚电聚合 膜的研究[J]. 物理化学学报, 1991, 7(2): 146-150.
[21] 王阳. 基于多模板分子印迹聚合物电化学传感器的研究[D]. 无锡:江南大学, 2011.
[22] 杨涛, 焦奎, 杨婕, 等. 聚邻氨基酚/Ni2+修饰碳糊电极的制备及其对葡萄糖的电催化氧化[J]. 分析化学研究简报, 2006, 34(10): 1415-1418.
[23] SIMÕES M, MARTINS N, CABRITA M J, et al. Tailor-made molecularly imprinted polymers for dimethoate and deltamethrin recognition: synthesis, characterization and chromatographic evaluation[J]. Journal of Polymer Research, 2014, 21(3): 1-13.
[24] BARBERO C, SILBER J J, SERENO L. Electrochemical properties of poly-ortho-aminophenol modified electrodes in aqueous acid solutions[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1990, 291(1): 81-101.
[25] ZHOU Jie, HE Xiwen, LI Yijun. Binding study on 5,5-diphenylhydantoin imprinted polymer constructed by utilizing an amide functional group[J]. Analytica Chimica Acta, 1999, 394: 353-359.
Fabrication and Application of Electropolymerized Molecularly Imprinted Film for 3-Phenoxybenzoic Acid Detection
DAI Fangfang1, ZHOU Yao1, MA Liang1,2,3,*, GUO Xuexia4, ZHANG Yuhao1,2,5
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing 400716, China; 3. Laboratory of Risk Assessment for Citrus Quality and Safety, Ministry of Agriculture (Chongqing), Chongqing 400712, China; 4. Chinese Academy of Agricultural Engineering, Ministry of Agriculture, Beijing 100125, China; 5. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China)
This study aimed to develop a rapid and precise method for detecting 3-phenox ybenzoic acid (3-PBA) in environmental samples which can prov ide technical support for ecological ri sk asses sment of th e major pyrethroid metabolit e. Using o-aminophenol (OAP) as the monomer and 3-PBA as the template, a molecularly imprinted membrane (MIM) for 3-PBA detection by combination wit h electrochemical technology was formed on the sur face of glassy carbon electrode (GCE). The response to 3-PBA was completed in 30 s. The results showed that the relationship between peak current and 3-PBA concentration within the range of 2.00 mg/L to 11.00 mg/L was linear (the linear equation was y = 0.29x + 2.16) with a linear correlation coeffi cient of 0.99 and the limit of detection (LOD) was 1.47 mg/L. The recoveries were between 92.00% and 101.00% in spiked water samples.
3-phenoxybenzoic ac id; environmental pollution; molecularly impr inted membrane; electrochemistry
X592;S482.4
A
1002-6630(2015)20-0232-07
10.7506/spkx1002-6630-201520045
2014-12-22
重庆市科委重点课题(cstc2013 yykfB0165);中央高校基本科研业务费专项(XDJK2013B035;2362014xk11)
戴芳芳(1991—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:daiff19910326@163.com
*通信作者:马良(1979—),女,副教授,博士,研究方向为食品安全与检测。E-mail:zhyhml@163.com
