超高效液相色谱法检测药桑椹中1-脱氧野尻霉素
2015-12-21蒲俊松向仲怀杨光伟何宁佳
蒲俊松,陈 虎,向仲怀,杨光伟*,何宁佳*
(家蚕基因组生物学国家重点实验室,重庆 400715)
超高效液相色谱法检测药桑椹中1-脱氧野尻霉素
蒲俊松,陈 虎,向仲怀,杨光伟*,何宁佳*
(家蚕基因组生物学国家重点实验室,重庆 400715)
建立超高效液相色谱测定新疆药桑椹中1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)含量的方法。药桑椹粉经0.05 mol/L盐酸提取,在pH 8.5的硼酸盐缓冲液条件下,氯甲酸-9-芴基甲酯(9-fluorenylmethyl chloroformate,FMOC-Cl)与DNJ反应生成具有紫外吸收的络合物(DNJ-FMOC),然后采用超高效液相色谱-紫外检测器测定。液相色谱条件为CORTECSTMC18色谱柱(2.1 mm×100 mm,2.7 μm),流动相为乙腈-0.5%醋酸(28∶72,V/V),在流速0.6 mL/min、柱温28 ℃、检测波254 nm条件下检测。结果表明:DNJ与其他组分分离效果良好,方法检出限为0.1 μg/mL(RSN=3),线性范围在0.5~20 μg/mL,相关系数(r)为0.999 970,加标回收率平均为106.4%。精密度实验、稳定性实验、重复性实验以及回收率实验表明,该方法稳定可靠,可作为测定药桑椹中DNJ含量的有效方法。
药桑;1-脱氧野尻霉素;超高效液相色谱;紫外检测
药桑(Morus nigra Linn.)属桑科桑属黑桑种。药桑起源于伊朗,16世纪在我国新疆等地开始栽培,是我国唯一的黑桑种。目前也主要分布于新疆阿克苏、和田、吐鲁番和喀什等地区[1-4]。药桑桑椹是维吾尔族历代的民间药材,具有降低血糖、血脂的功效[5]。现代药理学研究证实药桑椹具有降三高(高血糖、高血脂、高血压)、抗氧化、抗肿瘤等药理作用[6-8]。药桑椹中含有黄酮、多糖、生物碱等多种活性成分[9-10],1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)是一种主要存在于桑树中的多羟基哌啶生物碱。其具有降血糖[11]、降血脂[12]、抗肿瘤[13]、抑制变形链球菌生长[14]、抗病毒[15]等功效。
作为降血糖的重要活性成分,DNJ含量可以作为桑制品降血糖效果的质量指标,也是进一步筛选富含DNJ的桑资源重要依据[16],因而需要开发一种可靠的DNJ检测方法。目前,DNJ的检测方法主要分为两类,一类是碘-碘化钾分光光度法[17],该方法步骤少,所需试剂易得,仪器要求不高,但是精确度不高;另一类是色谱法,又分为气相色谱法[18]和液相色谱法,高效液相色谱法为常用分析方法。按照配备的检测器不同,高效液相色谱法分为蒸发光散射检测法[19]、荧光检测法[20]、紫外检测法[16]和质谱检测法[21]。除蒸发光散射检测法精确度相对较差,其他3 种方法检测结果准确、稳定、可靠。
近年来基于小颗粒填料、低系统体积及快速检测等技术发展的超高效液相色谱法,具有快速高效、高分离度等特点[22],现已广泛应用于食品、药物中各类物质的分析检测。目前国内外还没有采用超高效液相色谱法检测桑树中DNJ的方法报道。本研究通过优化反应条件,确定最佳仪器分析条件,建立了超高效液相色谱-紫外检测器法测定药桑椹中DNJ的方法。
1 材料与方法
1.1 材料与试剂
药桑椹由新疆和田蚕研所提供,采自和田不同地区;果桑椹采自西南大学桑树品种资源圃。材料于60 ℃烘干至质量恒定,粉碎机粉碎,过40 目筛,置干燥器中冷冻备用。
DNJ(纯度≥98%,CAS:19130-96-2) 北京恒元启天化工技术研究院;氯甲酸-9-芴基甲酯(9-fluorenylmethyl chloroformate,FMOC-Cl,纯度≥99.0%,色谱纯)、甘氨酸(纯度≥99%) 美国Sigma公司;乙腈、甲醇、醋酸(均为色谱纯) 美国Thermo Fisher Scientifi c公司。
1.2 仪器与设备
DHG-9140A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;FA2004B电子天平 上海精天电子仪器有限公司;KQ-500DV数控超声清洗器 昆山市超声仪器有限公司;CT15RE冷冻离心机 日本Hitachi公司;ACQUITY超高效液相色谱、I-Class色谱仪(配紫外检测器及Empower 3工作站) 沃特世科技(上海)有限公司;GX-03 150 g功能粉碎机 浙江高鑫工贸有限公司。
1.3 方法
1.3.1 样品的提取
精确称取待测桑椹粉1 g,加入50 mL 0.05 mol/L HCl溶液,混匀后30 ℃水浴超声10 min,提取液在20 ℃条件下10 000×g离心5 min,收集上清液,沉淀物再按上述步骤重复提取1 次,合并上清液,超纯水定容至100 mL,即得样品提取液。
1.3.2 DNJ标准液的配制
取DNJ标准品一瓶(20 mg),用10 mL 0.05 mol/L HCl溶液溶解,摇匀配为2 mg/mL的DNJ标准液。用时将DNJ标准液配制成0.5、2、8、12、16、20 μg/mL备用。
1.3.3 DNJ的衍生化
取DNJ提取液(或DNJ标准液)100 μL于1.5 mL的离心管,加入0.4 mol/L硼酸钾缓冲液(pH 8.5)100 μL,再加入5 mmol/L的FMOC-Cl(溶解于乙腈中)200 μL,混匀后,20 ℃水浴20 min,加入1 mol/L的甘氨酸100 μL中和剩余的FMOC-Cl终止反应,加入1%的醋酸溶液100 μL使衍生物稳定,而后加入超纯水400 μL稀释,以0.22 μm针头式过滤器过滤,即得测试液。
1.3.4 色谱条件
色谱柱:CORTECSTMC18(2.1 mm×100 mm,2.7 μm);紫外检测器,检测波长:254 nm;流动相:乙腈-0.5%醋酸(28∶72,V/V);流速:0.6 mL/min;柱温:28 ℃;进样量:1 μL。
2 结果与分析
2.1 流动相的选择及其比例的优化
实验比较乙腈和不同体积分数醋酸溶液作为流动相的分离效果,结果显示较高的醋酸体积分数能够改善色谱峰的对称性,综合考虑选择乙腈-0.5%醋酸溶液作为色谱分析时的流动相。DNJ衍生物为弱极性,随着乙腈比例的降低,流动相极性增加,洗脱能力变弱,目标物的保留时间也会随之延长,这有助于目标物与杂质的分离。当乙腈-0.5%醋酸(50∶50,V/V)时,因杂质干扰,目标物不能有效的分离,最后逐渐降低乙腈的比例,能够有效分离目标物;当乙腈-0.5%醋酸(28∶72,V/V)时,目标物的峰形良好,分离度为3.4。因此流动相比例选用乙腈-0.5%醋酸(28∶72,V/V)。
2.2 测试样品的超高效液相色谱图谱
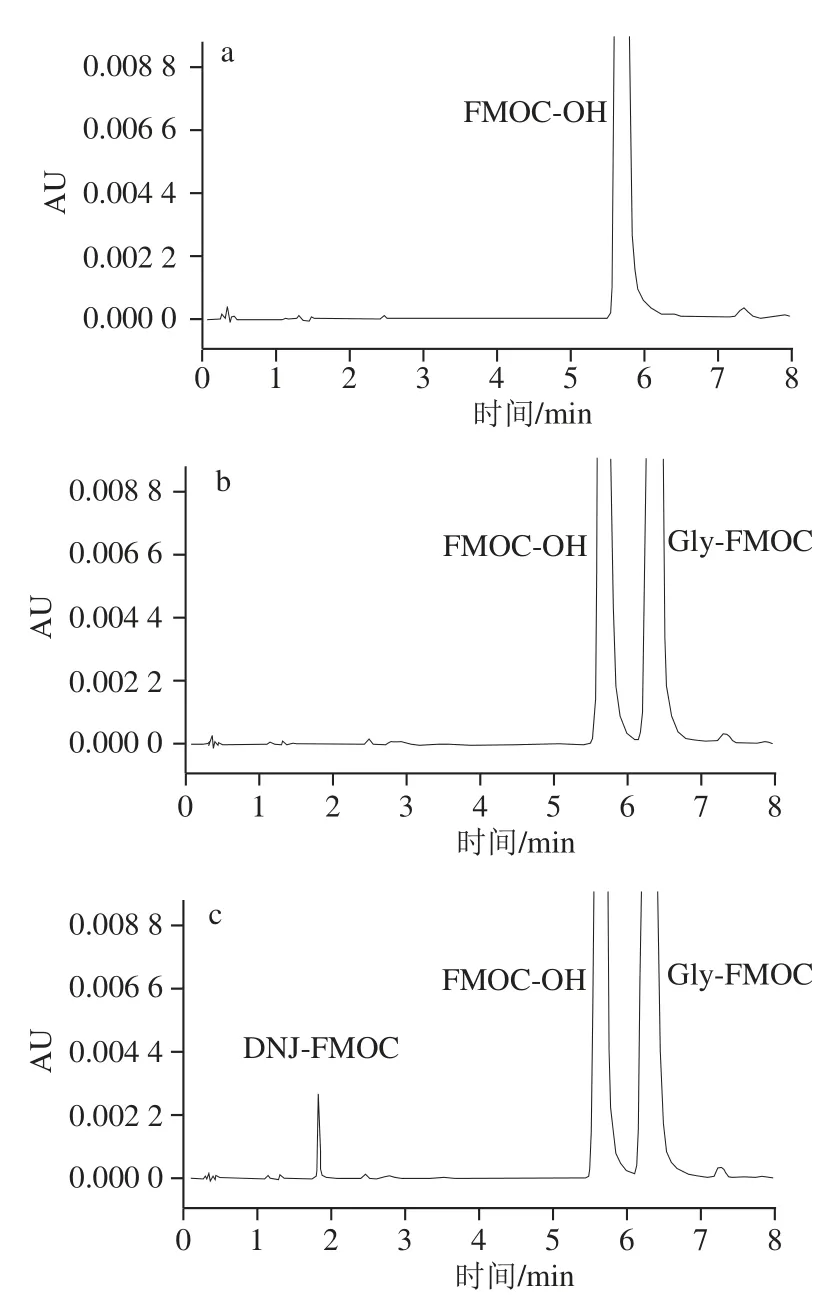

图1 DNJ标准品及药桑椹提取液色谱图Fig.1 Chromatograms of DNJ standard and black mulberry fruit sample
分别对DNJ标准品及桑椹提取液进行超高效液相色谱分析。如图1所示,图1c中DNJ标准品有3 个主色谱峰,但在进行衍生化反应时,若只加FMOC-Cl,不加Gly和DNJ,则仅出现FMOC-OH色谱峰(图1a);只加Gly和FMOC-Cl进行衍生化反应,则只出现FMOC-OH和Gly-FMOC色谱峰(图1b);通过分析第1个色谱峰峰面积与DNJ标准品的质量浓度,发现其呈线性关系。由此可以断定,图1c中3 个色谱峰依次分别为DNJ-FMOC、FMOC-OH、Gly-FMOC。
2.3 DNJ的线性关系
将DNJ标准溶液质量浓度梯度按1.3.3节的方法进行衍生化反应,反应液在上述色谱条件下进行超高效液相色谱-紫外检测器分析,以色谱峰面积(y)与标准品质量浓度(x)绘制标准曲线。结果表明,DNJ的质量浓度与色谱峰面积呈良好的线性关系,经回归分析,二者的回归方程为y=872x-13.1,相关系数r=0.999 970,方法检出限为0.1 μg/mL(RSN=3)。
2.4 精密度和重复性
取同一供试品溶液,分别进样测定6 次,分别测定DNJ的峰面积值,计算相对标准偏差(relative standard deviation,RSD)为1.32%(n=6),说明本测定方法精密度符合要求。按1.3节方法操作取桑椹粉6 份,进行超高效液相色谱分析,根据峰面积值,并对照标准曲线计算样品中的DNJ含量,如表1所示,6 次测定的平均含量为0.623 4 mg/g,其RSD为1.00%(n=6)。表明本方法的重复性良好。
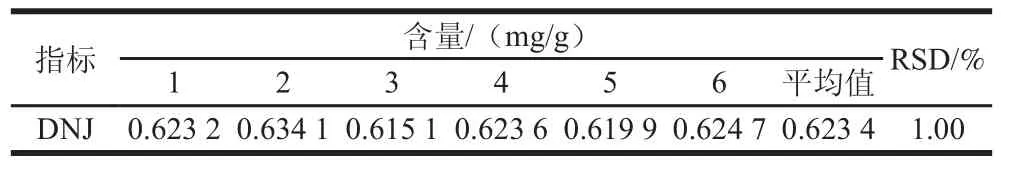
表1 重复性实验结果Table1 Results of repeatability test
2.5 稳定性实验结果
取桑椹粉提取液进行衍生化反应,分别间隔0、4、8、16、24、48 h进样,共进样6 次。测定结果表明,DNJ-FMOC的峰面积基本一致,计算DNJ峰面积的RSD为2.40%(n=6)。实际上在室温条件放置一周后再次测定,DNJ-FMOC的峰面积也无显著变化。
2.6 加标回收率
取测定过DNJ含量的桑椹粉6 份,每份0.5 g,分别加入0.4 mg/mL标准品溶液1 mL,按1.3节方法制备样品液和进行衍生反应。超高效液相色谱分析测定DNJ含量,计算加标回收率。如表2所示,测定发现平均加标回收率为106.4%,RSD为2.43%。此结果表明,本测定方法符合加标回收率的要求。
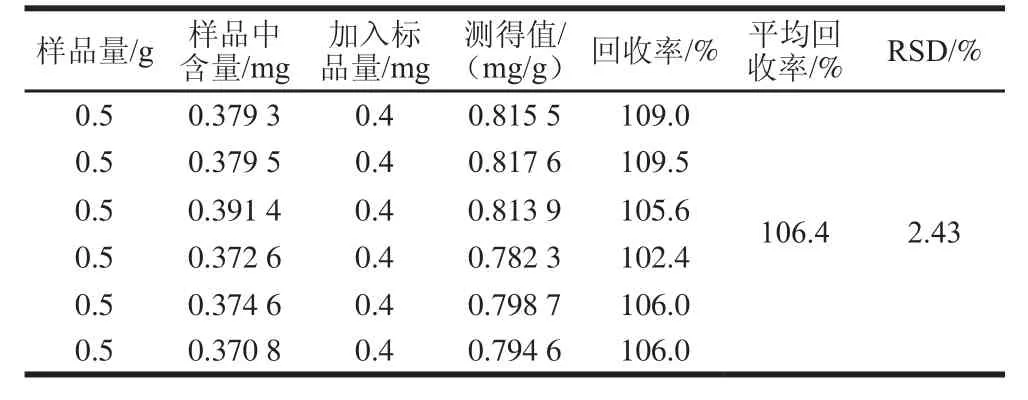
表2 加标回收率实验结果Table2 Results of recovery rate test
2.7 桑椹样品DNJ含量测定
表3 7 种桑椹样品中DNJ含量测定Table3 The contents of DNJ in seven cultivars of mulberry fruit (x± s) mg/g
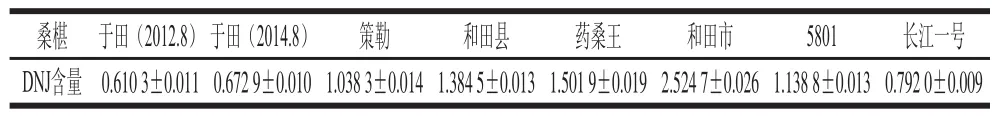
表3 7 种桑椹样品中DNJ含量测定Table3 The contents of DNJ in seven cultivars of mulberry fruit (x± s) mg/g
桑椹于田(2012.8)于田(2014.8)策勒和田县药桑王和田市5801长江一号DNJ含量0.610 3±0.011 0.672 9±0.010 1.038 3±0.014 1.384 5±0.013 1.501 9±0.019 2.524 7±0.026 1.138 8±0.013 0.792 0±0.009
对7 种桑椹中DNJ含量进行测定,结果如表3所示。前5 种都是药桑椹,采自新疆不同地区,其中包括了2012年和2014年8月采于于田的药桑椹。药桑王为单棵,因其栽培历史悠久而得名。5801和长江一号两种是果桑,采自西南大学桑树品种资源圃。从表3可以看出,产自于田2012年和2014年的药桑椹中DNJ含量相差不大,初步表明同一地区不同时间的药桑椹中DNJ含量稳定。而不同地区药桑椹中DNJ的含量差异较大,其中和田市的含量最高,是于田的4 倍。和田县、药桑王和和田市的药桑椹中DNJ的含量均高于刘凡[23]、肖明[24]等检测桑叶、桑叶茶中DNJ的含量。Kimura等[25]研究表明DNJ给药剂量为60 kg人体质量6 mg时能够抑制高血糖,和田市产药桑椹DNJ含量为2.524 7 mg/g干质量,按药桑椹含水量80%[1],每次食用12 g鲜果就能达到抑制高血糖的效果。
3 结 论
本实验建立了超高效液相色谱-紫外检测器测定药桑椹中DNJ含量的方法。 目前已有不少关于桑树中DNJ检测方法的报道,大多为高效液相色谱法。与传统的高效液相色谱相比,超高效液相色谱具有更快的分离速率、更高的分辨率和灵敏度[26]。高效液相色谱的方法不能完全适用于超高效液相色谱的分析,其中流动相的比例对物质的分离起着重要的作用。在本实验中,DNJ衍生物为弱极性,随着乙腈和0.5%醋酸溶液比例的降低,流动相的极性增强,洗脱能力减弱,分离能力变强,利于目标物与杂质的分离,但是检测时间也更长。即是如此,本方法也能在8 min内完成检测,相对于目前报道的最快速的DNJ检测方法(12 min完成检测)[20],其检测效率提高33%。当流动相比例为乙腈-0.5%醋酸(28∶72,V/V),DNJ峰形良好,分离度达到了3.4。且本方法流速低,能够减少有机溶剂的消耗,进样量少,节省样品。通过方法学验证,该方法具有良好的精密度、重复性和稳定性,能够满足分析要求。
随着果汁类饮料的风行和以桑椹为原材料的功能性食品的开发,DNJ作为该类产品的主要功能性成分,其含量直接影响该类产品的品质。药桑是新疆乃至中东地区独特稀贵的药用果桑种质资源[1],药桑椹为维吾尔族历代的民间药材,具有很高的开发价值,可作为新疆地区特有的果桑品种种植,对药桑椹的开发更能促进新疆的经济发展。近几年关于桑叶中DNJ的研究报道较多,针对桑椹的DNJ含量及差异研究较少,本研究填补了这一空白,所建立的超高效液相色谱检测药桑椹中DNJ的方法,快速、简便、定量准确,适合桑椹样品中DNJ的快速定量检测,为药桑椹的开发提供科学依据。
[1] 买买提依明. 新疆药桑的研究[J]. 北方蚕业, 2007, 28(1): 1-3.
[2] 张帆, 张刚, 陆承志. 维药药桑的研究与应用[J]. 传统医药, 2007, 16(20): 61.
[3] 江岩. 新疆黑桑椹多糖超声提取工艺优选[J]. 中国酿造, 2009, 28(3): 138-140.
[4] 江岩, 李斌, 郭晓军. 新疆黑桑椹多糖的提取和测定[J]. 食品科学, 2008, 29(8): 224-226.
[5] 卢红, 丁天龙, 吴曙光, 等. 新疆药桑的药用价值及在维吾尔医药中的应用[J]. 蚕业科学, 2011, 37(6): 1098-1101.
[6] 杨小兰, 毛立新, 张晓云. 黑桑椹的营养成分和抗氧化作用的研究[J].食品科学, 2006, 27(2): 248-250.
[7] 杨小兰, 毛立新, 张晓云. 黑桑椹对高脂血症大鼠的降脂作用研究[J].食品科学, 2005, 26(9): 509-5l0.
[8] 庞宗然, 裴凌鹏. 药桑不同提取物对2型糖尿病大鼠的治疗作用[J].中国老年学杂志, 2009, 29(21): 2733-2735.
[9] 蒋昊, 徐立, 刘峻池, 等. 药桑的生物活性成分及药理作用研究进展[J].蚕业科学, 2011, 37(1): 98-104.
[10] 买买提依明, 卢红, 木合达尔, 等. 新疆药桑的有效成分测定及药理作用的研究初报[J]. 北方蚕业, 2006, 27(4): 16-18.
[11] CHALUNTORN V, KIYOTAKA N, PHUMON S, et al. Development of high 1-deoxynojirimycin (DNJ) content mulberry tea and use of response surface methodology to optimize tea-making conditions for highest DNJ extraction[J]. Food Science and Technology, 2012, 45(2): 226-232.
[12] KOJIMA Y, KIMURA T, NAKAGAWA K, et al. Effects of mulberry leaf extract rich in 1-deoxynojirimycin on blood lipid profiles in humans[J]. Journal of Clinical Biochemistry and Nutrition, 2010, 47(2): 155-161.
[13] WANG R J, YANG C H, HU M L. 1-Deoxynojirimycin inhibits metastasis of B16F10 melanoma cells by attenuating the activity and expression of matrix metalloproteinases-2 and -9 and altering cell surface glycosylation[J]. Journal of Agriculture and Food Chemistry, 2010, 58(16): 8988-8993.
[14] ISLAM B, KHAN S N, HAQUE I, et al. Novel anti-adherence activity of mulberry leaves: inhibition of Streptococcus mutans biofilm by 1-deoxynojirimycin isolated from Mours alba[J]. Journal of Antimicrobial Chemotherapy, 2008, 62(4): 751-757.
[15] JACOB J R, MANSFIELD K, YOU J E, et al. Natural iminosugar derivatives of 1-deoxynojirimycin inhibit glycosylation of hepatitis viral envelope proteins[J]. Journal of Microbiology, 2007, 45(3): 431-440.
[16] 施新琴, 崔为正, 裘立群, 等. 用反相高效液相色谱-紫外检测法测定1-脱氧野尻霉素的含量[J]. 蚕业科学, 2006, 32(1): 146-149.
[17] 杨海霞. 桑叶中DNJ分离纯化及含量测定的研究[D]. 杭州: 浙江大学, 2003.
[18] 李宏, 钱永华, 王建芳, 等. 桑叶中1-脱氧野尻霉素(DNJ)的气相法测定[J]. 北方蚕业, 2006, 37(3): 31-32.
[19] KIMURA T, NAKAGAWA K, SAITO Y, et al. Simple and rapid determination of 1-deoxynojirimycin in mulberry leaves[J]. Biofactors, 2004, 22(1/4): 341-345.
[20] KIM J W, KIM S U, LEE H S, et al. Determination of 1-deoxynojirimycin in Morus alba L. leaves by derivatization with 9-fluorenylmethyl chloroformate followed by reversed-phase highperformance liquid chromatography[J]. Journal of Chromatography A, 2003, 1002: 93-99.
[21] NUENGCHAMNONG N, INGKANINAN K, KAEWRUANG W, et al. Quantitative determination of 1-deoxynojirimycin in mulberry leaves using liquid chromatography-tandem mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 44(4): 853-858.
[22] YU K, LITTLE D, PLUMB R, et al. High-throughput quantifi cation for a drug mixture in rat plasma-a comparison of ultra performance liquid chromatography/tandem mass spectrometry with highperformance liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2006, 20(4): 544-552.
[23] 刘凡, 李平平, 廖森泰, 等. 98 份不同桑树品种资源的桑叶总生物碱及1-脱氧野尻霉素含量测定[J]. 蚕业科学, 2012, 38(2): 185-191.
[24] 肖洪, 黄先智, 沈以红, 等. 响应面法优化提高发酵桑叶茶中1-脱氧野尻霉素含量工艺[J]. 食品科学, 2014, 35(10): 46-51. doi: 10.7506/ spkx1002-6630-201410009.
[25] KIMURA T, NAKAGAWA K, KUBOTA H, et al. Food-grade mulberry powder enriched with 1-deoxynojirimycin suppresses the elevation of postprandial blood glucose in humans[J]. Journal of Agricultural and Food Chemistry, 2007, 55: 5869-5874.
[26] 郝桂明, 唐素芳. 超高效液相色谱在药物分析中的应用[J]. 天津药学, 2009, 21(6): 64-69.
Determination of 1-Deoxynojirimycin in Black Mulberry Fruit by Ultra Performance Liquid Chromatography
PU Junsong, CHEN Hu, XIANG Zhonghuai, YANG Guangwei*, HE Ningjia*
(State Key Laboratory of Silkworm Genome Biology, Chongqing 400715, China)
The contents of 1-deoxynojirimycin (DNJ) in the fruits of black mulberry (Morus nigra L.) were measured using ultra performance liquid chromatography (UPLC). Dried fruits were pulverized and extracted with 0.05 mol/L HCl, and then incubated with 9-fl uorenylmethyl chloroformate (FMOC-Cl) in pH 8.5 borate buffer to produce the complex DNJ-FMOC. The concentration of DNJ-FMOC was detected by UPLC coupled with UV detector. A CORTECSTMC18column was used and the column temperature was kept at 28 ℃. The mobile phase was acetonitrile-0.5% acetic acid solution (28:72, V/V) with a fl ow rate of 0.6 mL/min. The UV detection wavelength was 254 nm. The results indicated that DNJ was separated well with a linearity ranging from 0.5 to 20 μg/mL. The limit of detection (LOD) was 0.1 μg/mL and the correlation coeffi cient (r) between the peak area of DNJ-FMOC and DNJ concentration was 0.999 970 and the average recovery from spiked samples was 106.4%. The tests for precision, stability, reproducibility and recovery rate showed that the method was stable and reliable, and could be used as an effective method for the determination of DNJ content in black mulberry fruits.
Morus nigra L.; 1-deoxynojirimycin; ultra performance liquid chromatography; UV detection
TS207.5
A
1002-6630(2015)20-0207-04
10.7506/spkx1002-6630-201520040
2015-01-09
国家高技术研究发展计划(863计划)项目(2013AA100605);国家农业部公益性行业2003科研专项(201403064)
蒲俊松(1990—),男,硕士,研究方向为植物化学。E-mail:466342842@qq.com
*通信作者:杨光伟(1958—),男,研究员,博士,研究方向为植物生理。E-mail:yanggw@swu.edu.cn
何宁佳(1971—),女,教授,博士,研究方向为功能基因组与分析生物学。E-mail:hejia@swu.edu.cn
