离子色谱法测定黑果枸杞中的甜菜碱
2015-12-21耿丹丹肖远灿胡风祖
耿丹丹,谭 亮,肖远灿,胡风祖,董 琦,*
(1.中国科学院西北高原生物研究所,青海 西宁 810008;2.中国科学院大学生命科学学院,北京 100049)
离子色谱法测定黑果枸杞中的甜菜碱
耿丹丹1,2,谭 亮1,肖远灿1,胡风祖1,董 琦1,*
(1.中国科学院西北高原生物研究所,青海 西宁 810008;2.中国科学院大学生命科学学院,北京 100049)
建立黑果枸杞中甜菜碱的离子色谱测定法。采用Metrosep C4阳离子分析柱(150 mm×4.6 mm,4 μm),柱温为38.5 ℃,1.5 mmol/L甲烷磺酸溶液为流动相,流速为0.8 mL/min,电导检测器。结果表明,甜菜碱在10.4~830.0 mg/L质量浓度范围内线性关系良好(R2=0.999 8),加标回收率在95.51%~98.06%(n=3)之间。所建方法操作简便、重复性好,适用于黑果枸杞中甜菜碱含量测定。
离子色谱;黑果枸杞;甜菜碱
黑果枸杞(Lycium ruthenicum Murr.)为茄科(Solanaceae)枸杞属(Lycium)多年生灌木,分布于我国陕西北部黄土高原、宁夏、甘肃、青海、内蒙古、新疆和西藏等地区,中亚、高加索和欧洲等地区亦有分布[1]。《晶珠本草》、《四部医典》记载,藏医以其成熟果实入药,治疗心热病、心脏病、月经不调、停经等病症,并且药效明显,民间用作滋补强壮、明目及降压药[2-3]。甜菜碱是黑果枸杞中主要药效成分之一,在体内起甲基供体的作用,具有抗脂肪肝、降压、抗肿瘤等作用[4-5]。
甜菜碱是一种季铵型生物碱,具有良好的理化性状和较好的稳定性及抗氧化能力。其化学结构与氨基酸、胆碱相似具有多种生物学功能,广泛应用于饲料添加剂、医药工业、农林业生产、食品添加剂、日化等领域[6-10]。目前测定甜菜碱含量的方法包括:酸碱滴定法、凯氏定氮法、紫外分光光度法、高氯酸非水滴定法、高效液相色谱法、离子色谱法等。杨雪等[11]比较了甜菜碱含量的测定方法,发现离子色谱法测定甜菜碱含量更准确、更方便。离子色谱法在检测甜菜碱方法中有着令人满意的结果,显示出良好的应用前景[12-18]。
目前,采用离子色谱法测定黑果枸杞中甜菜碱含量尚未见报道。本实验建立了离子色谱法测定黑果枸杞甜菜碱的含量,该方法操作简单、重复性和准确性好、成本低[11,17],对黑果枸杞的质量标准研究提供了一定方法支撑,为黑果枸杞资源的研究与开发利用提供了理论依据。
1 材料与方法
1.1 材料与试剂
收集不同产地的7 批黑果枸杞样品,经中国科学院西北高原生物研究所马世震副研究员鉴定为黑果枸杞。将新鲜黑果枸杞通风处阴干,粉碎后置干燥器中保存。样品信息见表1。

表1 样品信息Table1 Information about the samples used in this study
甜菜碱标准品(供含量测定用) 中国食品药品检定研究院;甲磺酸(纯度不小于98%) 国药集团化学试剂有限公司;三氯甲烷和正丁醇均为分析纯;超纯水(电阻率不小于18.2Ω·M)实验室自制。
1.2 仪器与设备
930系列智能集成型离子色谱仪(配备930 Compact IC Flex蠕动泵,945 Professional Detector Vario电导检测器) 瑞士Metrohm公司;TGL-16C型高速台式离心机上海安亭科学仪器厂;AG135型精密电子天平 瑞士MettlerToledo公司;KQ-100E型超声波清洗器 昆山超声仪器科技公司;优普UPE-Ⅱ-40L型超纯水机 上海优普实业有限公司。
1.3 方法
1.3.1 溶液的配制
淋洗液:准确称取甲磺酸2.88 g,置于1 000 mL容量瓶中,加纯水稀释至刻度,摇匀,配制成30 mmol/L甲磺酸溶液。准确吸取50 mL该溶液,加纯水定容至1 000 mL,摇匀。0.45 μm滤膜过滤,备用。
标准品储备液:准确称取甜菜碱对照品适量,置于10 mL容量瓶中,加纯水溶解并稀释至刻度,摇匀,配制成质量浓度0.83 mg/mL甜菜碱标准品储备液,置于4 ℃冰箱中,备用。
1.3.2 色谱条件
淋洗液:甲磺酸溶液;色谱柱:Metrosep C4阳离子分析柱(150 mm×4.6 mm,4 μm);检测器:电导检测器;流速:0.8 mL/min;柱温:38.5 ℃;进样量:20 μL。
1.3.3 样品前处理
称取枸杞样品粉末约3 g,精密称定(准确至0.001 g),置于具塞三角瓶中,加入80 mL水,超声提取30 min,过滤至100 mL容量瓶中,静置10 min,定容至刻度,摇匀。取2 mL滤液于离心管中,加入2 mL Sevag试剂[17-19](三氯甲烷-正丁醇,4∶1,V/V),剧烈振荡使其充分混合,在9 000 r/min转速条件下离心5 min,弃去中间变性蛋白层和下层有机层,上层水相继续重复上述操作直至水相与有机相中间无变性蛋白出现为止。移取上层清液,过0.45 μm滤膜后测定。
2 结果与分析
2.1 样品前处理方法选择
在利用离子色谱法对黑果枸杞样品中甜菜碱的测定时,起干扰作用的杂质主要有花青素和蛋白质。色素和蛋白质过多会对离子色谱柱造成严重损害,因此实验过程中必须进行脱色以及除蛋白质处理。比较Sevag法[19-21]及三氯甲烷除蛋白方法[22]:分别于5 mL离心管中加入2 mL三氯甲烷溶液和Sevag试剂,然后加入2 mL黑果枸杞样品溶液,剧烈振荡后离心,取上层清液对比溶液颜色变化。结果可知,利用Sevag试剂处理过的样品溶液颜色明显浅于三氯甲烷处理后的样品溶液,且色谱图中目标峰处杂质干扰明显降低。所以,本实验采用Sevag试剂作为样品前处理溶剂。
2.2 色谱条件的选择
2.2.1 检测方式的选择
由于甜菜碱是一种季铵型生物碱,在酸性条件下,可以电离成阳离子,在电导检测器条件下有电导响应。因此,选择电导检测器作为检测方式。
2.2.2 色谱条件的优化
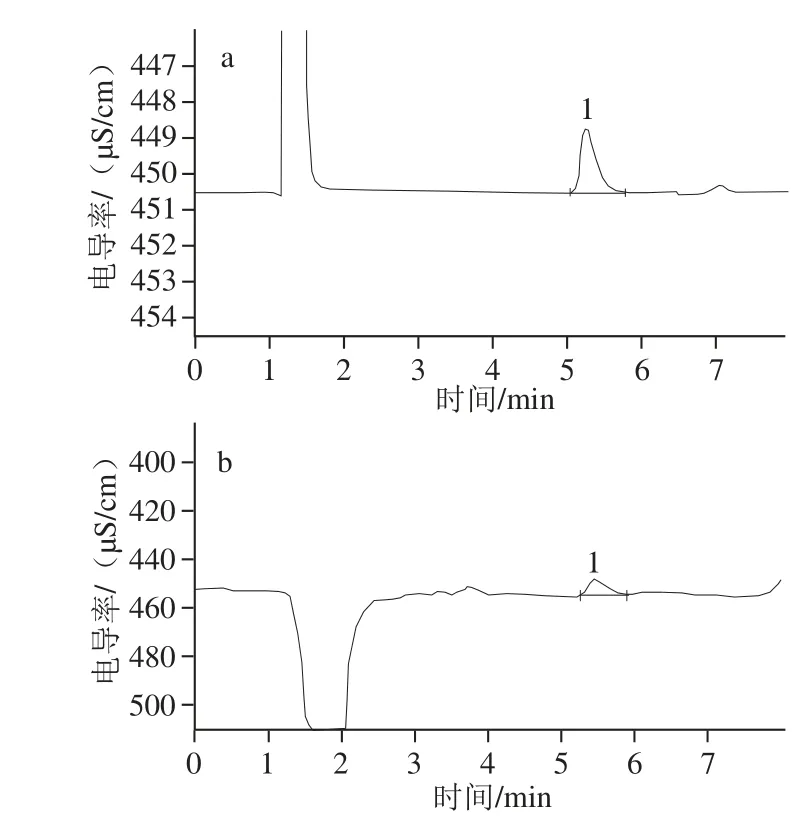
图1 标准品和样品色谱图Fig.1 Ion chromatograms of betaine standard (a) and betaine sample from Lycium ruthenicum Murr. (b)
为了排除样品中除甜菜碱之外的其他阳离子干扰,选择阳离子分析常用的淋洗强度较强的甲磺酸溶液作为淋洗液[23-25]。考察淋洗液的浓度、流速对甜菜碱色谱峰的影响,发现提高淋洗液的浓度时,保留较弱的甜菜碱与干扰离子不能完全分离,最终确定甲磺酸淋洗液浓度为1.5 mmol/L,流速为0.8 mL/min。标准品和样品色谱图分别见图1a和图1b。
2.3 线性关系和重复性
以峰面积为纵坐标对甜菜碱质量浓度(mg/L)为横坐标绘制标准曲线。结果得回归方程为y=0.004 4x-0.021 5(R2=0.999 8),甜菜碱标准品质量浓度在10.4~830.0 mg/L范围内线性关系良好。
对方法的重复性进行考察,分别称取6 份黑果枸杞样品约3 g,精密称定(准确至0.001 g),按1.3.3节处理,1.3.2节测定峰面积,并计算相对标准偏差(relative standard deviation,RSD)。结果显示,样品中甜菜碱峰面积的RSD为3.25%,表明此方法重复性良好。
2.4 检出限和定量限
采用逐级稀释标准品溶液的方法确定检出限和定量限,得到甜菜碱的检出限和定量限分别为60 mg/kg和200 mg/kg。
2.5 回收率
采用加样回收法,在9 份已知甜菜碱含量的样品中按低、中、高质量浓度分别精密加入甜菜碱标准溶液,每一质量浓度3 份,并按1.3.3节处理,1.3.2节测定峰面积,计算平均回收率和RSD,测定结果见表2。加标回收率落在95.51%~98.06%之间,RSD均小于1.14%。
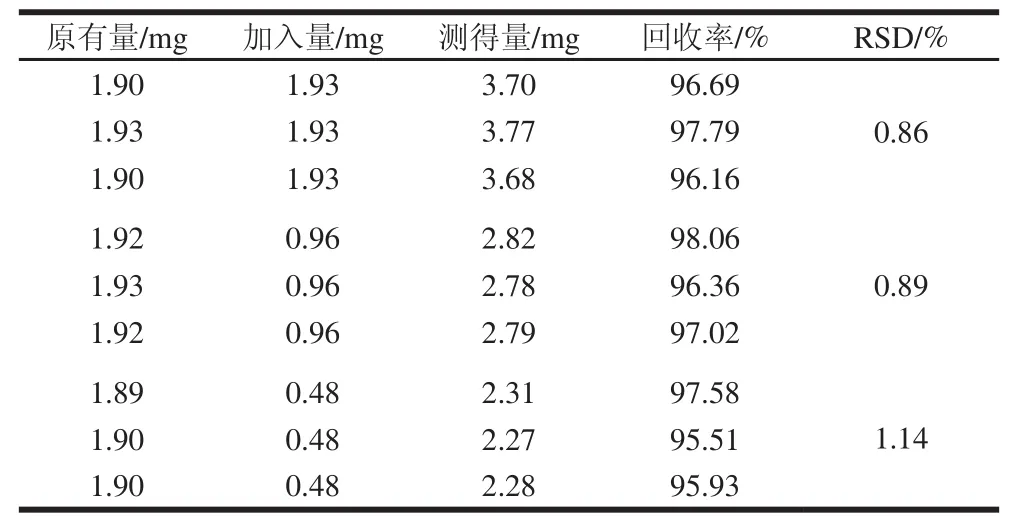
表2 加标回收率及RSD(n =3)Table2 Recovery and RSD in spiked samples (n = 3)
2.6 样品的含量检测结果
根据实验选定的方法,对7 批不同产地的黑果枸杞样品进行色谱分析,结果见表3。甘肃民勤县黑果枸杞中甜菜碱含量最高为19.58 mg/g,青海格尔木市最低为9.44 mg/g。

表3 样品分析结果(n=3)Table3 Betaine contents of real samples (n = 3)
3 结 论
本实验建立离子色谱法检测黑果枸杞中甜菜碱的方法,并对新疆、青海、甘肃3 地7 批不同产地的黑果枸杞中甜菜碱进行含量测定。结果表明,该方法灵敏度高、准确性好、操作简单。本研究结果可为黑果枸杞质量标准的制定提供理论依据。
[1] 匡可任, 路安民. 中国植物志[M]. 北京: 科学出版社, 1978: 10.
[2] 钱颜丛, 宇文萍. 枸杞子化学成分及药理研究新进展[J]. 中医药学报, 2000, 28(4): 33-35.
[3 ] 刘勇民. 维吾尔药志: 下[M]. 乌鲁木齐: 新疆科技卫生出版社, 1999: 478-485.
[4] 谢忱, 徐丽珍, 李宪铭. 枸杞子化学成分研究[J]. 中国中药杂志, 2001, 26(5): 323-324.
[5] 张宇金, 高世勇, 何立巍. 甜菜碱的生物活性研究[J]. 哈尔滨商业大学学报: 自然科学版, 2006, 22(1): 13-16.
[6] 李慧. 甜菜碱的作用及测定方法[J]. 吉林畜牧兽医, 2012, 33(6): 24-26.
[7] 张立新, 李生秀. 甜菜碱与植物抗旱/盐性研究进展[J]. 西北植物学报, 2004, 24(9): 1765-1771.
[8] 朱振鹏, 孙晓先. 甜菜碱在畜牧业上的应用[J]. 饲料与畜牧, 2013(4): 29-31.
[9] 杨东元, 王亚红, 郑岚. 药用甜菜碱柠檬酸盐的合成研究[J]. 西北大学学报, 2010, 40(2): 265-268.
[10] 张晨光, 潘见, 黄文平. 离子色谱直接电导法检测糖蜜中的甜菜碱[J].食品科学, 2012, 33(1): 208-210.
[11] 杨雪, 王洪荣, 邹益东. 甜菜碱含量的测定方法比较[J]. 饲料工业, 2013, 34(7): 48-51.
[12] 王婷, 王存进, 杜晓磊. 离子色谱法测定饲料中的甜菜碱[J]. 化学分析计量, 2013, 22(5): 61-63.
[13] SUO Decheng, LI Lan, ZHANG Su. Simulataneous determination of choline, carnitine and betaine in premixes by non-suppressed ion chromatography[J]. Analytical Methods, 2013, 5(1): 59-63.
[14] SHI Haining, WANG Zonghua, WANG Hui. Determination of glycolate acid, mono-and dichloroacetic acids in synthetical betaine by anion-exchange chromatography[J]. Chinese Journal of Chemistry, 2011, 29(4): 778-782.
[15] ZHANG Jiajie, ZHU Yan. Determination of betaine, choline and trimethylamine in feed additive by ion-exchange liquid chromatography/non-suppressed conductivity detection[J]. Journal of Chromatography A, 2007, 1170(1): 114-117.
[16] KALSOOM U, BREADMORE M C, GUIJT R M, et al. Evaluation of potential cationic probes for the detection of proline and betaine[J]. Electrophoresis, 2014, 35(23): 3379-3386.
[17] 张自萍, 郭荣, 廖国玲. 枸杞甜菜碱含量测定方法的比较研究[J]. 西北农业学报, 2007, 16(6): 292-295.
[18] 朱怀远, 庄亚东, 熊晓敏. 离子色谱法直接测定食品添加剂中的甜菜碱[J]. 食品科学, 2012, 33(2): 173-176.
[19] JI Y B, ZHANG J, YU M, et al. Study on methods of removing protein from crude crinum polysaccharide[C]// International Conference on Biological Engineering and Biomedical. Yichang, 2014: 358-366.
[20] 张萍, 贺茂萍, 殷力. 石榴皮多糖的Sevage法除蛋白工艺研究[J]. 食品科技, 2013, 38(12): 219-231.
[21] 郝博慧, 杨鑫, 马莺. 蕨麻Sevage法脱蛋白工艺研究[J]. 食品工业科技, 2011, 32(2): 254-258.
[22] 王婷, 王存进, 杜晓磊. 离子色谱法测定饲料中的甜菜碱[J]. 化学分析计量, 2013, 22(5): 61-63.
[23] 杨一青, 李慧琴, 许晓菁. 非抑制离子色谱法检测甜菜碱的含量[J].精细石油化工, 2013, 30(4): 79-82.
[24] 彭绪玲, 姜振邦, 李仁勇. 离子色谱法同时测定PM2.5中的5 种阳离子和3 种有机胺[J]. 化学分析测量, 2014, 23(增刊1): 52-54.
[25] 郑德敏. 有机酸淋洗液的非抑制型离子色谱法测定有机胺[J]. 哈尔滨师范大学自然科学学报, 2002, 10(4): 67-70.
Determination of Betaine in Lycium ruthenicum Murr. by Ion Chromatography
GENG Dandan1,2, TAN Liang1, XIAO Yuancan1, HU Fengzu1, DONG Qi1,*
(1. Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining 810008, China; 2. College of Life Sciences, University of Chinese Academy of Sciences, Beijing 100049, China)
An ion chromatography coupled with conductivity detection method was developed for the determination of betaine in Lycium ruthenicum Murr.. The analyte was separated on a Metrosep C4cation exchange column (150 mm × 4.6 mm, 4 μm) by using methane sulfonic acid (1.5 mmol/L) as mobile phase. The fl ow rate was 0.8 mL/min at a column temperature of 38.5 ℃. It was found that the linearity range of betaine was 10.4-830.0 mg/L (R2= 0.999 8) and the spiked recoveries varied in the range of 95.51%-98.06%. The proposed method was found to be simple, reproducible and suitable for the determination of betaine in L. ruthenicum.
ion chromatography; Lycium ruthenicum Murr.; betaine
O657.75
A
1002-6630(2015)20-0145-03
10.7506/spkx1002-6630-201520027
2015-01-21
中国科学院仪器功能开发技术创新项目(Ig201308)
耿丹丹(1990—),女,硕士研究生,研究方向为天然产物与药物分析。E-mail:gengdandan110@163.com
*通信作者:董琦(1980—),女,工程师,硕士,研究方向为食品化学。E-mail:qdong@nwipb.cas.cn
