花生内源过敏原蛋白Ara h 2的分离纯化及鉴定
2015-12-21朱青青张文举上海大学生命科学学院上海200444
朱青青 张文举 蔡 琴 陈 沁(上海大学生命科学学院,上海 200444)
近年来,食物过敏引起了人们的广泛关注。据世界粮农组织(FAO)1995年报告,90%以上的食物过敏是由牛奶、蛋、鱼、甲壳类水产动物、花生、大豆、坚果类和小麦引起的[1],其中花生致敏人数占食物过敏的59%[2],相对于其他过敏原而言,花生过敏具有长期性、普遍性,甚至威胁生命等特点。目前国际免疫联合会命名小组委员会认可的花生过敏原有11种,其中Ara h 1、Ara h 2、Arah 3、Ara h 6属于主要过敏原,可被90%花生过敏患者识别[3]。而Ara h 2被认为是致敏性最强的花生过敏原之一,其cDNA序列全长为477bp,编码158个氨基酸,分子量17~20kD,pI为5.2,约占花生蛋白总量的10%[4]。Ara h 2有Ara h 2.01和Ara h 2.02两个亚型[5],称为同种异型物,Ara h 2.02比 Ara h 2.01多1个由12个氨基酸构成的IgE结合表位,因此其致敏性可能更严重[6]。
为深入研究花生过敏机理,获得大量高纯度的花生Ara h 2蛋白是关键。对于Ara h 2的分离纯化方法已有很多报道,如 Burks[7,8]、张英坤[9]等通过花生脱脂,离子交换层析等方法分离得到Ara h 2蛋白。由于脱脂时使用的有机溶剂丙酮等可能会使蛋白质变性或沉淀[10,11],在本研究中花生不经过脱脂,粗提蛋白直接过DEAE-Sepharose Fast Flow阴离子交换柱,并用SDS-PAGE和 MALDI—TOF/MS分离、纯化并鉴定目的蛋白,为进一步开展花生过敏原Ara h 2致敏机理研究提供试验材料。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
花生:四粒红,购于上海市某大型超市;
预染Marker:天根生化科技(北京)有限公司;
DEAE-Sepharose Fast Flow预装柱:博格隆(上海)生物技术有限公司。
1.1.2 主要仪器
垂直板型电泳槽:PowerPacTMBasic型,美国BIO-RAD公司;
蛋白纯化仪:AKTA Purifier型,美国General Electric公司;
恒温磁力搅拌器:81-2型,上海志威电器有限公司;
超微量分光光度计:NanoDrop 2000型,上海在途生物科技有限公司;
高速多功能粉碎机:HCP-200型,上海旗箭粉碎机公司;
台式高速冷冻离心机:Biofuge Stratos型,德国贺利氏有限公司。
1.2 试验方法
1.2.1 花生总蛋白的提取及SDS—PAGE分析 花生去红衣,组织破碎后液氮研磨,得花生粉末。5g花生粉末浸于100mL,20mmol/L,pH 8.2Tris—HCl缓冲液中,4℃磁力搅拌3h,5 000×g,4℃冷冻离心5min,上清于25 000×g再次离心30min,上清液经0.45μm过滤膜过滤得蛋白提取液,-20℃保存,备用。
将提取得到的花生蛋白粗提液进行SDS—PAGE电泳分析[12,13]:采用不连续体系SDS—PAGE电泳平板凝胶,浓缩胶浓度为5%(pH 6.8),分离胶浓度为19%(pH 8.8),80V恒压电泳30min后,120V恒压跑电泳。电泳结束后,经考马斯亮蓝R250染色、醋酸脱色。
1.2.2 DEAE-Sepharose Fast Flow阴离子交换层析 据文献[14]报道花生蛋白Ara h 2等电点为5.2左右,采用阴离子交换树脂DEAE-Sepharose Fast Flow(16mm×250mm)进行分离。20mmol/L,pH 8.2Tris—HCl平衡4~5个柱体积,流速2mL/min;花生蛋白上柱后,先用 Tris—HCl(20mmol/L,pH 8.2)漂洗至基线,再用0~1mol/L NaCl连续梯度洗脱(流速2mL/min),280nm检测紫外吸收峰,自动收集器收集洗脱蛋白。
将收集到的洗脱蛋白溶液置于透析袋中,透析3次,每次2h。经3kD Milipore超滤管4℃下浓缩,备用。
1.2.3 Ara h 2蛋白的回收及得率的测定 纯化后的目的蛋白溶液经SDS—PAGE电泳,KCl染色后割下目的条带,切成细小胶条置于透析袋中进行恒压(100V,2h)水平电泳,结束后置于20mmol/L,pH 8.2Tris—HCl中透析4h,离心,收集上清液与花生纯化后蛋白进行SDS—PAGE电泳,进行比较对照,鉴定回收结果。
1.2.4 MALDI—TOF/MS鉴定Ara h 2蛋白 将纯化的蛋白进行SDS—PAGE电泳,考马斯亮蓝染色,醋酸脱色后,切下目的条带,冷冻保存。送至复旦大学蛋白质组中心进行MALDI—TOF/MS质谱鉴定。质谱条件:激发波长335nm,加速电压20kV,一级质谱误差100mg/L,二级质谱误差0.6kD。
2 结果与分析
2.1 花生粗提蛋白SDS—PAGE分析
花生经液氮研磨、浸提、离心后获得蛋白粗提物,SDS—PAGE电泳检测结果如图1所示,蛋白电泳检测到至少10条主蛋白条带,Ara h 1(65kDa)和 Ara h 3(14~45kDa不等)含量较高,其中检测到分子量约为18kD和20kD的两个目的条带,与已报道[15]的Ara h 2分子量相吻合。

图1 花生蛋白粗提物电泳结果Figure 1 SDS—PAGE of extraction products of crude peanut proteins
2.2 DEAE-Sepharose Fast Flow阴离子交换层析法分离Ara h 2蛋白
在pH 8.2的条件下,花生中带正电荷和不带电的蛋白首先随缓冲液洗出,带负电的则由于其带电大小不同与DEAE-Sepharose Fast Flow结合能力有所不同。在洗脱过程中,随NaCl离子强度增大,带负电的蛋白依次被洗脱下来。将收集到的洗脱蛋白溶液进行SDS—PAGE电泳,从而确定目的蛋白Ara h 2被洗脱下来时NaCl浓度,电泳结果见图2(b),表明目的蛋白 Ara h 2在0.2~0.3mol/L NaCl(图2(a)箭头所指位置)时被洗脱下来,且随着NaCl离子强度的增大,洗脱蛋白溶液中Ara h 2的含量逐渐增大后又逐渐减少。收集目的蛋白含量较大的洗脱溶液用以回收。
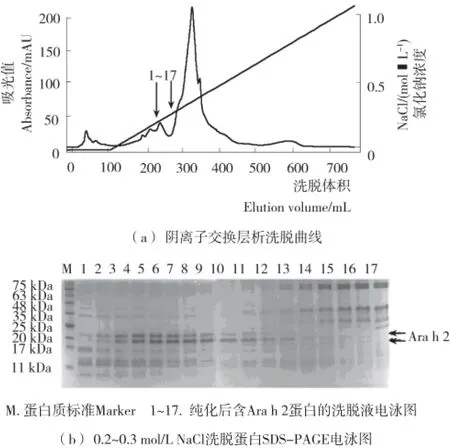
图2 阴离子交换层析分离纯化花生过敏原Ara h 2Figure 2 Purification of peanut allergen Ara h 2by anion-exchange chromatography
2.3 电泳回收Ara h 2蛋白及其得率计算
由图2(b)可知,纯化后含目的蛋白Ara h 2的溶液中有少量杂带,因此,进行SDS—PAGE电泳后割胶回收以进一步纯化。由图3可知,目的蛋白得到富集,蛋白密度扫描该蛋白纯度>95%(图略),表明SDS—PAGE电泳回收Ara h 2蛋白的方法可行,此法可迅速获得一定量纯度较高的Ara h 2蛋白。经过计算,花生Ara h 2蛋白在粗提、纯化、回收各步骤的蛋白得率见表1,纯化后目的蛋白的回收率可达到18.6%。

图3 电泳回收纯化后蛋白电泳图Figure 3 SDS—PAGE of recovered purification protein
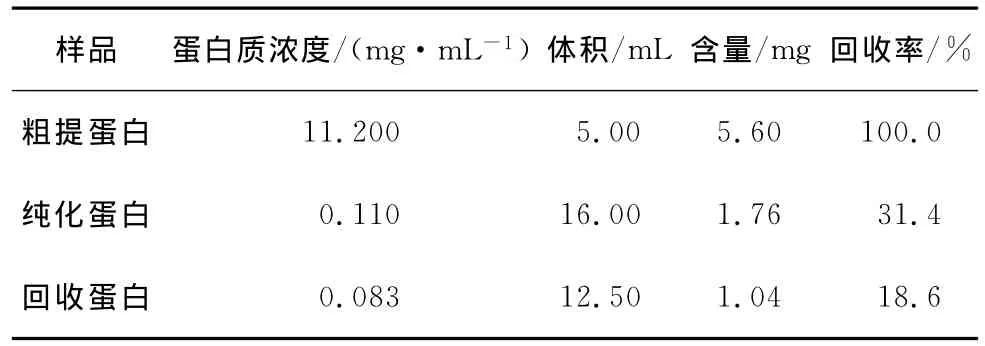
表1 花生过敏原Ara h 2各步骤得率Table 1 Recovery rate of peanut allergen Ara h 2 in every step
2.4 花生过敏原Ara h 2的质谱鉴定
采用 MALDI—TOF/MS测得肽质量指纹谱(PMF),并在数据库中查询识别的方式鉴定蛋白质,是目前蛋白质组学研究中最普遍应用的蛋白鉴定方法。本研究对目的蛋白Ara h 2进行 MALDI—TOF/MS分析得到一个一级质谱(图4)和7个二级质谱(图略)。根据一级和二级质谱数据使用GPS Explore软件(软件版本号:V3.6,ABI)进行分析,分析结果使用 MASCOT(软件版本号:V2.1,Matrix Science,U.K)搜库软件对NCBlnr数据库比对。目的蛋白Ara h 2的两个同系物 Ara h 2.01,Ara h 2.02分别与登录号gi|224747150和gi|26245447具有100%同源性,分子质量分别为18.5kD和20.1kD,肽段序列比对结果见表2,表明本研究得到的纯化蛋白即为花生过敏原蛋白Ara h 2。

表2 花生过敏原Ara h 2质谱鉴定肽段序列比对结果Table 2 Comparison of peptides in peanut allergen Ara h 2 by mass spectroscopy

图4 花生过敏原Ara h 2MALDI—TOF/MS质谱图Figure 4 MALDI—TOF/MS spectrum of peanut allergen Ara h 2
3 讨论
离子交换层析主要是利用各蛋白所带电荷不同即与层析柱结合能力的不同,通过增强洗脱液离子浓度,将各蛋白分离开来。通过对比每管收集量、洗脱速度和洗脱时间对纯化结果的影响,发现每管收集量越大,目的蛋白浓度越小,则混入杂蛋白的可能性越大;洗脱速度太慢,很多目的蛋白很难被洗下来;洗脱时间越短,NaCl浓度增大越快,则会导致目的蛋白还没来得及收集就和其他蛋白一起洗脱下来。由图2可知,0.2~0.3mol/L NaCl线性洗脱时得到目的蛋白,而该 NaCl浓度与罗春萍[16]、Lehmann[17]等的研究不同。原因可能是阴离子交换柱、填料等购买厂家不同,蛋白质与交换柱结合能力略有差异导致结果不同;Lehmann在分离纯化Ara h 2时使用强阴离子交换柱,目的蛋白在0.15mol/L NaCl时线性洗脱下来。
本研究采用DEAE-Sepharose Fast Flow弱阴离子交换柱,发现分辨率更好,但目的蛋白得率略低,可能是因为两个原因:① 部分蛋白混入其他管中,由于浓度太小没有收集;②在使用超滤管浓缩时,由于Ara h 2含有很多疏水基团,会非特异性地结合到滤膜上,造成蛋白损失。本研究采用0~1mol/L NaCl连续梯度洗脱,增强离子浓度而降低蛋白与介质电荷,从而得到连续的洗脱蛋白,较之阶段洗脱离子浓度跨度大能更好地分离纯化蛋白。
4 结论
花生过敏问题日益得到人们的关注,为深入研究花生过敏原的致敏特性及其免疫学功能,获得纯化的花生过敏原蛋白是关键。本试验以新鲜花生为原料,采用阴离子交换层析及SDS—PAGE电泳回收的方法纯化回收得到高纯度(95%)的花生过敏原蛋白Ara h 2,此方法简单、快速,易操作。经SDS—PAGE电泳和 MALDI—TOF—MS检测鉴定目标蛋白为Ara h 2两个同系物,分子量分别为18.5kD和20.1kD。为进一步开展Ara h 2蛋白的后续研究提供了依据。
1 何强.天然食品原料中的过敏原及其控制方法研究进展[J].食品与机械,2013,29(6):253~256.
2 Li Hao,Yu Jian-mei,Ahmedna M,et al.Reduction of major peanut allergens Ara h 1and Ara h 2,in roasted peanuts by ultrasound assisted enzymatic treatment[J].Food Chemistry,2013,141(2):762~768.
3 Mueller G A,Gosavi R A,Pomés A.Ara h 2:crystal structure and IgE binding distinguish two subpopulations of peanut allergic patients by epitope diversity[J].Allergy,2011,66:878~885.4 Schppi G F,Konrad V,Imhof D,et al.Hidden peanut allergens detected in various foods:findings and legal measures[J].Allergey,2001,56(12):1 216~1 220.
5 Apostolovic D,Luykx D,Warmenhoven H.Reduction and alkylation of peanut allergen isoforms Ara h 2and Ara h 6;characterization of intermediate-and end products[J].Biochimica et Biophysica Acta,2013,1 834(12):2 832~2 842.
6 韩远龙,吴志华,李璞,等.花生过敏原结构及加工研究进展[J].食品科学,2013,34(8):310~315.
7 Burks A W,Williams L W,Helm R M,et al.Identification of a major peanut allergen,Ara hⅠ,in patient with atopic dermatitis and positive peanut challenges[J].Allergy Clin.Immunol,1991,88(2):172~179.
8 Burks A W,Williams L W,Connaughton C,et al.Identification of a major peanut allergen,Ara hⅡ,in patient with atopic dermatitis and positive peanut challenges[J].Allergy Clin.Immunol,1992,90(6):962~969.
9 张英坤,陈红兵.离子交换层析法分离花生过敏原Ara h 2的研究[J].食品科学,2006,27(12):259~262.
10 吴海强,余晓,刘志刚.食品过敏原指纹图谱快速检测研究(三)——花生总蛋白2-DE指纹图谱和蛋白点 MALDI—TOF/MS分析[J].热带医学杂志,2006,6(3):271~273.
11 Koppelman S J,Vlooswijk R A A,Knippels L M J,et al.Quantification of major peanut allergens Ara h 1and Ara h 2in the peanut varieties Runner,Spanish,Virginia and Valencia,bred in different parts of the world[J].Allergy,2001,56(2):132~137.
12 何伟逸,吴序栎,刘志刚,等.阴离子交换层析法分离纯化花生主要过敏原Ara h 1的研究[J].现代食品科技,2013,29(4):768~771.
13 宋宏新,刘立新,柏红梅,等.牛乳中蛋白质的电泳分析技术研究[J].食品与机械,2010,26(6):51~53.
14 张雅军,张浩,杨选,等.花生主要致敏物质及其脱敏方法研究进展[J].食品科学,2014,35(17):312~318.
15 William Palmer G,Dibbern Jr D A,Wesley Burks A,et al.Comparative potency of Ara h 1and Ara h 2in immunochemical and functional assays of allergenicity[J].Clinical Immunology,2005,115(3):302~312.
16 罗春萍,高金燕,胡纯秋,等.花生过敏原Ara h 6的分离纯化及鉴定[J].食品科学,2010,31(15):76~80.
17 Lehmann K,Hoffmann S,Neudecker P,et al.High-yield expression in Escherichia coli,purification,and characterization of properly folded major peanut allergen Ara h 2[J].Protein Expression and Purification,2003,31(2):250~259.
