纳米磁性四氧化三铁固定脂肪氧合酶的研究
2015-12-21丁文武曹汝毅孙铭珍夏云空西华大学生物工程学院四川成都6009山东师范大学历山学院山东济南5004四川大学生命科学学院四川成都6009
丁文武 曹汝毅 孙铭珍 夏云空(.西华大学生物工程学院,四川 成都 6009;.山东师范大学历山学院,山东 济南 5004;.四川大学生命科学学院,四川 成都 6009)
脂肪氧合酶是一类较为常见的酶,应用前景广阔,可用于染料、涂料和洗涤剂等工业化生产[1-3]。然而,由于脂肪氧合酶在动植物中含量低、分离纯化难导致其价格高,稳定性也较差,难以在工业上广泛应用。将酶固定化可以加强酶的稳定性,并可以重复利用从而降低生产成本。因此,酶固定化技术一直是酶应用研究领域中一项引人注目且非常重要的课题[4]。
用于固定化酶的载体和方法有很多,其中采用磁性微球固定化酶,不仅会大大提高酶的稳定性[5],而且利用载体具有磁性的特点可以组装成磁性流化床或固定床反应器,有利于固定化酶的进一步应用[6],因此磁性微球固定化酶的研究成为许多研究者[7-9]青睐的课题。目前,用于固定化酶的主要载体之一是纳米Fe3O4。纳米Fe3O4的制备方法有多种,如水热法、溶胶—凝胶法和共沉淀法等[10]。此外,由于纳米Fe3O4离子具有非常大的比表面积以及比表面能,从而导致其在制备以及应用过程中极易发生团聚,进而严重影响其使用,因此必须对其进行表面改性以消除影响[11]。将酶固定在磁性微球上的方法主要有吸附法和共价法等[12],尽管酶的固定化方法很多,但到目前为止,很难找到一种适用于各种酶的固定化方法,因此,研究并找到适宜的固定化方法仍是固定化酶研究的热点课题[13]。
本研究拟通过水热法制备纳米磁性Fe3O4,并用SiO2和KH550对粒子进行表面修饰得到纳米磁性载体,然后用交联法固定脂肪氧合酶,研究影响酶活的因素,讨论固定方法的适宜性,以便为该酶找到合适的固定化方法,从而为其进一步的应用研究提供参考。
1 材料与方法
1.1 材料及仪器
1.1.1 材料与试剂
硝酸钾、氢氧化钾、七水合硫酸亚铁、无水乙醇、正硅酸四乙酯、氨水、亚油酸等:分析纯,国药集团化学试剂有限公司;
石油醚:化学纯,天津市富宇精细化工有限公司;
戊二醛、过氧化氢:分析纯,成都市科龙化工试剂公司;
Tween-20(CP):分析纯,天津市科密欧化学试剂有限公司;
KH550:化学纯,浙江新安有机硅试剂有限公司。
1.1.2 主要仪器设备
pH计:PHS-25CW型,上海般特仪器制造有限公司;
电热恒温水浴锅:DK-S28型,上海森信仪器有限公司;
双光束紫外可见分光光度计:TU-1901型,北京普析通用仪器有限责任公司。
1.2 方法
1.2.1 纳米磁性载体的制备 分别向圆底烧瓶中加入浓度为0.6moL/L、体积为25mL的 Na2S2O3·5H2O溶液和浓度为4.0moL/L、体积为25mL的NaOH溶液,搅拌混合均匀,再向烧瓶中逐滴加入浓度为4.0moL/L、体积为50mL的FeSO4·7H2O溶液,持续搅拌1h后,将体系转移至反应釜,加热至160℃使其持续反应16h,取出反应体系,用磁铁将体系中黑色物质分离出来并水洗3次,得到黑色物质即为纳米磁性Fe3O4;室温下,将100mL乙醇、10mL水和2.5mL正硅酸四乙酯分别加入烧瓶中,搅拌5min后,向其中加入2.0mL的浓氨水以及制备的纳米Fe3O4,继续搅拌10h后,磁铁分离获得SiO2包裹的纳米Fe3O4;将54g乙醇、3g水及2.28g KH550分别加入烧瓶中,水解10min后,加入上述步骤制备的SiO2包裹的纳米Fe3O4,在氮气保护下搅拌2h后,磁铁分离即获得以SiO2和KH550修饰的纳米磁性载体,保存备用。
1.2.2 脂肪氧合酶的固定化 将大豆粉碎,然后用40目的筛子筛分去皮,再按照固液比为1∶5(m∶V)的比例用石油醚对大豆浸提5次;取50g脱脂大豆粉于圆底烧瓶中并加水350mL,室温下搅拌1h后,搅拌液于4 000r/min离心20min,收集上清液即为粗酶液,保存备用;取1.5g纳米磁性载体和50mL粗酶液加入到烧瓶中,超声使其分散后,加入1.0g戊二醛(占体系总量2%),常温搅拌2h后,以强力磁铁分离出反应液中的固体物质,并用水洗涤3次后,即得纳米固定化酶微粒,密封于4℃下保存备用。
1.2.3 底物溶液的配制及酶活的测定 参照文献[14]。
1.2.4 酶活影响因素的测定
(1)pH值的影响:将粗酶液(或固定化酶0.05g)加入到pH分别为6,7,8,9,10的反应体系中,20℃反应后,进行酶活测定。
(2)温度的影响:将粗酶液(或固定化酶0.05g)置于温度分别为20,25,30,35,40,45℃的水浴中进行反应后,测定酶活。
(3)H2O2浓度的影响:将粗酶液(或固定化酶0.05g)加入到 H2O2浓度分别为0,3,6,9,12,15,18g/L的反应体系中,恒温(游离酶30℃,固定化酶25℃)反应后进行酶活测定。
2 结果与分析
2.1 纳米Fe3O4形貌分析
对固定化酶而言,载体结构和组成直接影响着固定化酶的活性及其催化效率。将制备好的Fe3O4粒子在无水乙醇中超声分散一定时间后,用电子显微镜进行观察。由图1可知,载体为亮黑色短棒状粒子,平均长度约为600nm,平均粒径约为40nm,由于制备的粒子粒径属于纳米范围,从而具备了很高的比表面积,因此使得粒子具有非常高的表面自由能[15],而粒子之间的团聚可以有效降低表面自由能,使体系逐渐趋于稳定,因此从图1中可以所看到粒子有一定的聚集。

图1 Fe3O4纳米粒子电镜图Figure 1 TEM image of naked Fe3O4nanoparticles
2.2 Fe3O4及固定化酶的XRD分析
Fe3O4及固定化酶的XRD分析见图2。Fe3O4会在2θ为30.1°,35.5°,43.1°,53.3°,57.4°,62.3°下出现了6个特征峰,而由图2可知所检测的固定化酶出现了与Fe3O4相同的特征峰,说明对Fe3O4的表面修饰和酶的固定化,并没有改变合成的磁性纳米Fe3O4的内部晶体结构,表明纳米Fe3O4能在反应过程中很好地保持其磁性等特性,从而有利于其在后续的反应过程中进一步应用,也证明了可以以纳米Fe3O4粒子作为固定化脂肪氧合酶的载体进行探索和研究。
2.3 热失重分析
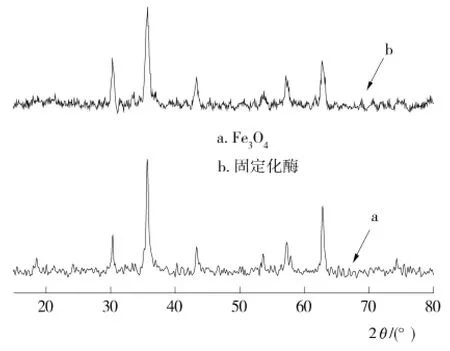
图2 Fe3O4及固定化酶的XRD分析Figure 2 XRD patterns of bare Fe3O4and immobilized enzyme

图3 固定化酶的热失重分析Figure 3 TGA of immobilized enzyme
由图3可知,热失重曲线的形状带有过渡和倾斜区段;曲线的水平部分表示颗粒的质量恒定没有发生变化,而带有斜率的部分表示颗粒的质量发生了变化。温度在0~200℃时,纳米磁性载体和固定化酶的失重大约有1%和5%,这部分失重是因载体上的可挥发物和水分挥发等损失造成的,随着温度的继续升高,脂肪氧合酶和其他包裹物都会被逐渐烧掉,当温度达到600℃左右时,曲线逐渐趋向水平,此时剩下的物质为Fe3O4,而脂肪氧合酶等都已经被全部烧掉,据此计算,载体上脂肪氧合酶的固定量约占固定化酶颗粒质量的14%。
2.4 pH对酶活性能的影响
游离酶和固定化酶的活性测定结果见图4,固定化酶的最适pH为9.0,游离酶的最适pH为8.0。pH值对酶活的影响,主要是通过影响酶分子活部位上的有关基团,从而进一步影响与底物的结合与催化;固定化酶最适pH值向碱性一侧发生偏移,主要原因可能是纳米磁性微粒作为一种复合的碱性氧化物,对酸的耐受性较差,在碱性的环境下,固定化酶比游离酶有更宽的适应范围[16],但随着pH值的不断升高,无论游离酶还是固定化酶均将逐渐失活。
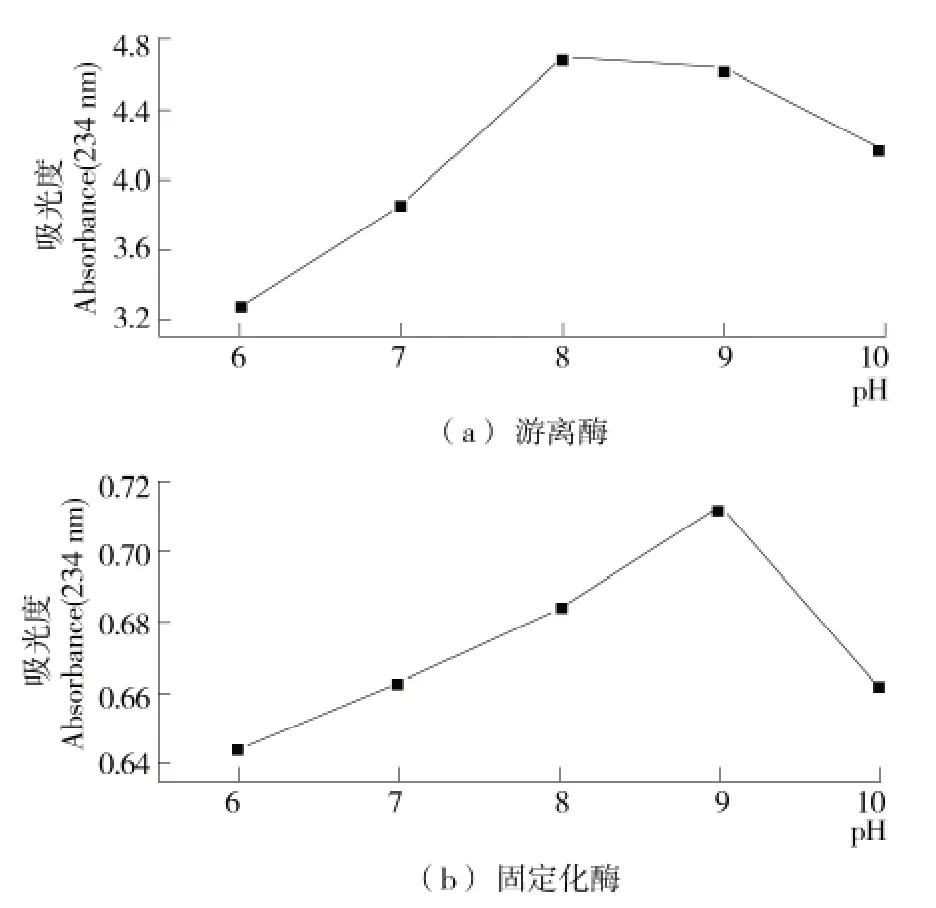
图4 pH对游离酶和固定化酶的活性影响Figure 4 Effect of pH on free and immobilized enzyme activity
2.5 温度对酶活性能的影响
由图5可知,温度对酶促反应速率的影响比较大,游离酶的最适温度为30℃,而固定化酶的最适温度为25℃,且在25~35℃内都保持了较高的酶活力,说明固定化酶扩大了反应温度范围,对温度的敏感性有所下降;而对脂肪氧合酶的利用和处理都应尽量在低温下操作,以便保持较高的酶活[14],所以将脂肪氧合酶的固定化有利于降低酶对温度的苛刻要求。
2.6 双氧水对酶活性能的影响

图5 温度对游离酶和固定化酶的活性影响Figure 5 Effect of temperature on free and immobilized enzyme activity
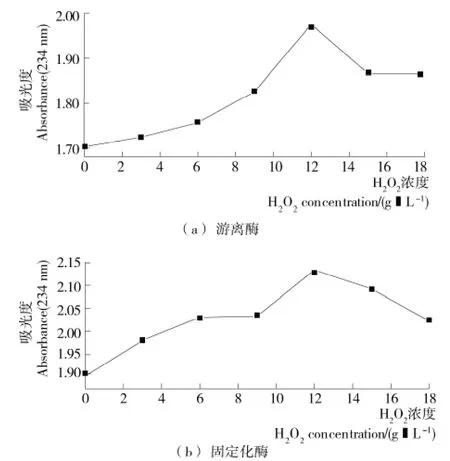
图6 H2O2浓度对游离酶和固定化酶的活性影响Figure 6 Effect of H2O2concentration on free and immobilized enzyme activity
由图6可知,游离酶和固定化酶的活性都随着H2O2浓度的增加而增加,当H2O2浓度为12.0g/L时,酶的活性达到最高,当H2O2浓度继续增加时,酶的活性开始降低,可能是前期加入H2O2起到了诱发酶活性的作用,但环境中过多的H2O2会改变酶的结构,从而抑制酶的活性[17]。最后在最适条件下经测定,游离酶的酶活约为1.82×103U/mL,固定化的酶活约为2.31×103U/g。
3 结论
本试验采用水热法制备了纳米磁性四氧化三铁,然后用SiO2和KH550对其表面进行表面修饰得到复合纳米四氧化三铁载体,再用戊二醛将脂肪氧合酶固定在复合载体上;通过电镜观察,合成得到的纳米磁性四氧化三铁呈亮黑色短棒状粒子;通过XRD分析得到合成的颗粒具有四氧化三铁的特征峰,且这些特征峰在经过对颗粒的表面修饰和酶的固定化后仍然得到了保持;通过热失重分析得到,载体上酶的含量占载体质量的14%;通过对酶活的影响因素考察得到,游离酶的最适温度为30℃,最适pH 8.0,H2O2浓度达到12.0g/L时,酶活达到最高,最适条件下酶活为1.82×103U/mL;固定化酶的最适温度为25℃,最适pH 9.0,H2O2浓度为12.0g/L时,酶活最高,最佳条件下酶活为2.31×103U/g。结果表明以纳米磁性四氧化三铁固定脂肪氧合酶方法适宜可行,因而在此基础上,可将以该材料固定化的脂肪氧合酶进一步进行应用研究,如氧化氯丙嗪或发酵产生香味物质等,同时也可以进一步研究该酶的性质,如酶的半衰期、稳定性及使用次数等。
1 Gardner H W.Recent investigations into the lipoxygenase pathway of plants[J].Biochimica et Biophysica Acta,1991,1 084(3):221~239.
2 Feussner I,Wasternack C.The lipoxygenase pathway[J].Annual Reviewof Plant Biology,2002,53:275~297.
3 蔡琨,方云,夏咏梅.植物脂肪氧合酶的研究进展[J].现代化工,2003,23(增刊):23~27.
4 李伟,孙建中,周其云.适用于酶包埋的高分子载体材料研究进展[J].功能高分子学报,2001,14(3):365~369.
5 钱斯日古楞,王红英.磁性淀粉微球固定化脂肪酶的研究[J].食品科学,2004,25(4):47~49.
6 张世涛,梁茂雨,纵伟,等.磁场稳定流化床反应器水解牛乳中乳糖的研究[J].食品与机械,2007,23(1):18~20.
7 张媛媛,张晖,王立,等.磁性壳聚糖微球固定化米糠内源酶的研究[J].食品与机械,2013,29(3):51~54.
8 钱婷婷,杨瑞金,华霄.改性磁性壳聚糖微球固定化乳糖酶[J].食品与机械,2011,27(1):7~10.
9 纵伟,刘艳芳,赵光远.磁性壳聚糖微球固定化脂肪酶的研究[J].食品与机械,2008,24(1):13~15.
10 季俊红,季生福,杨伟,等.磁性Fe3O4纳米晶制备及应用[J].化学进展,2010,22(8):1 566~1 574.
11 李国辉,李春忠,吕志敏.纳米氧化钛颗粒表面处理及表征[J].华东理工大学学报,2000,26(6):639~641
12 彦锋,李军荣,伏莲娣.固定化酶的制备及应用[J].高分子通报,2001,23(2):13~17.
13 辛宝娟,邢国文.氧化铁磁性纳米粒子固定化酶[J].化学进展,2010,22(4):593~602.
14 蔡琨,方云,夏咏梅,等.大豆脂肪氧合酶的提取及影响酶活因素的研究[J].林产化学与工业,2004,24(2):52~56.
15 李黎,马力.Fe3O4磁性微粒的制备及表征[J].中国组织工程研究与临床康复,2011,15(34):6 385~6 387.
16 罗建平,欧杰,潘利华.交联β-葡萄糖苷酶聚集体的制备及其性质[J].食品科学,2013,29(10):254~258.
17 冯明.PDMS膜生物反应器生物转化制备香草醛研究[D].成都:四川大学,2007.
