Nanog与CD44在胃癌细胞株MKN45球体细胞中的表达及其意义
2015-12-21刘建明周友浪马利林徐骏飞章建国
刘建明,周友浪,马利林,徐骏飞,章建国
Nanog与CD44在胃癌细胞株MKN45球体细胞中的表达及其意义
刘建明,周友浪△,马利林,徐骏飞,章建国
目的检测与干细胞相关的2种因子胚胎干细胞相关转录因子4(Nanog)和分化抗原簇44(CD44)在胃癌细胞株MKN45悬浮球体细胞中的表达。方法选择人胃癌细胞株MKN45,在含有表皮生长因子(EGF)及成纤维生长因子(bFGF)无血清培养液中培养,观察球体形成情况;采用免疫印迹(Western blot)、免疫荧光与实时定量聚合酶链反应(qRT-PCR)检测干细胞相关基因Nanog和CD44在球体细胞及原代贴壁细胞中的表达差异。结果胃癌细胞株MKN45在无血清培养条件下能形成悬浮球体,球体细胞中的Nanog和CD44的mRNA相对表达量分别为2.34±0.22和1.18±0.04,明显高于贴壁细胞中的Nanog和CD44的mRNA相对表达量1.00±0.00和1.00±0.05;球体细胞中的Nanog和CD44的蛋白质相对表达量分别为0.18±0.02和0.24±0.04,明显高于贴壁细胞中的相对表达量0.07±0.02和0.18±0.01(P<0.05)。球体细胞中Nanog主要分布在细胞核周围及细胞质中,而CD44主要在细胞膜上表达,且同一个球体细胞中的Nanog与CD44大多同时表达。结论胃癌细胞株MKN45在无血清培养条件下形成的球体细胞具有肿瘤干细胞的特性。Nanog/CD44共表达细胞可能是胃癌干细胞的一种表型。
胃肿瘤;肿瘤干细胞;抗原,CD44;悬浮培养法;Nanog
肿瘤干细胞(cancer stem cell,CSC)是肿瘤的起源,它决定肿瘤发生进展、治疗抵抗和复发转移[1-2]。针对CSC的研究,首要的任务是CSC的分离与鉴定。悬浮培养法是近年来用来分离CSC一种方法。Zhang等[3]研究发现,前列腺癌细胞株在无血清的悬浮培养系统中能形成肿瘤球,进一步研究证实,这些肿瘤球细胞中的CSC标志物分化抗原簇44(cluster of differentiation 44,CD44)以及其他干性基因神经胶质瘤致病基因1(Gli1),腺苷三磷酸结合盒转运体G2(ABCG2)与B细胞特异性莫洛尼鼠白血病病毒插入位点(Bmi-1)基因的表达水平增高。吴庭枫等[4]用神经干细胞培养基培养胶质瘤细胞株,获取其胶质瘤干细胞球,发现这种胶质瘤干细胞属于CDl33+A2B5-亚群,高表达血管内皮生长因子受体-2(VEGFR-2),具有自我更新及多向分化潜能,可参与血管拟态的形成。然而,悬浮培养法应用于胃癌干细胞分离的相关报道极为罕见。本文采用悬浮培养法在胃癌细胞株MKN45中分离球体细胞,并检测其与干细胞相关的胚胎干细胞相关转录因子4(ES cell associated transcripts4,Ecat4,又名Nanog)和分化抗原簇44(cluster of differentiation 44,CD44)在胃癌细胞株MKN45悬浮球体细胞中的表达。
1 材料与方法
1.1 材料人胃癌细胞株MKN45购自上海中科院细胞库;N-2添加剂及B-27添加剂购自Invitrogen公司;青链霉素及培养液购自Gibco公司;人成纤维生长因子-2(basic Fibroblast Growth Factor-2,FGF-2)及表皮生长因子(Epidermal Growth Factor,EGF)购自Chemicon公司;Nanog、CD44抗体及电化学发光(Electro-Chemi-Luminescence,ECL)试剂购自Santa Curz公司;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)与4%甲醛购自Sigma公司,Evagreen TM qPCR Master Mix购自Biotium Inc公司;Trizol Reagent试剂盒购自Qiagen公司;PCR引物由上海Invitrogen公司合成。
1.2 方法
1.2.1 细胞培养人胃癌细胞株MKN45在含10%胎牛血清(FBS)的1640培养液中培养,细胞贴壁以后,收集贴壁细胞置于含无血清的1640培养液96孔超低黏附板中培养,培养液中加入1%N-2添加剂、2%B-27添加剂、1%青链霉素、20 μg/L人FGF-2和100 μg/L EGF,观察悬浮球形成情况,每孔100个细胞,2周后在倒置显微镜(Olympus)下观察悬浮球形成情况(40及100倍)。当形成的悬浮球长到单个球体含200~500个细胞时,将悬浮球溶解成1 000个/mL细胞的溶液,按每孔100 μL单细胞悬液植入含无血清培养液的96孔的超低黏附板中,2周后观察第二代悬浮球形成情况,贴壁细胞作为对照组观察成球情况。
1.2.2 实时定量聚合酶链反应(qRT-PCR)以悬浮球体细胞为实验组、贴壁细胞为对照组,分别取1×106个细胞提取总RNA,按照Trizol Reagent试剂盒说明书进行。分光光度计检测RNA浓度,取1 μg RNA按照逆转录试剂盒进行合成cDNA,PCR反应体系为50 μL,包括25 μL混合物,上、下游引物各1 μL[分别为Nanog、CD44、甘油醛-3-磷酸脱氢酶(GAPDH)引物],2 μL cDNA模板,双蒸水补足到50 μL。95℃预变性10 min,95℃变性10 s,60℃退火30 s,72℃延伸30 s,扩增40个循环。荧光定量PCR(7500)检测各基因的表达,引物序列见表1,操作步骤及加样剂量按照荧光定量PCR试剂盒说明书进行,每组重复实验3次,结果用7500 System Software V 2.0分析,以GAPDH基因为内参,根据公式2-ΔΔCT计算目的基因的相对表达量。
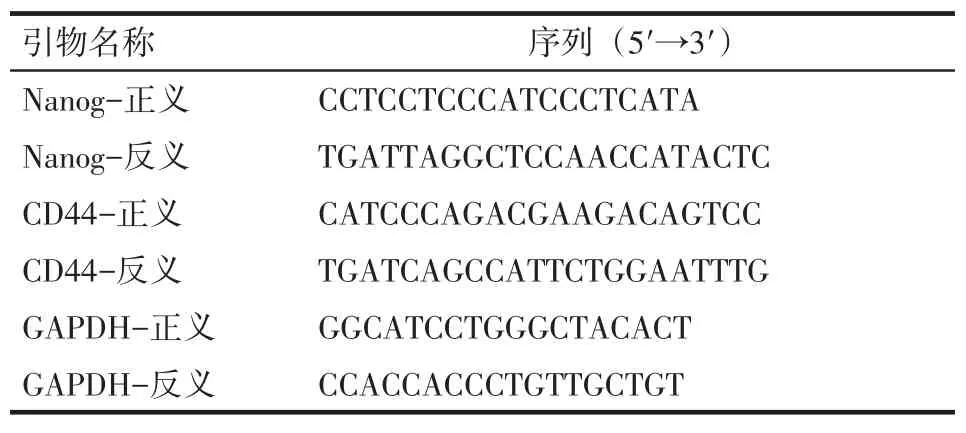
Tab.1The base sequences of primers for quantitative real-time PCR表1 实时定量聚合酶链反应引物序列
1.2.3 蛋白免疫印迹分析悬浮球或贴壁细胞经含有蛋白酶抑制剂的裂解液裂解并提取蛋白样本,然后添加变性缓冲液后煮沸备用,用十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)在8%或12%的凝胶中分离并转移到聚偏氟乙烯(PVDF)膜上,5%牛奶封闭后加入一抗,在4℃条件下孵育过夜(抗-Nanog 1∶500,抗-CD44 1∶500),洗膜缓冲液(TBST)洗3次,然后加入标记辣根过氧化物酶的二抗,室温下培养2 h,TBST洗3次,最后,蛋白条带经ECL化学发光试剂曝光于胶片(Kodak)上。
1.2.4 免疫荧光分析将悬浮球细胞及贴壁细胞在室温下用4%甲醛固定15~20 min,用磷酸盐缓冲液(PBS)清洗3次,在含10%的羊血清及0.1%Triton X-100的封闭液中封闭10 min,去除封闭液,分别加入Nanog和CD44抗体,在4℃下孵育过夜(抗-Nanog 1∶200,抗-CD44 1∶200),PBS替代原抗体作为阴性对照,PBS洗3次,加入标记异硫氰酸荧光素或罗丹明的相应二抗,用DAPI染细胞核。在荧光显微镜下观察并拍照。
1.3 统计学方法采用SPSS 17.0统计软件包分析数据,所有实验至少重复3次,计量资料采用均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌细胞悬浮球体的形成胃癌MKN45细胞在无血清培养基中培养7 d即开始形成细胞球体,培养至14 d球体基本形成,中心密度増高。培养21 d左右球体完全形成,球体结构饱满,细胞排列致密,中心密度更高,见图1。第1代球体细胞吹散后在无血清培养基中继续培养,能继续形成细胞球体,成球率达(29.70±6.21)%,高于原代细胞的成球率为(3.30±1.49)%,差异有统计学意义(t=13.052,P<0.05)。
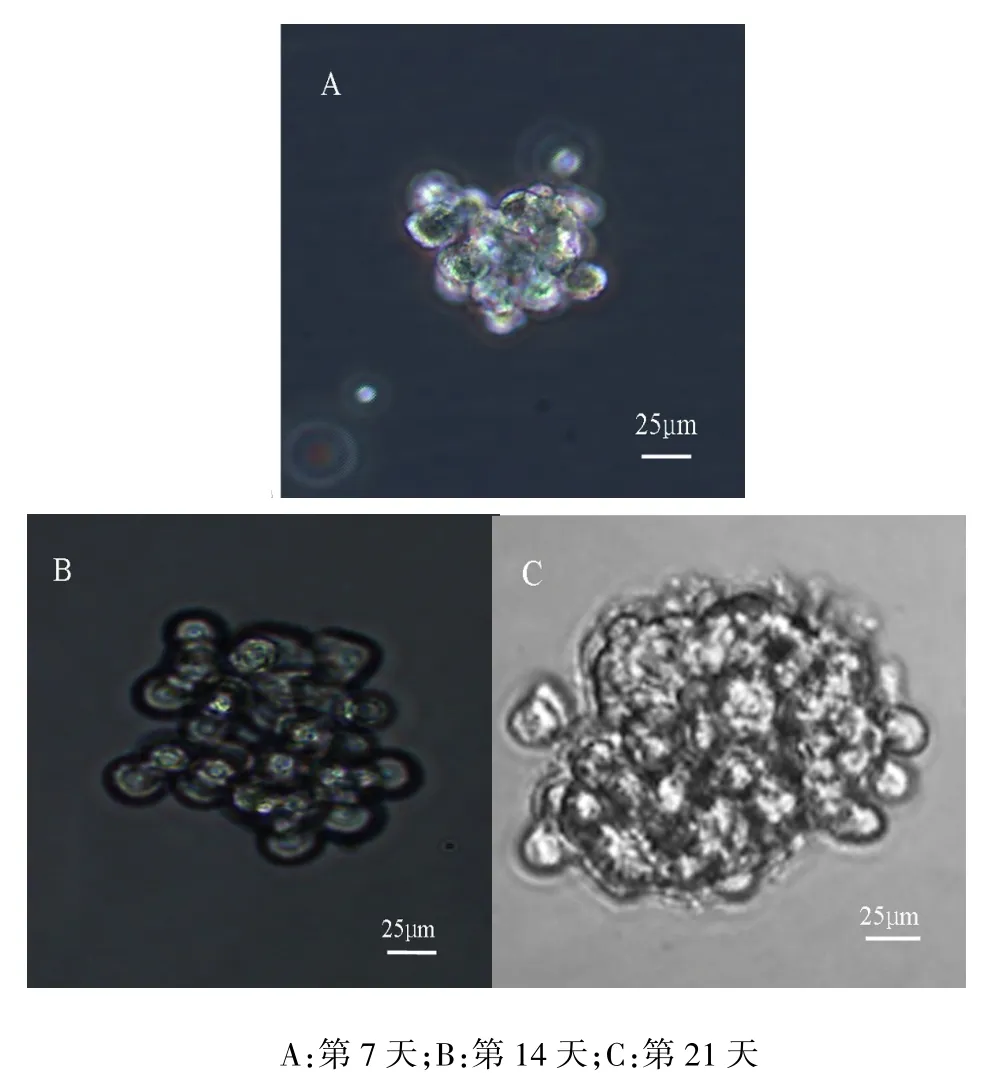
Fig.1The spheroid body of gastric cancer cell line MKN45 observed in serum-free condition图1 胃癌细胞株MKN45在无血清培养条件下所形成的悬浮球体
2.2 球体细胞中干细胞相关基因的表达定量PCR显示,球体细胞中干细胞相关基因Nanog、CD44的表达明显高于原代贴壁细胞,见表2。蛋白免疫印迹条带显示球体细胞的Nanog及CD44的表达明显高于原代贴壁细胞,见图2、表3。免疫荧光分析显示,球体细胞中Nanog主要分布在细胞核周围及细胞质中,而CD44主要表达于细胞膜上,且同一个球体细胞中的Nanog与CD44大多同时表达,见图3。而Nanog在原代贴壁细胞中表达微弱,CD44仅在部分原代贴壁细胞中表达,见图4。
Tab.2Comparison of the expression levels of Nanog and CD44 mRNA between spheroid cells and parental cells表2 2组细胞干细胞相关因子mRNA实时定量PCR分析结果(n=3,)
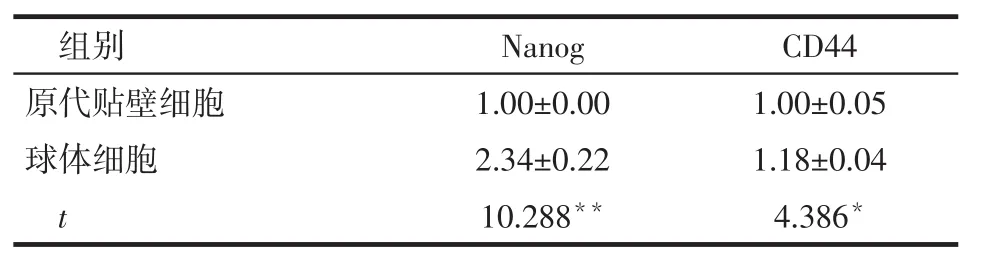
Tab.2Comparison of the expression levels of Nanog and CD44 mRNA between spheroid cells and parental cells表2 2组细胞干细胞相关因子mRNA实时定量PCR分析结果(n=3,)
*P<0.05,**P<0.01
组别原代贴壁细胞球体细胞t Nanog 1.00±0.00 2.34±0.22 10.288**CD44 1.00±0.05 1.18±0.04 4.386*

Fig.2Western blot results for Nanog and CD44 proteins in spheroid cells and parental cells图2 球体细胞与原代贴壁细胞中Nanog、CD44电泳图
Tab.3Comparison of expression levels of Nanog and CD44 protein between spheroid cells and parental cells表3 2组细胞干细胞相关因子蛋白表达量的比较(n=3,)
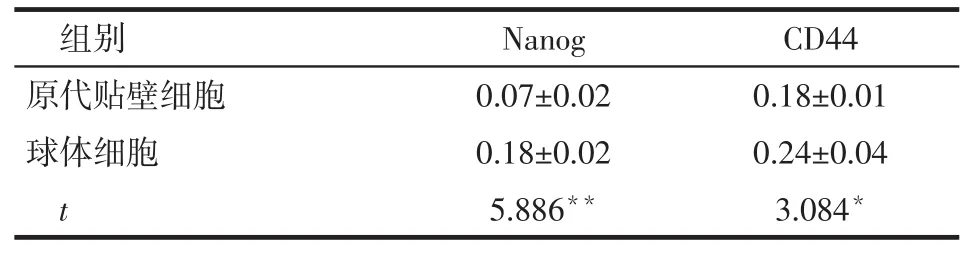
Tab.3Comparison of expression levels of Nanog and CD44 protein between spheroid cells and parental cells表3 2组细胞干细胞相关因子蛋白表达量的比较(n=3,)
*P<0.05,**P<0.01
组别原代贴壁细胞球体细胞t Nanog 0.07±0.02 0.18±0.02 5.886**CD44 0.18±0.01 0.24±0.04 3.084*
3 讨论
3.1 悬浮培养法分离胃癌球体细胞悬浮培养法是将候选细胞在含bFGF及EGF的无血清培养液中培养,能形成悬浮球体的细胞被认为是CSCs[5]。文献报道悬浮培养法已分别在前列腺癌[3]、胶质瘤[4]以及大肠癌[6]等许多实体肿瘤中成功分离、鉴定出CSC,而应用于胃癌干细胞的分离、鉴定的相关研究报道极为罕见。本研究选用胃癌细胞株MKN45在含人EGF及bFGF的无血清的培养液中培养,结果显示有一小部分细胞能够形成悬浮球体,且悬浮球体细胞在无血清培养条件下的成球率明显高于原代贴壁细胞,提示悬浮球体细胞富集具有自我更新与增殖能力的胃癌干细胞。
3.2 Nanog及CD44在肿瘤悬浮球体细胞中的表达意义Nanog作为一种同源异型结构域转录因子,在维持鼠胚胎干细胞的多能性、阻止胚胎干细胞向原始内胚层分化方面发挥至关重要的作用。近年来研究表明,悬浮培养法分离的球体细胞中的Nanog表达明显高于原代贴壁细胞。韩兴文等[7]用无血清培养法从骨肉瘤细胞株U2-OS和MG-63中培养出悬浮球,RT-PCR检测Stro-1阳性细胞(间充质干细胞)、Stro-1阴性细胞及悬浮球细胞中Nanog mRNA的表达,结果显示Stro-1阳性细胞和悬浮球细胞Nanog mRNA表达水平均高于Stro-1阴性细胞的表达水平。王涌等[8]采用无血清培养基结合耐药筛选法在肝癌细胞系SMMC-7721中培养出悬浮球体,定量PCR、免疫荧光法检测Nanog、CD24等肿瘤干细胞标志物的表达,结果发现悬浮球体细胞中的Nanog、CD24等肿瘤干细胞标志物明显高于普通肝癌细胞。提示Nanog基因可能在维持悬浮球体细胞自我更新及其未分化状态过程中发挥重要作用。
CD44是一种多功能的跨膜糖蛋白,在许多正常组织细胞及肿瘤组织中都有表达[9],也是在实体肿瘤中最早用来分离鉴定CSC的标志物之一[10]。Fan等[6]采用悬浮球培养法在大肠癌细胞株HT29中成功培养出悬浮球体细胞,进一步研究发现悬浮球体细胞中CD44(+)细胞所占比例(89.5%)是原代贴壁细胞中CD44(+)细胞所占比例(1.3%)的68倍,CD133(+)/CD44(+)细胞所占比例从原代贴壁细胞中的0.6%上升到5.4%,球体细胞中醛脱氢酶1(Aldehyde dehydrigenase1,ALDH1)的表达(20.5%)高于原代贴壁细胞(7.5%),并且球体细胞对5-氟尿嘧啶(5-Fu)的耐受性比原代贴壁细胞强,提示悬浮培养法是富集大肠癌干细胞的有效方法,为大肠癌干细胞的研究提供了一种稳定有效的细胞模型。杨宏琼等[11]采用克隆形成实验在人胃癌细胞株SGC-7901中培养出3种类型的克隆,即紧密型、中间型和松散型克隆。采用免疫荧光技术和Western blot法检测不同克隆细胞中CD44和CDX2的表达,结果显示CD44在紧密型克隆细胞中的表达明显强于中间型和松散型克隆,因而推测紧密型克隆可能富含胃癌干细胞。
3.3 Nanog及CD44在胃癌球体细胞中的表达意义为了进一步证实悬浮培养法分离的悬浮球体细胞的干细胞特性,本研究对胃癌细胞株MKN45悬浮球体细胞中的干细胞相关因子Nanog及CD44做了检测,结果显示,球体细胞中Nanog、CD44表达均明显高于原代贴壁细胞中的表达,表明胃癌细胞株MKN45在无血清的培养液中培养出的悬浮球体细胞具有类似肿瘤干细胞的分子基础。免疫荧光显示原代贴壁细胞中Nanog表达微弱,证实随着细胞的分化,Nanog的表达水平降低或消失;CD44仅在部分原代贴壁细胞中表达,提示CD44在部分已分化的细胞中也能表达,其并非干细胞的特异性标志物。同一球体细胞中Nanog与CD44大多同时表达,提示Nanog/CD44共表达细胞可能是胃癌干细胞的一种表型。
[1]Marx J.Cancer research:mutant stem cells may seed cancer[J].Science,2003,301(5638):1308-1310.
[2]Singh SK,Hawlns C,Clarker ID,et al.Identification of human brain tumour initiating cells[J].Nature,2004,432(7015):396-401.
[3]Zhang L,Jiao M,Li L,et al.Tumorspheres derived from prostate cancer cells possess chemoresistant and cancer stem cell properties [J].J Cancer Res Clin Oncol,2012,138(4):675-686.doi:10.1007/ s00432-011-1146-2.
[4]Wu TF,Chen JM,Chen SS,et al.Phenotype of SHG-44 glioma stem cell spheres and pathological characteristics of their xenograft tumors[J].Chin J Oncol,2013,35(10):726-731.[吴庭枫,陈金明,陈三送,等.SHG-44胶质瘤干细胞球的表型特点及其移植瘤病理特征[J].中华肿瘤杂志,2013,35(10):726-731].doi:10.3760/ cma.j.issn.0253-3766.2013.10.002.
[5]Lee J,Kotliarova S,Kotliarov Y,et al.Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines[J].Cancer Cell,2006,9(5):391-403.
[6]Fan X,Ouyang N,Teng H,et al.Isolation and characterization of spheroid cells from the HT29 colon cancer cell line[J].Int J Colorectal Dis,2011,26(10):1279-1285.
[7]Han XW,Wang SK,Kang XW,et al.Significance of Nanog gene expression in osteosarcoma-like tumor stem cells[J].J Fourth Mil Med Univ,2009,30(6):513-516.[韩兴文,王栓科,康学文,等. Nanog mRNA在骨肉瘤类肿瘤干细胞中的表达和意义[J].第四军医大学学报,2009,30(6):513-516].doi:1000-2790(2009)06-0513-04.
[8]Wang Y,Liu YH,Jiang JS,et al.A new method for purification and identification of hepatocellular carcinoma stem cell of SMMC-7721 [J].Natl Med J Chin,2012,92(48):3434-3437.[王涌,刘雅辉,姜建帅,等.人肝癌细胞系SMMC-7721肿瘤干细胞筛选及鉴定[J].中华医学杂志,2012,92(48):3434-3437].doi:10.3760/cma.j. issn.0376-2491.2012.48.014.
[9]Prince ME,Sivanandan R,Kaczorowski A,et al.Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma[J].Proc Natl Acad Sci USA,2007, 104(3):973-978.
[10]Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
[11]Yang HQ,Zhou ZH,Zhang YL,et al.Morphological observation of human gastric cancer cell SGC-7901 clones and identification of gastric cancer stem cells[J].Chin J Oncol,2013,35(3):164-169.[杨宏琼,周志华,张尤历,等.人胃癌细胞株SGC-7901的克隆形态观察及含肿瘤干细胞克隆的鉴定[J].中华肿瘤杂志,2013,35(3): 164-169].doi:10.3760/cma.j.issn.0253-3766.2013.03.002.
(2014-04-19收稿2014-08-12修回)
(本文编辑李鹏)
(图3、4见插页)
The expression and significance of Nanog and CD44 in spheroid body-forming cells of gastric cancer cell line MKN-45
LIU Jianming,ZHOU Youlang△,MA Lilin,XU Junfei,ZHANG Jianguo
Department of General Surgery,Affiliated Hospital of Nantong University,Jiangsu 226001,China△
ObjectiveTo detect the expression of stem-cell related factors Nanog and CD44 in spheroid body-forming cells of gastric cancer cell line MKN-45.MethodsThe gastric cancer cell line MKN-45 was used to culture spheroid bodies in non-adherent condition in a serum-free medium supplemented with epidermal growth factor(EGF)and basic fibroblast growth factor(bFGF).Using Western blot analysis,immunofluorescence staining and quantitative real time polymerase chain reaction(qRT-PCR),the expression levels of stem cell-related genes Nanog and CD44 were studied.ResultsIn this study,we observed that MKN45 cells formed spheroid bodies in non-adherent condition in a serum-free medium,and the levels of Nanog and CD44 mRNA expression in spheroid body-forming cells were 2.34±0.22 and 1.18±0.04,respectively, which were higher than those in parental cells(1.00±0.00 and 1.00±0.05).The levels of Nanog and CD44 protein expression in spheroid body-forming cells were 0.18±0.02 and 0.24±0.04,respectively,which were significantly higher than those in parental cells(0.07±0.02 and 0.18±0.01,P<0.05).Nanog protein was positively stained within the perinuclear and cytoplasm of the spheroid body-forming cells,and CD44 was positively stained mainly in the membrane.Dual staining of Nanog/CD44 indicated that the embryonal protein Nanog was co-localized with CD44 in the spheroid body-forming cells.Conclusion Spheroid body-forming cells developed from human gastric cancer cell line MKN-45 in serum-free medium supplemented with EGF and bFGF show characteristics of cancer stem cell(CSC).The cells co-expressed of CD44 and Nanog maybe a phenotype of gastric CSCs.
stomach neoplasms;neoplastic stem cells;antigens,CD44;suspension culture;Nanog
R735.2
A
10.3969/j.issn.0253-9896.2015.01.008
江苏省南通市科技局资助项目(HS2012067)
南通大学附属医院普外科(邮编226001)
刘建明(1965),男,主任医师,副教授,博士,主要从事胃癌的基础与临床研究
△通讯作者E-mail:liujmtq1@163.com
