杜香多糖的抗氧化活性及物理性质研究
2015-12-20张乔会王建中逄锦慧罗兴武
张乔会 王建中 逄锦慧 崔 洁 杨 喆 罗兴武
(1.湖北民族学院科技学院,湖北 恩施 445000;2.北京林业大学生物科学与技术学院,北京 100083;3.林业食品加工与安全北京市重点实验室,北京 100083)
杜香(Ledum palustreL.)为杜鹃花科杜香属的常绿灌木[1],是中国东北、内蒙古大兴安岭林区的主要组成树种,其分布面积约占大兴安岭林地面积的70%[2]。据统计[3],大兴安岭杜香干叶年产量达53.6万t。杜香枝叶成分丰富,含有多种挥发性精油、熊果酸、多糖等[4,5]。
杜香资源丰富,目前主要研究其精油[6]、熊果酸[7]等,而对杜香多糖的理化性质研究未见报道。随着保健品市场的活跃,杜香资源开发潜力巨大,研究杜香多糖的抗氧化性、稳定性、分子刚性等对于杜香的综合开发利用具有重要意义。本研究拟通过水提醇沉法提取杜香多糖[8],利用红外分析鉴定多糖基团,利用蒽酮硫酸法[9]测定杜香多糖粗物中多糖的含量,通过总还原力测定[10-12]和分别清除羟基自由基[13-16]、DPPH自由基[17-19]、超氧阴离子[20-22]能力4种 评价方法,分析杜香多糖的抗氧化活性。并采用一般材料分析方法分析杜香多糖的物理性质,为其开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
杜香:由内蒙古金河林业局提供,经北京林业大学植物专家鉴定,自然风干后磨粉并过40目筛,放干燥器中备用;
1,1-二 苯 基-2-苦 肼 基 (1,1-dipheny1-2-picrylhydrazyl,DPPH)、邻苯三酚、硫酸亚铁、磷酸氢二钠、磷酸二氢钠、氯化钠、VC、铁氰化钾、三氯乙酸、2,6-二叔丁基-4-甲基苯酚(BHT)、三氯化铁、三羟甲基氨基甲烷(Tris)、氢氧化钠、邻菲罗啉:分析纯,北京化工厂。
1.2 试验仪器
FT-IR红外光谱仪:Tensor27型,德国Bruker公司;
热重分析仪:TGA60型,日本Shimadzu公司;
旋转蒸发仪:RE-5203型,上海亚荣生化仪器厂;
电子天平:METTLER TOLEDO型,梅特勒—托利多仪器(上海)有限公司;
X射线衍射仪:XRD-6000型,日本Shimadzu公司;
冻干机:LL1500型,美国Thermo Fisher Scientific公司;
分光光度计:普析T6型,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 杜香多糖的提取 采用水提醇沉法:准确称取一定量的杜香枝叶粉,按1∶35(m∶V)加入去离子水,然后放入恒温水浴震荡箱中80℃震荡6h,离心分离液体和固体粉末,向上清液中加入酒精至浓度为85%,置于4℃冰箱中静置1h,然后分离固液两相,固体为粗多糖。
1.3.2 杜香多糖纯化 将1.3.1得到的样品按1∶10(m∶V)加入石油醚处理5h进行脱脂,接着将脱脂样品按1∶2(m∶V)溶解于去离子水中,加入酒精至浓度为85%,置于4℃冰箱中静置1h,分离固液两相,重复上述操作4次,然后采用Sevag法[23]脱蛋白,所得样品在-110℃下冷冻干燥,便可得到杜香多糖成品。将脱脂脱蛋白和脱脂未脱蛋白的多糖样品配成100μg/mL的溶液,利用紫外光谱分析脱脂、脱蛋白前后杜香多糖的变化。
1.3.3 杜香多糖的红外分析 取少量样品置于红外光谱仪中进行测定,扫描分辨率2cm-1,扫描范围为400~4 000cm-1,扫描次数32次[24]。
1.3.4 杜香多糖含量测定 采用蒽酮硫酸法[23],并以葡萄糖为参照制作标准曲线。
1.3.6 杜香多糖的TG分析 准确称取3~8mg的杜香多糖,放入综合热重分析仪内进行热综合(TG)分析测定,以考察杜香多糖的热稳定性。分析条件:扫描温度20~600℃,升温速度10℃/min,N2流速40mL/min[24]。
1.3.7 杜香多糖的X-RD分析 取一定量的杜香多糖于X射线衍射仪的样品室内进行扫描,扫描范围为5°~60°,在扫描范围内以5°/min的变化速率进行X射线照射,利用得到的数据绘制XRD衍射强度曲线图,并计算出样品的结晶度。根据衍射角与衍射强度的关系绘制XRD曲线。
1.4 数据分析
采用 Microsoft Excel(Office 2007)软件整理数据,Orgin软件进行统计分析。
2 结果与分析
2.1 杜香多糖纯化结果分析
由图1可知:未脱蛋白前,杜香多糖溶液在280nm处有明显的吸收峰,说明其含有蛋白成分。脱蛋白后的样品在280nm处没有明显的吸收峰,说明其不含蛋白。与未脱蛋白的样品进行比较,同一波长下,脱蛋白样品的吸收值偏低,这可能是因为未脱蛋白的多糖样品中含有一定的核酸及蛋白,这两种物质含有一定数量的碱基和疏水基团,从而使样品的紫外吸收产生增色效应。脱蛋白后,蛋白、核酸被除去,产生增色效应的基团也被除去,样品紫外吸收恢复正常,因而在同一波长下,脱蛋白的多糖样品比未脱蛋白的多糖样品紫外吸收值要略低。

图1 杜香多糖样品紫外扫描光谱Figure 1 UV scanning spectrum of polysaccharide fromLedum palustre L.
2.2 杜香多糖红外分析
由图2可知,谱图在3 389cm-1和1 156~1 024cm-1的峰分别为O—H和C—O的伸缩振动,1 024cm-1的较强吸收也说明了杜香多糖中可能有葡萄糖结构,2 889cm-1的尖峰以及1 567~1 370cm-1的峰分别为C—H的伸缩振动和变角振动,1 648cm-1处出现吸收峰,推测该峰为醛基中CO的伸缩振动引起的,谱图在1 648cm-1波数处还出现一较强的吸收峰,说明杜香多糖中可能有酰氨取代基,谱图在903cm-1波数处还出现吸收峰,说明杜香多糖可能含有β-型糖苷键。总之,杜香水提醇沉物具有多糖的一般吸收峰,证明杜香水提醇沉物为杜香多糖。

图2 杜香多糖的红外光谱图Figure 2 IR spectrum of polysaccharide fromLedum palustre L.
2.3 杜香多糖含量的测定结果
由图3可知:在含量为0.00~0.05mg/mL的范围内,葡萄糖含量与吸光度线性关系良好。标准曲线方程为y=9.79x-0.002,回归系数R2=0.995。测得杜香粗提物的吸光值为0.272,从而计算出杜香多糖粗提物中多糖的含量为69.95%。
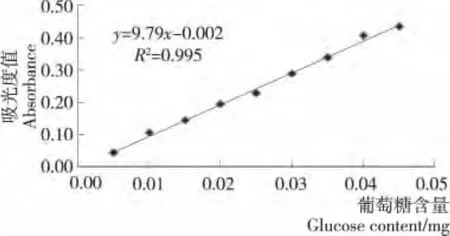
图3 葡萄糖标准曲线Figure 3 Standard curve of glucose
2.4 杜香多糖抗氧化结果分析
2.4.1 清除DPPH·的能力 由图4可知:抗氧化剂(Vc,BHT等)明显比杜香多糖的清除能力强,这是因为抗氧化剂采用的是纯品,单位体积内浓度相对较高,而制备的杜香多糖粗提物纯度相对较低所致。随浓度升高,杜香多糖对DPPH·的清除率呈明显上升趋势,在0.60mg/mL处,达到54.70%。利用线性关系得出杜香多糖清除DPPH·的EC50值为0.52mg/mL。

图4 杜香多糖与Vc、BHT清除DPPH·能力的比较Figure 4 The scavenging rate of DPPH radical on polysaccharide from Ledum palustre L.compared with Vc,BHT
2.4.2 清除·OH的能力 由图5可知:随浓度升高,杜香多糖和VC对·OH的清除率呈递增趋势;VC对·OH的清除效果明显优于杜香多糖。当浓度为1.00mg/mL时,杜香多糖的清除率为40.97%。利用线性关系得出杜香多糖对·OH的EC50值为1.41mg/mL。

图5 杜香多糖与Vc清除·OH能力的比较Figure 5 The scavenging rate of hydroxyl radical on polysaccharide from Ledum palustre L.compared with Vc
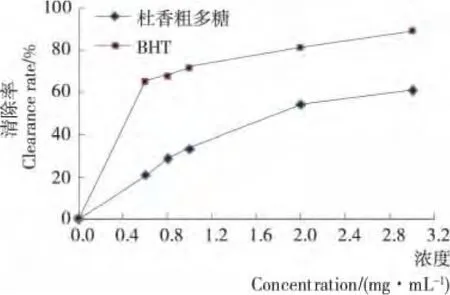
图6 杜香多糖与BHT清除·能力的比较Figure 6 The scavenging rate of superoxide anion radical on polysaccharide fromLedum palustre L.compared with BHT
2.4.4 总还原力 还原能力的测定是以样品是否为有效的电子供应者为评价指标的。若是有效的电子供应者,其供应的电子可将Fe3+还原成Fe2+,还可与自由基形成较惰性物质,从而中断自由基连锁反应。一般情况下,物质的吸光度越大,还原能力越强,其抗氧化能力也越高[25]。由图7可知:随浓度增加,吸光度值增加趋势比较平缓,相同浓度时抗氧化剂BHT的总还原能力明显优于杜香多糖。杜香多糖的还原力随浓度的增加呈线性增加,杜香多糖的还原力在0.95~1.00mg/mL范围内高于0.095~0.100mg/mL的BHT的溶液,还原力较强。
2.5 杜香多糖物理性质分析结果
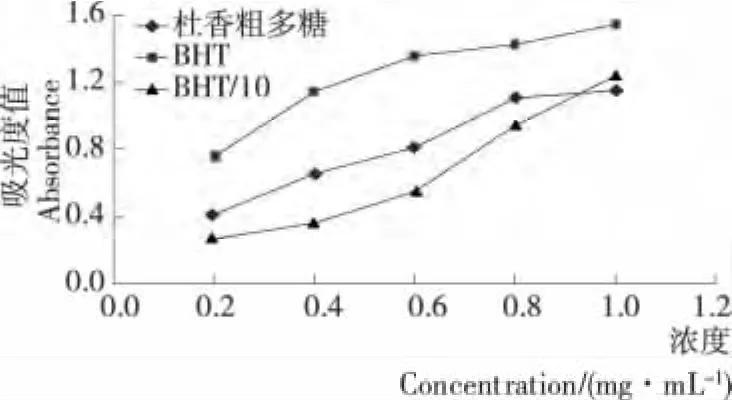
图7 杜香多糖与Vc、BHT还原力的比较Figure 7 The reducing power of polysaccharide fromLedum palustre L.compared with Vc,BHT
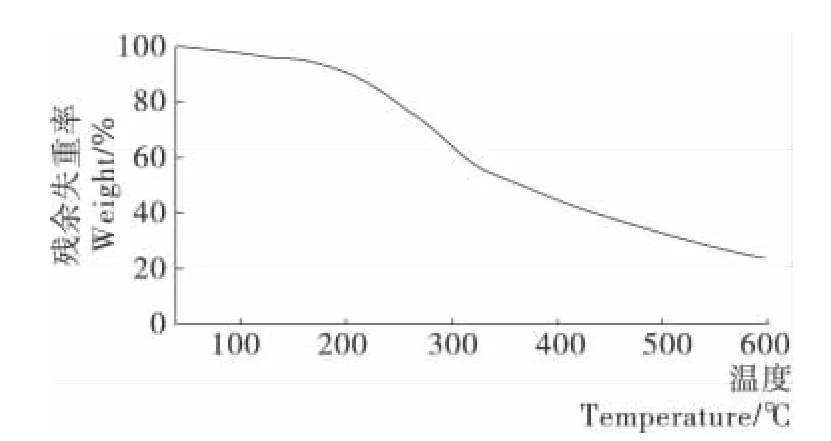
图8 杜香多糖失重图(氮气保护)Figure 8 TGA analysis of polysaccharide fromLedum palustre L.under N2condition
2.5.1 热重分析 由图8可知,杜香多糖具有2次明显的失重过程,这与多糖的含水量、组成和聚集态等有关。第1次失重出现在78℃左右,失重率为1.50%,可能是多糖受热失水形成的失重峰;第2次失重出现在190~550℃,失重率为41.97%,此温度区间的失重快,说明杜香多糖在该温度范围内发生了剧烈的分解反应,也说明在190℃以内时,杜香多糖是相对稳定地发生热裂解。550℃以后的温度范围,杜香多糖失重率为13.80%,说明在这个范围内,杜香多糖进一步降解。
2.5.2 X射线衍射分析 由图9可知,杜香多糖的X射线衍射强度曲线最高峰出现在2θ为20°附近,且峰形圆顿,基本呈现典型馒头峰的特性,说明结晶度较低。2θ为30°和40°时,有2个圆顿的小肩峰,也说明了其结晶度低。这可能是因为杜香多糖是由几种多糖混合而成的一种混合性多糖,不同成分的衍射强度曲线的最高峰出现的2θ位置不同,从而产生了肩峰现象。总体来说,杜香多糖的结晶度低(3.6%),分子刚性较差。这也可以作为鉴定杜香多糖的一种方式。
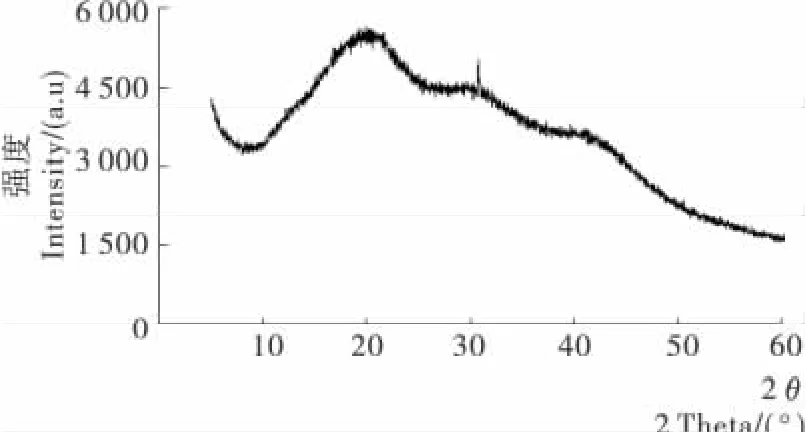
图9 杜香多糖的X-衍射强度曲线图Figure 9 XRD intensity curves of polysaccharide fromLedum palustre L.
3 结论
杜香多糖具有一定的抗氧化活性,并与浓度呈一定的函数关系,且在一定范围内随浓度增高,其活性逐渐增强。杜香多糖清除DPPH·、·、·OH的EC50值分别为0.52,1.41,1.71mg/mL,还原力接近 BHT并与浓度呈正相关。杜香多糖结晶度低,分子刚性差,其在190℃温度范围内稳定,超过该温度,将发生剧烈的热分解使其失重。本试验研究了杜香多糖的理化性质,可为其开发利用提供一定的理论基础。但关于杜香多糖的纯化、单糖分析及结构鉴定仍需进一步的研究。
1 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1999:4.
2 冯旭,周勇,郭立新.黑龙江省野生香料植物资源及其利用[J].国土与自然资源研究,1995(2):68~72.
3 周以良.中国大兴安岭植被[M].北京:科学出版社,1991:239~310.
4 赵頔,张敏,武文斌,等.杜香黄酮提取纯化工艺及其抗炎作用研究[J].中成药,2012,34(8):1 590~1 594.
5 路博琼,罗书勤,张力平,等.超临界CO2萃取杜香挥发油工艺优化及成分分析[J].现代农业科技,2014(6):173~176.
6 姜玮,刘静波,卢静,等.杜香挥发油研究概述[J].食品科学,2010,31(13):337~341.
7 张乔会,逄锦慧,王建中,等.不同提取方法对杜香熊果酸提取得率的影响[J].食品工业科技,2014,35(23):217~222.
8 岳春,李靖靖,方永远.虫草多糖微波辅助提取工艺的优化[J].食品与机械,2014,30(1):192~195.
9 蔡芳,赵阳,白音夫,等.蒽酮—硫酸法测定蒙药荨麻多糖的含量[J].中国民族医药杂志,2014(3):58~59.
10 刘光宪,冯健雄,王辉,等.不同纯化方法对花生多糖抗氧化活性的影响[J].食品与机械,2014,30(1):189~191.
11 秦轶,侯小桢,章斌,等.柠檬精油的化学成分分析及其抗氧化活性研究[J].食品与机械,2014,30(3):169~173.
12 阮长青,刘肇明.黄豆酱中低聚肽的分离及抗氧化活性研究[J].食品与机械,2014,30(3):151~153.
13 刘颖,梁盈,林亲录,等.南瓜多糖的提取及其抗氧化活性研究进展[J].食品与机械,2014,30(3):239~243.
14 余凡,杨恒拓,田光辉,等.紫薯色素的微波提取及其稳定性和抗氧化活性的研究[J].食品工业科技,2014,34(4):321~326.
15 刘萍,高云涛,张丽珠,等.山奈酚清除DPPH自由基的新型微量光度滴定方法研究[J].食品工业科技,2014,35(5):53~57.
16 Hana Kim,Jeong Yong Moon,Hyeonji Kim,et al.Antioxidant and antiproliferative activities of mango(Mangifera indicaL.)flesh and peel[J].Food Chemistry,2010,121(2):429~436.
17 Ribe Iro S M R,Barbosa L C A,Queiroz J H,et al.Phenolic compounds and antioxidant capacity of Brazilian mango(Mangifera indicaL.)varieties [J].Food Chemistry,2008,110(3):620~626.
18 Hao Jing,David D Kitts.Antioxidant activity of Sugar-lysine Maillard reaction products in cell free and cell culture systems[J].Archives of Biochemistry and Biophysis,2004,429(2):154~163.
19 金鸣,蔡亚欣,李金荣,等.邻二氮菲—Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553.
20 王飞,张洪,刘秀玲.枳椇子各部位清除羟自由基作用的比较[J].华西药学杂志,2006,21(1):48.
21 魏银花,申迎宾,王立,等.紫米多酚提取工艺及抗氧化活性研究[J].食品与机械,2013,29(3):111~115.
22 张京芳,王冬梅,周丽,等.香椿叶提取物不同极性部位体外抗氧化活性研究[J].中国食品学报,2007,7(5):12~16.
23 梁丽军,曾哲灵,熊涛,等.蒽酮-硫酸法测定大蒜多糖含量[J].食品科学,2008,28(9):499~502.
24 Pang Jin-hui,Wu Miao,Zhang Qiao-hui,et al.Comparison of physical properties of regenerated cellulose filmsfabricated with different cellulose feedstocks in ionic liquid[J].Carbohydrate Polymers,2015(121):71~78.
25 崔洁,顾欣,王建中,等.山杏果肉可溶性膳食纤维的抗氧化活性与红外光谱分析[J].食品与发酵工业,2012,38(1):123~127.
