半胱胺对奶牛瘤胃微生物蛋白产量、产奶性能和氮排泄的影响
2015-12-20孙友德刘锡武孙国强
王 玲 孙友德 刘锡武 孙国强*
(1.青岛农业大学动物科技学院,青岛 266109;2.青岛市畜牧兽医研究所,青岛 266100)
随着奶牛业的蓬勃发展,特别是奶牛养殖集约化程度的提高,奶牛所产生的粪污给环境带来了巨大压力,其中氮对环境的影响已经被公认为是造成环境污染的重要原因之一。采取营养调控技术,在提高生产性能的同时,降低奶牛的氮排泄对于减轻环境污染和节省蛋白质饲料资源将具有重大的现实意义。半胱胺(cysteamine,CS)又名β-巯基乙胺,为乙酰辅酶A的组成部分,因含有性质活泼的巯基和氨基而具有多种生物活性。王全军等[1]的体外发酵试验表明CS可以通过促进瘤胃发酵提高养分利用率。卢炜等[2]研究发现,CS可以促进山羊消化道发育,提高饲料转化率,加速个体生长。沈赞明等[3]报道,奶牛饲粮中添加CS能显著提高奶牛日产奶量和乳脂率、乳蛋白率。目前,CS在肉牛上的研究较多,结果表明其具有提高养分利用率的作用,而在奶牛生产上的研究较少,且主要集中在生产性能上,尚未见CS对奶牛瘤胃微生物蛋白(MCP)产量和氮排泄的影响进行研究的报道。本试验拟通过给奶牛补饲不同水平的CS,探讨CS对奶牛瘤胃微生物蛋白产量、产奶性能及氮排泄的影响,以期提高奶牛产奶性能、节省蛋白质饲料资源和降低奶牛氮排泄,为实现奶牛业的健康可持续发展提供技术参考。
1 材料与方法
1.1 CS
CS由上海华扩达生化科技有限公司提供,为白色颗粒状物质,纯度30%。载体精料用犊牛料,由青岛奥特奶牛原种场提供,其组成及营养水平见表1。

表1 载体精料组成及营养水平(干物质基础)Table 1 Nutrient levels of the concentrate using as substrate(DM basis) %
1.2 试验设计
本试验采用单因素随机区组设计,选用青岛奥特奶牛原种场体况良好,年龄、体重、产奶量和泌乳期[(135±15)d]相近的荷斯坦奶牛40头,分为4组,每组10头。对照组和试验1组、2组、3组分别补饲0、15、20和25 g/(d·头)CS。方法为将CS加入0.25 kg载体精料中混匀,随全混合日粮(TMR)饲喂。整个试验为70 d,其中预试期14 d,正试期56 d。TMR组成及营养水平见表2。
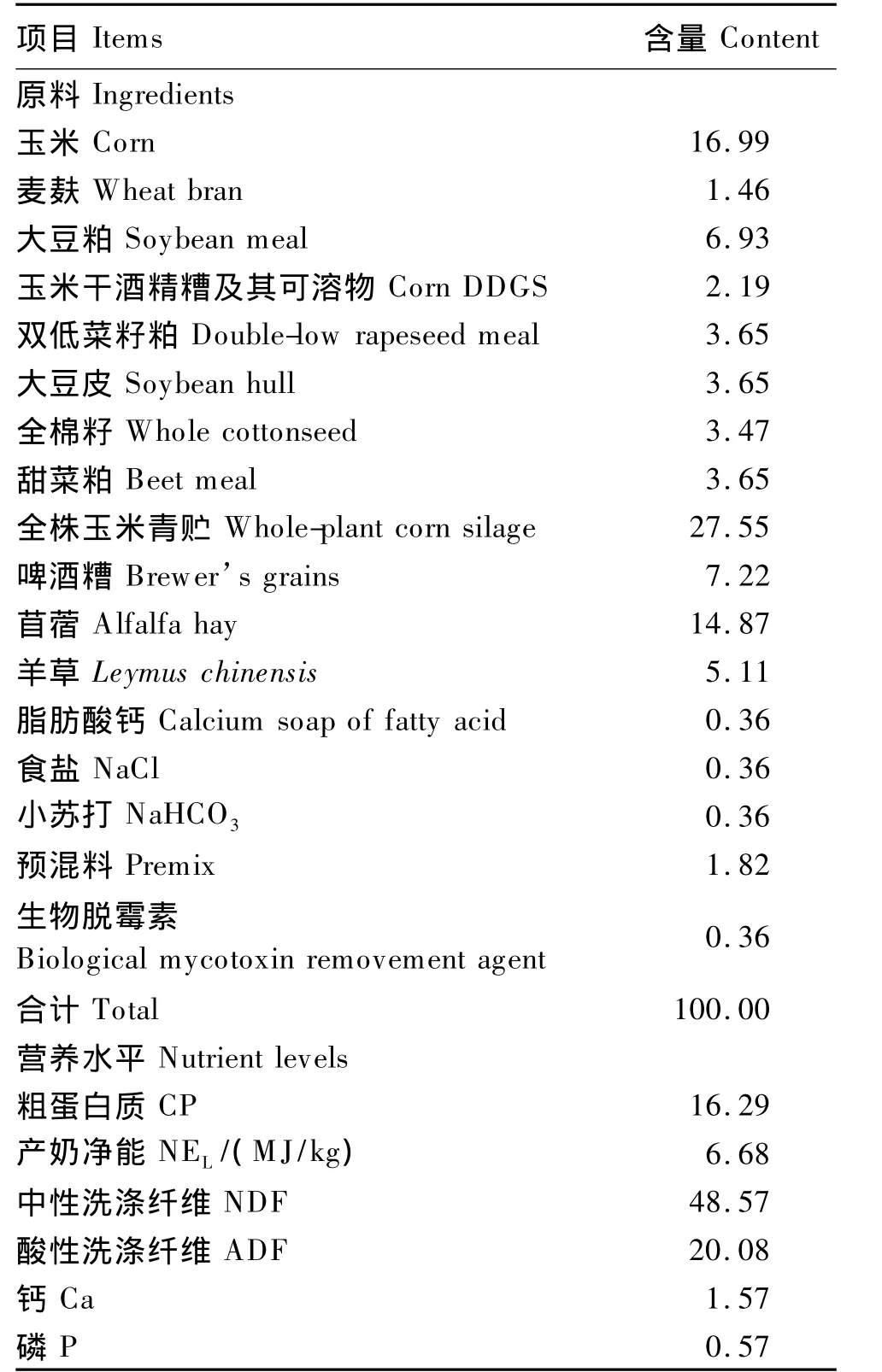
表2 全混合日粮组成及营养水平(干物质基础)Table 2 Composition and nutrient levels of the TMR(DM basis) %
1.3 饲养管理
试验牛采用舍饲,采用利拉伐挤奶设备日挤奶2 次(03:30、15:00),日饲喂 TMR 3 次(04:00、11:00、16:00),确保奶牛每天必须有20 h以上可以接触到TMR。奶牛采食后在运动场自由运动和饮水,常规光照、驱虫和管理。
1.4 试样采集及处理
1.4.1 饲粮样
按四分法收集TMR样和载体精料样,65℃烘箱中烘干,制成风干样,粉碎后备用。
1.4.2 粪样
预试期开始当天、正试期第28天、正试期结束时共采集3次粪样,采用点收粪法,采取人工接粪结合直肠取粪的方式,即每次采样时,将牛用颈夹固定后,采用直肠取粪的方式依次采集每头牛的粪样,若采集过程中牛出现自主排粪的姿势,由专人负责接粪,每组收集10头试验牛的粪样,连续收集3 d,每天收集2次,每隔12 h收集1次,每天在前1天的基础上延后4 h收集,按每100 g粪样加10%硫酸25 mL进行固氮处理,放入烘箱65℃烘干,制成风干样,用于氮含量测定。
1.4.3 乳样
预试期开始当天、正试期每隔15 d各采样1次乳样,均按早、晚产奶量的比例共收集65 mL乳样,其中50 mL乳样加入重铬酸钾防腐剂(0.6 mg/mL)混合均匀,4℃冷藏用于乳成分含量检测。剩余15 mL经400×g离心10 min,取4 mL离心乳样,加入等体积的三氯乙酸(TCA)(25%),静置5 min后于2 000×g下离心20 min去蛋白质,取1.5 mL处理好的乳样-20℃冷冻用于乳尿素氮排泄量的测定。
1.4.4 尿样
预试期开始当天,正试期第28天、正试期结束时采集尿样,采用点收尿法,采取人工接尿结合膀胱取尿的方式,即每次采样时,将牛用颈夹固定后,把导尿管插到膀胱里采取膀胱取尿的方式依次采集每头牛的尿样,若采集过程中牛出现自主排尿的姿势,由专人负责接尿,每组收集10头试验牛的尿样,连续收集3 d,每天收集2次,每隔12 h收集1次,每个采样日在前1天的基础上延后4 h收集,按一定比例加98%浓硫酸以调整尿液pH低于3,-20℃保存。
1.5 测定指标与方法
1.5.1 瘤胃 MCP产量
尿中排出的嘌呤衍生物(PD)主要来自瘤胃微生物嘌呤,因此可以通过PD估测经瘤胃排出的MCP产量。采用比色法分别测定尿中尿酸和尿囊素含量,尿酸与尿囊素含量之和即为尿PD含量[6],计算公式如下:
定风量系统具有恒定的风量。目前,大多数中央空调主要使用空调和冷水管道系统,两者都在恒定风量系统中控制具有恒定风量的特定区域。空调定风量系统采用空调变温供气来应对室内负荷波动。通过DDC监控风扇运行状态、设备故障、过滤器和防冻报警。
MCP(g/d)=6.25 × (70X)/(0.83 ×0.116 ×1 000)=6.25 ×0.727X。
式中:X为小肠吸收外源性嘌呤的量(mmol/d);70为每毫摩尔嘌呤含氮量(mg/mol);0.83为微生物核酸嘌呤的消化率;0.116为瘤胃微生物总氮中嘌呤氮的比例;6.25为氮换算为蛋白质的平均系数。
上述公式中,X的计算公式为:Y=0.85X+0.385BW0.75。
式中:Y为尿PD的排泄量(mmol/d);0.85为牛肠道中吸收的嘌呤转化为尿PD的回收率;0.385BW0.75为内源的 PD。
正试期第28天和正试期结束时MCP产量的平均值为正试期瘤胃MCP产量。
1.5.2 产奶量及乳成分含量
产奶量用利拉伐鱼骨式挤奶机测定,电子显示奶量。预试期、正试期每隔5 d记录1次产奶量,每次连记2 d,取平均值。
采用山东省农业科学院奶牛研究中心奶牛生产性能测定实验室的乳成分自动分析仪(Combi-Foss FT+,丹麦 Foss公司)测定乳蛋白率、乳脂率、乳糖率及乳体细胞数,采用加权平均法计算正试期各乳成分含量。
1.5.3 采食量
预试期内每隔2天称量1次剩料,并记录投料量,根据投料量和剩料量计算每头奶牛的平均采食量,共记录6次,预试期结束时根据6次的记录数据,计算得出预试期每头奶牛的平均采食量。按照同样的方法,正试期内每隔10 d记录和计算1次采食量,共6次。正试期结束时根据6次的记录数据,计算得出正试期每头奶牛的平均采食量。每次根据上次测定的采食量调整下一阶段的TMR投料量。根据平均采食量和饲粮营养物质含量计算养分采食量。
1.5.4 氮代谢指标
尿氮含量采用凯氏定氮法分析,尿素氮含量采用脲酶法测定,尿肌酐含量采用苦味酸比色法测定,试剂盒均购自南京建成生物工程研究所。参照 Valadares等[7]的方法,以尿肌酐(每头牛每天1 kg体重排出约29 mg)标记测定奶牛的排尿量。通过4 mol/L盐酸不溶灰分法结合采食量测定奶牛的日排粪量,参照张丽英[5]主编的《饲料分析及饲料质量检测技术》中的方法测定饲粮及粪中粗蛋白质(CP)含量。
氮代谢指标计算公式:


1.6 数据处理与分析
试验数据用Excel 2010软件进行数据的基本处理。采用SPSS17.0软件进行单因素方差分析,Duncan氏法多重比较进行组间差异显著性检验,以P<0.01和P<0.05分别表示差异极显著和显著,结果以平均值±标准误表示。
2 结果
2.1 CS添加水平对奶牛主要养分采食量的影响
由表3可知,饲粮中加入CS对干物质和其他养分的采食量影响较小。
表3 CS添加水平对奶牛主要养分采食量的影响Table 3 Effects of supplemental level of CS on main nutrient intake of dairy cows kg/d
2.2 CS添加水平对奶牛瘤胃MCP产量的影响
由表4可知,在MCP产量方面,试验组显著或极显著高于对照组(P<0.05或 P<0.01),试验1组显著高于对照组(P<0.05),试验2组和3组显著高于试验1组(P<0.05),试验2组和3组间无显著差异(P>0.05),试验1组、2组和3组MCP产量分别比对照组提高27.27%、66.56%、55.42%;各试验组尿酸排泄量显著或极显著高于对照组(P<0.05或P<0.01),试验3组显著高于对照组(P<0.05),试验1组和3组间差异不显著(P>0.05),试验2组显著高于试验3组(P<0.05);各试验组尿囊素排泄量显著或极显著高于对照组(P<0.05或P<0.01),试验1组显著高于对照组(P<0.05),试验2组和3组显著高于试验1组(P<0.05),试验2组和3组间无显著差异(P>0.05);各试验组尿PD排泄量显著或极显著高于对照组(P<0.05或P<0.01),试验1组显著高于对照组(P<0.05),试验2组和3组显著高于试验1组(P<0.05),试验2组和3组间无显著差异(P >0.05)。

表4 CS添加水平对瘤胃微生物蛋白产量的影响Table 4 Effects of supplemental level of CS on ruminal MCP production of dairy cows
2.3 CS添加水平对奶牛产奶量的影响
由表5可知,试验1组、2组、3组的产奶量均显著高于对照组(P<0.05),分别比对照组提高18.97%、19.58% 、11.25%,而 3 个试验组间无显著差异(P >0.05)。

表5 CS添加水平对奶牛产奶量的影响Table 5 Effects of supplemental level of CS on milk yield of dairy cows kg/d
2.4 CS添加水平对奶牛乳成分含量的影响
由表6可知,试验2组乳脂率极显著高于对照组(P <0.01),显著高于试验 3组(P <0.05),试验1组和3组与对照组间无显著差异(P>0.05);试验2组乳蛋白率极显著高于对照组(P<0.01),显著高于试验3组(P<0.05),试验1组和3组显著高于对照组(P<0.05),这2个组之间无显著差异(P>0.05);试验2组和3组的乳体细胞数显著降低(P<0.05),而这 2个组间差异不显著(P>0.05);饲粮中添加CS对乳糖率无显著影响(P>0.05)。
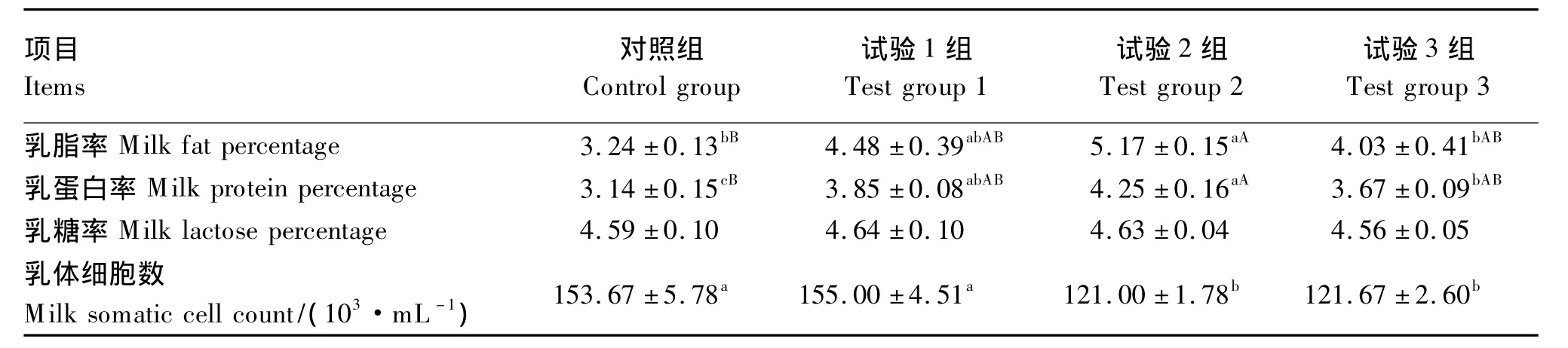
表6 CS添加水平对奶牛乳成分含量的影响Table 6 Effects of supplemental level of CS on milk composition content of dairy cows %
2.5 CS添加水平对奶牛氮表观消化率及氮排泄的影响
由表7可知,从粪氮排泄量来看,各试验组极显著低于对照组(P<0.01),试验1组和2组极显著低于试验3组(P<0.01),试验1组与试验2组之间无显著差异(P>0.05);试验组乳尿素氮排泄量显著或极显著低于对照组(P<0.05或P<0.01),其中试验2组和3组极显著低于对照组(P<0.01),各试验组间差异不显著(P >0.05);从尿氮排泄量来看,各试验组极显著低于对照组(P<0.01),试验2组极显著低于试验3组和1组(P<0.01),试验1组与试验3组之间差异不显著(P>0.05);试验1组、2组和3组氮总排泄量分别比对照组减少 16.24%、22.66%、9.92%,各试验组极显著低于对照组(P<0.01),试验2组极显著低于试验3组(P<0.01),显著低于试验1组(P <0.05),试验1组显著低于试验3组(P<0.05);试验2组的可消化氮、氮表观消化率均极显著高于对照组(P<0.01)。由此表明,饲粮中添加CS可以显著提高氮素的消化利用率,减少氮排放量。
3 讨论
3.1 CS添加水平对奶牛主要营养物质采食量的影响
杨洪波等[8]的研究表明150 g/d CS对奶牛日均干物质食量无显著影响。饲粮中添加CS后氮表观消化率的提高可能与CS可以调控瘤胃发酵,使瘤胃微生物的活动增强,中和胃肠道生长抑素(SS)的免疫活性,延长食糜在肠道内的潴留时间,增强消化道蠕动和消化酶的分泌有关。

表7 CS添加水平对奶牛氮排泄的影响Table 7 Effects of supplemental level of CSon nitrogen excretion of dairy cows
3.2 CS添加水平对奶牛瘤胃MCP产量的影响
MCP是反刍动物最主要的氮源供应,能提供反刍动物蛋白质需要量的60% ~65%,其产量反映了微生物利用氨氮的能力,其产量还间接反映瘤胃中微生物种群的数量。本试验中,瘤胃MCP产量随着CS添加水平的提高而逐渐升高,MCP产量以 CS添加水平为20 g/(d·头)时最高。MCP的合成量主要取决于碳水化合物和氮源的降解数量和速度是否相匹配,即能氮是否平衡的问题,黄雅莉等[9]研究表明,饲喂CS后瘤胃内挥发性脂肪酸含量增加。这说明添加CS后瘤胃内能量的供应更加充足,微生物活力的增强更有利于增强氮代谢,而脲酶活性的抑制,使氮源的降解速度降低,能氮更加平衡,更有利于MCP的生成,从而使MCP合成量增加。
3.3 CS添加水平对奶牛产奶量的影响
泌乳中后期的奶牛处于泌乳高峰过后逐渐下降阶段,随着生理状况的改变,产奶量逐渐下降至干奶。泌乳中后期奶牛处于采食量高峰期,采食量比前期明显升高,营养物质在体内的消化、利用及各营养成分在体内的分配等都将影响产奶性能[3]。CS可以耗竭外周血管和组织的 SS水平[10],提高内源性生长激素(GH)和胰岛素(INS)浓度,提高门静脉和肝脏的血流量,增加门脉系统输出α-氨基氮和β-羟基丁酸的量,并升高血液葡萄糖含量。奶牛体内血液葡萄糖含量的升高能为乳糖的合成提供更多的前体,并为乳脂的生成提供必要的原料,是作为提高奶牛产奶量和乳脂率的方法之一[11]。Kung 等[12]报道,降低饲粮蛋白质在瘤胃内的分解速度,以增加供给到小肠的氨基酸的量,是提高奶牛产奶量的常见做法。Taylor等[13]研究表明,提高奶牛饲粮中蛋白质的过瘤胃率,可提高奶牛产奶量,提高乳脂率和乳糖率。目前,关于CS可以提高奶牛产奶性能的报到比较多,在饲粮中添加CS能减缓中后期奶牛产奶量下降幅度,可显著提高产奶量[14]。本试验结果表明,饲粮中CS添加水平为15~25 g/(d·头)时可以显著提高奶牛产奶量,与上述试验结果一致,根据CS本身的特点推断其原因可能是:一方面,饲喂CS后体内GH浓度升高,促进胰岛素分泌,进而促使类胰岛素因子(IGF-1)体内合成增加,IGF-1能调控体内蛋白质和脂肪的营养分配,促进乳腺细胞对循环系统中氨基酸和葡萄糖的摄取利用,促进乳蛋白、乳糖和乳脂的合成,刺激动物泌乳反射,促进产奶量提高;另一方面,CS可以提高瘤胃微生物对氨氮的利用率,提高瘤胃MCP的产量,通过降低瘤胃微生物对蛋白质的降解速度,增加蛋白质的过瘤胃利用率,同时为小肠提供更多的氨基酸,为奶牛产乳提供更多的小肠可消化蛋白质,对产奶量的提高起到了积极作用。
3.4 CS添加水平对奶牛乳成分含量的影响
乳脂率和乳蛋白率的高低是衡量原料奶品质的重要指标,对原料奶的收购价格起着决定性作用。杨洪波等[8]研究结果表明,半胱胺盐酸盐可以显著提高泌乳奶牛的乳脂率,与本试验结果一致。但也有研究表明,饲粮中添加CS,乳脂率和乳体细胞数虽能得到明显的改善但不表现显著性差异[15],与上述结果的差异可能是由于饲粮组成、饲喂时间的长短或者外界环境等因素的不同造成的。乳脂率的升高可能与GH浓度的提高有关,Staples等[16]和 Johnson 等[17]研究表明,应用牛重组生长激素后可以显著提高乳脂率,GH可以增加乙酰辅酶A羧化酶、脂肪酸合成酶和脂蛋白酶的合成,其中乙酰辅酶A羧化酶是脂肪酸和合成的限速酶,CS能提高血清GH浓度,促进各种酶的合成从而提高乳脂率。乳体细胞数可以反映乳房的健康程度,体细胞数越高,牛乳房健康程度越差,牛乳房炎发病率越高。本试验中饲喂CS后乳体细胞数明显降低,表明奶牛乳腺得到良好的发育,乳房健康程度得到提高。
3.5 CS添加水平对奶牛氮表观消化率及氮排泄的影响
CS能以乙酰辅酶A的形式参与动物机体对蛋白质的调控,CS也可以通过抑制SS的分泌增加GH分泌量,促进动物对蛋白质的合成利用,同时,CS也可以通过调控瘤胃微生物,促进动物体对氮素的利用率,使得氮沉积增加进而减少动物体氮排泄。张军民等[18]给山羊瘤胃灌注CS后发现,瘤胃微生物活性增强,瘤胃内氨氮浓度降低,氮素有效利用率提高。张英杰等[19]给绵羊饲喂CS后发现,小肠中淀粉酶、胰蛋白酶、糜蛋白酶活性显著增高,小肠对蛋白质的消化吸收能力增强。本试验中,随着CS添加量的增加,试验组粪氮、尿氮、乳尿素氮排泄量均显著或极显著低于对照组,均以试验2组的水平最低,且CS的添加极显著降低了粪氮和乳尿素氮的排泄量,极显著提高了氮的消化利用率,提高了动物体氮沉积效率。氮排泄的降低、氮体内沉积效率的提高、氮消化利用率的提高一方面与饲料中的蛋白质在瘤胃内被降解为氨的速度受脲酶活性的影响有关,CS作为乙酰辅酶A的重要组成部分,是半胱氨酸的脱羧产物,能够抑制脲酶的活性,有效控制瘤胃内氨的爆发式释放,使氨较长时间稳定在一定的范围内,使瘤胃微生物有充分的时间利用氨合成MCP,降低了由于瘤胃内氨的释放速度大于微生物利用效率而损失的氮素,提高了瘤胃氮素利用率;另一方面饲喂CS后体内SS水平降低,SS对胃肠道消化液分泌和肠道养分吸收的抑制作用降低,小肠中淀粉酶、胰蛋白酶、糜蛋白酶活性的增高可以有效利用过瘤胃蛋白和瘤胃MCP,提高了小肠中蛋白质的消化利用程度,提高了小肠中的氮素利用率;其次,GH水平升高也是可以提高动物氮沉积和氮利用率的一个重要因素;此外,CS还可以通过提高IGF-1的水平提高氮素的利用率,IGF-1能通过内分泌、旁分泌和自分泌作用于靶细胞,引起合成代谢改变,促进蛋白质的转录及翻译水平,进而促进蛋白质的合成,GIF-1还能减少蛋白质的分解代谢和增强肝脏及肌肉摄取外源性氨基酸,从而促进蛋白质合成。
4 结论
奶牛饲粮中添加CS可以显著提高MCP产量、减少氮排泄、提高产奶性能,综合考虑上述指标,在本试验条件下,CS的适宜添加量为20 g/(d·头)。
[1] 王全军,毛胜勇,张红霞,等.半胱胺对山羊瘤胃微生物体外发酵的影响[J].华中农业大学学报,2002,21(6):535 -539.
[2] 卢炜,张磊,刘静,等.口服半胱胺对肉羊生产性能和血清激素水平的影响[J].江苏农业科学,2014,42(11):241-437.
[3] 沈赞明,张荣飞,解红梅,等.半胱胺盐酸盐对泌乳20~42周奶牛产奶性能和部分免疫指标的影响[J].畜牧兽医学报,2005,36(07):667 -673.
[4] 冯仰廉,陆治年.奶牛营养需要和饲料成分[M].3版.北京:中国农业出版社,2007:2.
[5] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:北京农业大学出版社,2007:49-74.
[6] CHEN X B,MAYUSZEWSKI W,KOWALCZYK J.Determination of allantoin in biological cosmetic and pharmaceutical samples[J].Journal of AOAC International,1996,79(03):628 -635.
[7] VALADARESR F D,BRODERICK G A,VALADARES FILHO S C,et al.Effect of replacing alfalfa silage with high moisture corn on ruminal protein synthesis estimated from excretion of total purine derivatives[J].Journal of Dairy Science,1999,82(12):2686-2696.
[8] 杨洪波,刘红,陈银岳,等.半胱胺盐酸盐对泌乳奶牛生产性能和血清激素水平的影响[J].动物营养学报,2014,26(7):1975 -1980.
[9] 黄雅莉,邹彩霞,韦升菊,等.体外产气法研究半胱胺对水牛瘤胃发酵参数和甲烷产气量的影响[J].动物营养学报,2014,26(01):125 -133.
[10] MCLEOD K R,HARMON D L,SCHILLO K K,et al.Cysteamine-induced depletion of somatostatin in sheep:time course of depletion and changes in plasma metabolites,insulin,and growth hormone[J].Journal of Animal Science,1995,73(01):77 -87.
[11] 沈赞明,申宜东,李嘉男,等.复合半胱胺盐酸盐对泌乳中期奶牛产奶性能的影响[J].中国畜牧兽医,2003,30(03):10 -13.
[12] KUNG L Jr,HUBER JT.Performance of high producing cows in early lactation fed protein of varying amounts,sources and degradability[J].Journal of Dairy Science,1983,66(02):227 -234.
[13] TAYLOR R B,HUBER JT,GOMEZ-ALARCON ,et al.Influence of protein degradability and evaporative cooling on performance of dairy cows during hot environmental temperatures[J].Journal of Dairy Science,1991,74(01):243 -249.
[14] 沈赞明,张荣飞,陈峰,等.复合半胱胺盐酸盐对泌乳后期奶牛产奶性能的影响[J].中国畜牧兽医,2004,31(08):9 -10.
[15] 崔立,陆天水,陈峰,等.半胱胺制剂对奶牛产奶性能的影响[J].上海交通大学学报:农业科学版,2001,19(04):271 -275.
[16] STAPLES C R,HEAD H H,DARDEN D E.Shortterm administration of bovine somatotropin to lactating dairy cows in a subtropical environment[J].Journal of Dairy Science,1988,71(12):3274 -3282.
[17] JOHNSON H D,MANALU R.Effect of somatotropin on milk yield and physiological responses during summer farm and hot laboratory conditions[J].Journal of Dairy Science,1991,74(04):1250 -1262.
[18] 张军民,杨国宇,王艳玲,等.灌注半胱胺对山羊瘤胃消化代谢的影响[J].河南农业大学学报,1998,32(02):118-132.
[19] 张英杰,刘月琴,孙洪新.饲喂半胱胺对绵羊小肠主要消化酶活性的影响[J].畜牧兽医学报,2006,37(10):999-1002.
