大肠高分化腺癌与其癌旁组织的质谱成像研究
2015-12-20于婷婷郑淑芳
何 滔,于婷婷,郭 赟,胡 骁,何 轩,郑淑芳
大肠高分化腺癌与其癌旁组织的质谱成像研究
何 滔,于婷婷,郭 赟,胡 骁,何 轩,郑淑芳
目的:探讨质谱成像技术在大肠高分化腺癌与其癌旁组织蛋白质组表达差异中的应用,寻找与大肠腺癌相关的蛋白质分子标志物。方法:应用质谱成像技术对人体大肠高分化腺癌及其癌旁组织术中冰冻活检组织进行质谱扫描,并用ClinProTools 2.0软件进行数据分析,采用遗传计算法计算峰面积,并进行t检验。结果:光镜下观察腺癌组织呈浸润和推挤式生长,癌旁组织显著纤维化伴炎细胞浸润,2种组织在大部分区域形成明显边界;腺癌组织与癌旁组织比较,表达显著差异蛋白多肽共11个,其中10个表达上调,1个表达下调。结论:对大肠高分化腺癌与其癌旁组织采用质谱成像技术进行对照研究能够直观反映出蛋白质分子差异,有希望在恶性肿瘤根治术中判断切缘是否有肿瘤组织残留发挥重要作用。
质谱成像;大肠腺癌;癌旁组织;蛋白质
0 引言
大肠癌是世界范围内最常见的胃肠道恶性肿瘤,目前通过手术及辅助放化疗等医疗手段,患者生存率已明显提高,但在已有远处转移的晚期患者中,5 a生存率仍仅有8%[1]。恶性肿瘤能否及时得到有效治疗及治愈,关键在于能否早期发现与诊断。目前临床实际工作中,大肠癌仍缺乏早期诊断特异性标志物[2],常用生化指标如癌胚抗原(carcino-embryonic antigen,CEA)特异性、敏感性都较差。
质谱成像(mass spectrometry imaging,MSI)是一种基于基质辅助激光解吸飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)的新兴分子成像技术。其将MALDI-TOF-MS和计算机技术结合起来,无需特殊的制片和染色,可以直接从生物组织切片表面获得任意分子量蛋白或小分子代谢物的空间分布信息,具有高灵敏度、高分辨率、高通量的优势。该技术最早于1997年被应用于研究生物组织中蛋白质的分布[3],目前在蛋白质、脂类和药物代谢等研究领域应用广泛[4-5]。
本研究探讨质谱成像技术在大肠高分化腺癌及其癌旁组织的蛋白质组表达差异中的应用,初步建立质谱成像技术探寻大肠腺癌生物标志物的方法,现介绍如下。
1 材料和方法
1.1 试剂
色谱纯98.5%基质三氟乙酸、乙腈、α-腈基-4-羟基肉桂酸、无水乙醇,美国Sigma公司生产。
1.2 仪器和材料
AutoFlex MALDI-TOF-MS质谱仪,ImagePrep工作站,导电载玻片,质谱成像分析软件FlexImaging 3.0、FlexControl和ClinProTools2.0(德国布鲁克公司);HM525冰冻组织切片机(德国美康公司);-80℃低温冰箱(赛默飞公司)。
1.3 方法
1.3.1 样本收集和储存
手术送检大肠腺癌及其癌旁组织标本,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗血水,消毒干纱布拭干,刀片切取肿瘤组织并包入铝箔,用液氮预冷后转至-80℃低温冰箱冻存。
1.3.2 冰冻切片、苏木精-伊红(hematoxylin-eosin,HE)染色
常规冰冻切片,切片厚度5 μm,常规HE染色、脱水、透明、封片。诊断标准[6]:高分化腺癌:呈腺管样或乳头样结构,浸润性生长,突破黏膜肌层浸润达黏膜下层和肌层,腺样结构超过肿瘤的95%;癌旁组织:距离肿瘤1~2 mm,大肠壁残留的正常间质及增生的纤维组织、胶原和炎细胞等。选取确诊的大肠高分化腺癌和癌旁组织标本进行质谱实验,共5例。
1.3.3 质谱成像组织切片样品制备
-20℃冰冻切片机,组织不使用包埋剂,切片厚度10 μm。将组织切片转移到导电载玻片上,乙醇浸泡。真空干燥5 min后,送入ImagePrep工作站进行芥子酸基质(10 mg/ml,乙腈∶水∶三氟乙酸=60∶40∶0.2)喷雾。组织切片喷雾结束后室温自然干燥5 min后,转移到不锈钢靶板上进行质谱分析。采用FlexImaging 3.0软件进行数据采集、ClinProTools 2.0软件进行数据分析,采用遗传计算法计算峰面积,再进行t检验,P值小于0.05确定为显著差异质谱峰。
2 结果
2.1 组织冰冻切片、HE染色结果
选取经病理医生确诊为大肠腺癌及其癌旁组织标本5例(如图1所示),光镜下观察腺癌组织呈浸润和推挤式生长,癌旁组织显著纤维化伴炎细胞浸润,腺癌组织与癌旁组织在大部分区域形成明显边界。
2.2 质谱扫描和数据分析结果
在光镜的观察引导下,选取大肠腺癌与癌旁组织扫描区域,癌旁组织扫描区域距离腺癌组织1~2mm,质谱扫描得到组织质谱峰图(如图2所示)。在大肠腺癌和癌旁组织质谱峰图中,多肽簇峰集中于质荷比(m/z)1 500~11 500之间。腺癌组织与癌旁组织比较,发现表达显著差异蛋白多肽共11个,其中10个表达上调,1个表达下调(如图3所示,见表1),部分蛋白多肽显著高表达于腺癌组织中(如图4所示)。
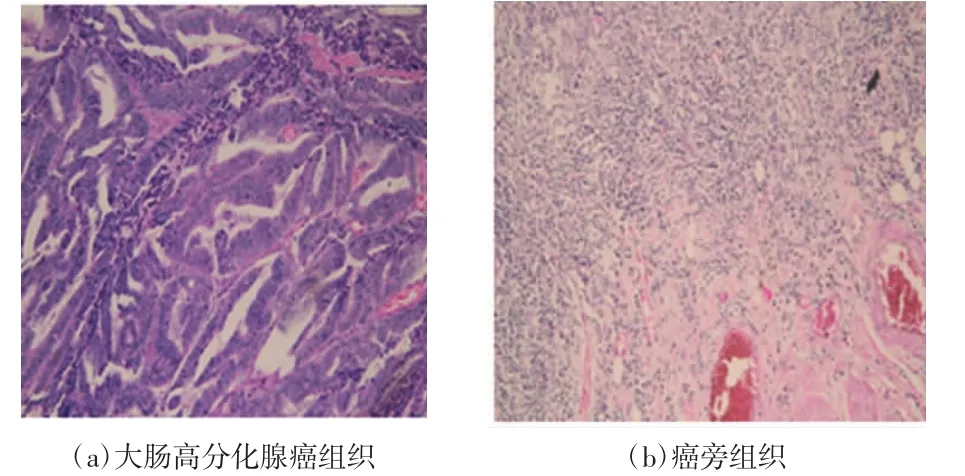
图1 组织冰冻切片、HE染色结果(×100)
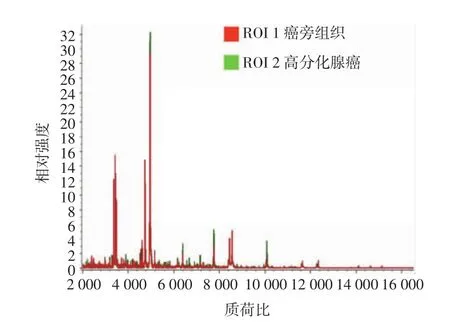
图2 癌旁组织和大肠腺癌质谱峰图
3 讨论
质谱成像技术是一种全新的分子成像技术,有较高的空间分辨力,可达8 μm[7];有较高的灵敏度和较宽的检测范围,可检测生物小分子、药物、多肽及蛋白质,样本处理简单。与其他蛋白质组研究技术相比,如双向凝胶电泳、毛细血管电泳、蛋白芯片等,质谱成像技术能在组织切片上直接对蛋白多肽进行定位分析,提供所研究蛋白多肽在组织中的分布信息,并进行相对定量分析。目前大部分质谱成像研究采用的是冰冻的新鲜组织,随着技术的改进,已经有学者将该技术应用于甲醛固定、石蜡包埋的组织[8],为进一步临床应用奠定了基础。有学者继而将质谱成像与组织芯片技术相结合,能高通量、快速、同时对上百种组织进行比较研究[9-10]。目前,质谱成像技术在疾病机理的研究中已广泛应用,尤其是在恶性肿瘤领域,如恶性黑色素瘤[11]、结肠癌[12]、卵巢癌[13]、乳腺癌[14]等。
在肿瘤的发生发展过程中,癌旁组织起到了至关重要的作用,如血管生成、小淋巴管增生、炎症因子表达、间质纤维化等,影响肿瘤生长、转化、侵袭、转移等生物学行为[15-16]。质谱成像技术在选取扫描区域时,与HE染色切片进行实时比对,可选取距离肿瘤1~2 mm的癌旁组织进行研究,有效避免肿瘤组织干扰。但前期试验中发现,如果对低分化肿瘤进行研究,选择扫描区域应稍远离肿瘤组织,否则难以避免肿瘤组织干扰。
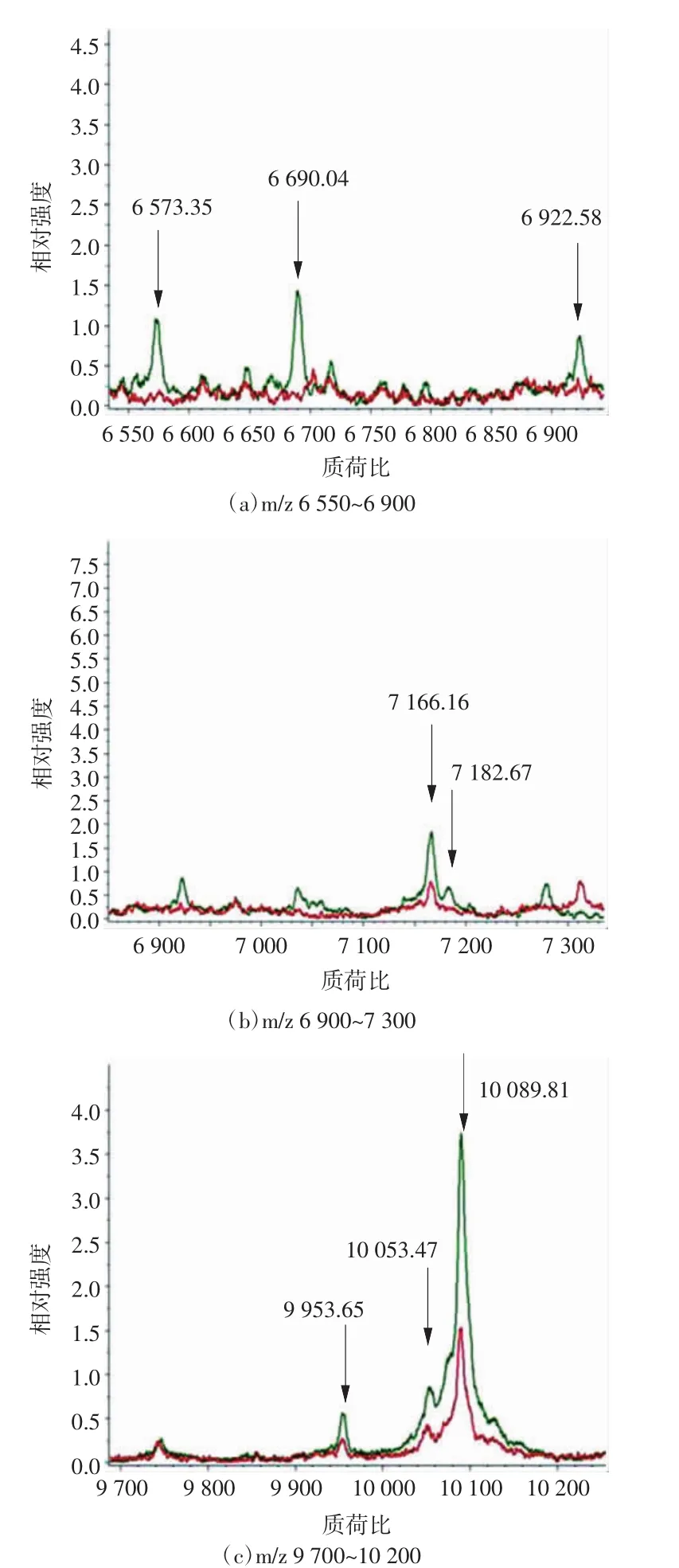
图3 表达具有显著差异的蛋白多肽图
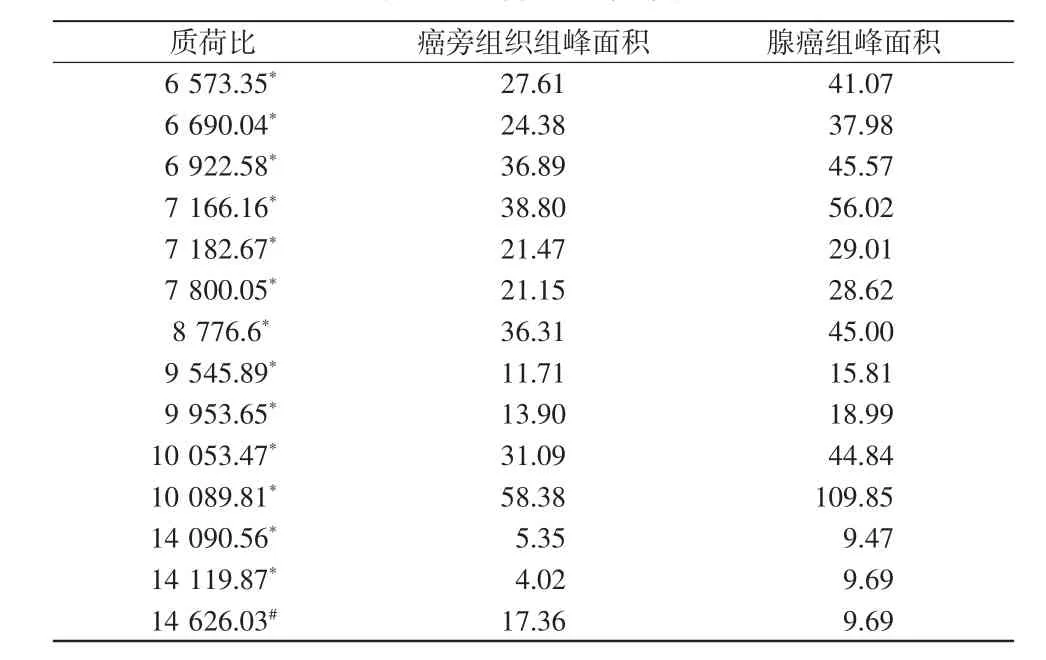
表1 差异分子统计表

图4 组织切片的扫描图和MALDI IMS图(×40)
Lee等[17]运用质谱成像技术对非小细胞肺癌与癌旁组织进行比较研究,发现磷脂质的表达谱能够准确区分癌及癌旁组织,准确度达92.9%,且在腺癌和鳞状细胞癌中也有明显表达差异。Meding等[18]运用质谱成像技术分别对来自食管、乳腺、结肠、肝、胃和甲状腺的6种腺癌组织进行比较,并成功鉴别了来源于结肠的肝转移性腺癌。本实验将腺癌组织与癌旁组织进行比较,发现显著差异蛋白多肽共11个,其中上调10个,下调1个,其中m/z 6 573.35和m/z 10 089.81 2种蛋白在肿瘤与癌旁组织中差异比较大,图4(c)和(f)显示了这2种差异蛋白的空间分布,可以看出这2种蛋白主要分布在腺癌组织中。前期对大肠高分化腺癌与大肠腺瘤的质谱成像研究中,发现与腺瘤相比,m/z 6 573.35和m/z 10 089.81 2种蛋白同样高表达于腺癌组织中,提示这2种蛋白可能为大肠腺癌组织的生物标志物,有待于在进一步研究中明确[19]。但目前由于技术限制,对组织中蛋白多肽进行直接鉴定仍是难点[20-21]。
随着质谱成像技术的成熟和临床应用,其可用于标记肿瘤组织的边界,有望能在恶性肿瘤根治术中判断切缘是否有肿瘤组织残留发挥重要作用。
[1]Comella P,Casaretti R,Franco L A,et al.Optimizing the management of metastatic colorectal cancer[J].CriticalReviewsinOncology/ Hematology,2010,75(1):15-26.
[2]张会涛,刘晓珺,沈滨,等.结直肠癌外周血肿瘤标志物的研究进展[J].世界华人消化杂志,2011,19(10):991-995.
[3]Caprioli R M,Farmer T B,Gile J.Molecular imaging of biological samples:localization of peptides and proteins using MALDI-TOF MS[J].Anal Chem,1998,69(23):4 751-4 760.
[4]Chughtai K,Heeren R M.Mass spectrometric imaging for biomedical
(▶▶▶▶)(◀◀◀◀)tissue analysis[J].Chem Rev,2010,110(5):3 237-3 277.
[5]Moritake S,Taira S,Sugiura Y,et al.Magnetic nanoparticle-based massspectrometryforthedetectionofbiomoleculesinculturedcells[J]. J Nanosci Nanotechnol,2009,9(1):169-176.
[6]Hamilton S R,Aalton L A.Pathology and genetics of tumours of the digestive system[M].Lyon:IARC Press,2000:105-143.
[7]Nilsson A,Fehniger T E,Gustavsson L,et al.Essential tactics of tissue preparation and matrix nano-spotting for successful compound imagingmassspectrometry[J].JProteomics,2010,73(6):1270-1278.
[8]Norris J L,Caprioli R M.Analysis of tissue specimens by matrix-assisted laser desorption/ionization imaging mass spectrometry in biological and clinical research[J].Chem Rev,2013,113(4):2 309-2 342.
[9]Casadonte R,Caprioli R M.Proteomic analysis of formalin-fixed paraffin-embedded tissue by MALDI imaging mass spectrometry[J]. Nat Protoc,2011,6(11):1 695-1 709.
[10]Steurer S,Borkowski C,Odinga S,et al.MALDI mass spectrometric imaging based identification of clinically relevant signals in prostate cancer using large-scale tissue microarrays[J].Int J Cancer,2013,133(4):920-928.
[11]Gwendoline T,Shchepinov M S,Southern E M,et al.Multiplex target protein imaging in tissue sections by mass spectrometry——TAMSIM[J].Rapid Commun Mass Spectrom,2007,21(6):823-829.
[12]Shimma S,Sugiura Y,Hayasaka T,et al.MALDI-based imaging mass spectrometry revealed abnormal distribution of phospholipids in colon cancer liver metastasis[J].Journal of Chromatography B,2007,855(1):98-103.
[13]Lemaire R,Menguellet S A,Stauber J,et al.Specific MALDI imaging and profiling for biomarker hunting and validation:fragment of the 11S proteasome activator complex,reg alpha fragment,is a new potential ovary cancer biomarker[J].J Proteome Res,2007,6(11):4 127-4 134.
[14]Rauser S,Marquardt C,Balluff B,et al.Classification of HER2 receptor status in breast cancer tissues by MALDI imaging mass spectrometry[J].J Proteome Res,2010,9(4):1 854-1 863.
[15]Lu P F,Weaver V M,Zena W.The extracellular matrix:a dynamic niche in cancer progression[J].J Cell Biol,2012,196(4):395-406.
[16]Ozbek S,Balasubramanian P G,Chiquet-ehrismann R,et al.The evolution of extracellular matrix[J].Mol Biol Cell,2010,21(24):4 300-4 305.
[17]Lee G K,Lee H S,Park Y S,et al.Lipid MALDI profile classifies non smallcelllungcancersaccordingtothehistologictype[J].LungCancer,2012,76(2):197-203.
[18]Meding S,Nitsche U,Balluff B,et al.Tumor classification of six common cancer types based on proteomic profiling by MALDI imaging[J].J Proteome Res,2012,11(3):1 996-2 003.
[19]何滔,郭赟,何轩,等.大肠高分化腺癌与大肠腺瘤的质谱成像[J].世界华人消化杂志,2013,21(34):3 806-3 812.
[20]Cazares L H,Dean T,Sawas M,et al.Imaging mass spectrometry of a specific fragment of mitogen-activated protein kinase/extracellular signal-regulated kinase 2 discriminates cancer from uninvolved prostate tissue[J].Clin Cancer Res,2009,15(17):5 541-5 551.
[21]Hanselmann M,Kothe U,Kirchner M,et al.Toward digital staining using imaging mass spectrometry and random forests[J].J Proteome Res,2009,8(7):3 558-3 567.
(收稿:2014-12-25 修回:2015-04-15)
Mass spectrometry imaging of colorectal well-differentiated adenocarcinoma and paracarcinoma tissues
HE Tao1,YU Ting-ting2,GUO Yun3,HU Xiao4,HE Xuan1,ZHENG Shu-fang1
(1.Department of Pathology,the Affiliated Hospital of Logistics University of PAP,Tianjin 300162,China; 2.Bruker Daltonics Company,Beijing 100081,China;3.Department of Endocrinology and Hematology, the Affiliated Hospital of Logistics University of PAP,Tianjin 300162,China;4.Tianjin Key Laboratory for Biomarkers of Occupational and Environment Hazard,Tianjin 300162,China)
Objective To identify specific protein molecular markers for colorectal adenocarcinoma,and to compare welldifferentiated colorectal adenocarcinoma tissues with pericarcinomatous tissues using mass spectrometry imaging technology.Methods Frozen biopsy of colorectal well-differentiated adenocarcinoma and paracarcinoma tissues underwent mass spectrometry imaging,and ClinProTools 2.0 software was used for data analysis.Genetic algorithm was applied to the calculation of the peak area,and t-test was carried out.Results Optical microscope found that adenocarcinoma tissues showed infiltrative growth,paracarcinoma tissues had fiberized appearance accompanied by phlogocyte infiltration,and that the two kinds of tissues had clear boundaries in most areas.When compared with paracarcinoma tissues,adenocarcinoma tissues had 11 polypeptides expressed significantly differently,including 10 up-regulated ones and 1 down-regulated case.Conclusion Mass spectrometry imaging can intuitively reflect the differences in the protein molecules between well-differentiated adenocarcinoma of the colon and its adjacent tissues,which may be used to determine whether there is residual tumor tissue during malignant tumor operation.[Chinese Medical Equipment Journal,2015,36(12):19-21,45]
mass spectrometry imaging;colorectal adenocarcinoma;paracarcinoma tissue;protein
R318;R445
A
1003-8868(2015)12-0019-04
10.7687/J.ISSN1003-8868.2015.12.019
天津市应用基础及前沿技术研究计划面上基金资助项目(11JC YBJC13000);武警后勤学院面上基金资助项目(WYMZ201009);武警后勤学院青年基金资助项目(WYQ201101)
何 滔(1981—),男,主治医师,主要从事临床病理及消化系统肿瘤方面的研究工作,E-mail:hetao_1981@163.com。
300162 天津,武警后勤学院附属医院病理科(何 滔,何轩,郑淑芳),内分泌血液科(郭 赟);100081 北京,布鲁克·道尔顿公司(于婷婷);300162天津,天津市职业与环境危害生物标志物重点实验室(胡 骁)
郑淑芳,E-mail:zhengshf@126.com
