麦胚内源蛋白酶主要特性研究
2015-12-20杨润强王淑芳顾振新
杨润强 王淑芳 顾振新
(南京农业大学食品科技学院,南京 210095)
麦胚内源蛋白酶主要特性研究
杨润强 王淑芳 顾振新
(南京农业大学食品科技学院,南京 210095)
研究了麦胚蛋白酶的主要特性。结果显示:麦胚蛋白酶主要被饱和度为20%~60%的硫酸铵沉淀,其水解酪蛋白的最佳反应温度为50℃,30℃保温30 min其活性无显著下降;麦胚蛋白酶活性在pH为5.5和7.5时较高,且在pH 5.5条件下放置30 min其活性无显著下降。pH 5.5时,Mg2+、Mn2+、Ba2+、胃酶抑素A(Pepstatin A)、碘乙酸(IAA)、苄磺酰氟(PMSF)和乙二胺四乙酸(EDTA)强烈抑制其活性,而 Li+、Ca2+、Cu2+、2-ME和二硫苏糖醇(DTT)显著促进其活性。pH 7.5时,Pepstatin A、IAA、PMSF和EDTA显著抑制蛋白酶活性。pH 5.5和7.5时,麦胚蛋白酶对酪蛋白的Km分别为0.562和4.935 mg/mL,且亲和力比以牛血清蛋白、卵清蛋白和明胶为底物时高。麦胚蛋白酶主要为半胱氨酸蛋白酶和丝氨酸蛋白酶。
麦胚 内源蛋白酶 主要特性
种子发芽过程中,内源蛋白酶被激活可将储藏蛋白水解为可溶性蛋白、多肽和氨基酸,这对胚芽发育起重要作用[1-2]。天冬氨酸蛋白酶、半胱氨酸蛋白酶、丝氨酸蛋白酶及金属蛋白酶4组蛋白酶存在于发芽大麦和绿麦芽中,这些蛋白酶的催化机制不同且可被不同的抑制剂所抑制[3]。
通过微生物发酵制备的工业用蛋白酶因混入了一些微生物毒素而存在着使用不安全的因素[4],而植物蛋白酶具有无毒无害的优点。Ratnaparkhe等[5]研究了火炬松种子在发芽、发芽完成及幼苗形成过程中金属蛋白酶的表达特性。Ogbonna等[6]从高粱麦芽 KSV8-11中纯化到一种蛋白酶。Timotijevic′等[7]从荞麦种子中发现了几种天冬氨酸蛋白酶。然而,对小麦胚芽内源蛋白酶的研究不多[8]。
小麦磨粉过程中剔除的麦胚,其蛋白质质量分数高达30%,但是目前没有得到充分利用。近年来,有关以麦胚蛋白为原料制备生物活性肽,如抗氧化肽[9]、降血压肽[10]的研究报道居多,但是鲜见麦胚蛋白酶特性研究报道。本试验对麦胚内源蛋白酶基本特性进行了初步研究,旨在为利用麦胚内源蛋白酶降解自身蛋白制备麦胚生物活性肽提供依据。
1 材料与方法
1.1 材料
小麦胚芽:中国徐州同源面粉有限公司。麦胚于-20℃保存待用。酪蛋白、明胶、碘乙酸(IAA)、胃酶抑素A(Pepstatin A)、乙二胺四乙酸(EDTA)、苄磺酰氟(PMSF):美国Sigma公司。
1.2 粗酶液提取
蛋白酶的提取参照 Wen等[11]的方法。取2 g麦胚,加10 mL柠檬酸 -磷酸氢二钠缓冲液(含5 mmol/L巯基乙醇),研磨匀浆,6 000×g冷冻离心30 min,取上清液,用于蛋白酶活力分析。
1.3 蛋白酶初步纯化
准确量取一定体积的酶提取液,然后缓慢加入相应饱和度(从0~100%)的固体硫酸铵并缓慢搅拌,静置1 h后,6 000×g离心30 min,整个过程在4℃条件下进行。测定上清液中残留的酶活力和酶蛋白含量。沉淀于-20℃保存待用。
1.4 蛋白酶酶学特性分析
1.4.1 最适反应温度和温度稳定性
量取1.0 mL粗酶液与1.0 mL质量浓度为20 mg/mL的酪蛋白在30~80℃范围内反应10 min,然后测定蛋白酶活力。蛋白酶温度稳定性测定是在测定活力前,酶液在不同温度下放置30 min后用酪蛋白法测定蛋白酶活力。
1.4.2 最适反应pH和酸碱稳定性
量取1.0 mL粗酶液与1.0 mL质量浓度为20 mg/mL的酪蛋白在pH 2.5~9.5范围内反应10 min(50℃),然后测定蛋白酶活力。蛋白酶pH稳定性测定是在测定活力前,酶液在不同pH下孵育30 min后用酪蛋白法测定蛋白酶活力。
1.4.3 金属离子对酶活力的影响
酶液分别与 Li+、Ca2+、Cu2+、Zn2+、Mg2+、Mn2+和Ba2+混合后用酪蛋白法测定酶活力。反应液中金属离子的终物质的量浓度为2 mmol/L。
1.4.4 添加物对酶活力的影响
酶液分别与 Pepstatin A、IAA、PMSF、EDTA、L-cysteine、GSH、β-ME、和 DTT混合后用酪蛋白法分别在pH 5.5和7.5条件下测定酶活力。以未加任何添加物所测得的活力为对照(100%)。
1.4.5 底物特异性
分别以酪蛋白、明胶、牛血清蛋白和卵清蛋白为底物,分别在pH 5.5和7.5条件下用游离氨基酸法测定酶活力,各底物的质量浓度为20 mg/mL。以酪蛋白为底物时的酶活力为对照(100%)。
1.4.6 米氏常数
采用双倒数作图的方法测定米氏常数。分别在pH 5.5和7.5条件下测定酶反应速率,然后拟合反应曲线并计算米氏常数(Km)。
1.5 蛋白酶活力测定
1.5.1 酪蛋白法
在Wen等[11]提供的蛋白酶活力测定方法的基础上稍作修改。以酪蛋白溶液(质量浓度为20 mg/mL)作为底物,1 mL的底物溶液和1 mL的酶提取液在50℃下保温反应10 min,之后在90℃水浴中保温5 min以灭酶,然后加入 2 mL TCA(0.6 mol/L)溶液,于室温下沉淀未反应的蛋白质,时间为15 min左右。蛋白酶活力是通过测定A275的增加值来计算,即1 g麦胚酶提取液每分钟产生1μg酪氨酸,定义为1个蛋白酶活力。对照管与上述所加组分相同,但在酶反应前加入TCA溶液。
1.5.2 游离氨基酸法
酶水解酪蛋白、明胶、牛血清蛋白和卵蛋白,然后测定游离氨基酸含量[12]。1 mL粗酶液加入4 mL 0.1 mol/L柠檬酸缓冲液和1 mL质量浓度为20 mg/mL的酪蛋白,50℃条件下保温1 h,然后加入2 mL 0.6 mol/L的三氯乙酸终止反应。离心后,2 mL上清液加入3 mL茚三酮溶液后煮沸15 min,然后用15 mL 60%的乙醇溶液定容。570 nm下测定吸光值,计算出增加的游离氨基酸量,以亮氨酸作为标准。1 h产生1μg游离氨基酸定义为1个酶活力单位。
1.6 可溶性蛋白含量测定
以牛血清蛋白为标准,采用考马斯亮蓝G-250法测定[13]。
1.7 数据统计方法
采用SPSS 18.0进行显著性分析,n=3,显著水平为P<0.05和P<0.01;结果以平均值±标准差表示。
2 结果与讨论
2.1 蛋白酶初步纯化
粗蛋白酶采用硫酸铵分级沉淀法纯化。结果显示(图1),在硫酸铵饱和度为0~20%范围内,粗提液中蛋白酶活力无显著变化,在硫酸铵饱和度为20%~60%范围内,蛋白酶活力急剧下降;随着硫酸铵饱和度的增加,蛋白质含量成直线下降趋势。90%左右的酶活力集中于由20%~60%硫酸铵饱和度所沉淀的蛋白质中。硫酸铵分级沉淀后,大部分杂蛋白被除去,麦胚内源蛋白酶得以纯化。

图1 不同硫酸铵饱和度沉淀后对残余酶活力和蛋白质的影响
2.2 最适温度和热稳定性
随着酶作用温度的升高,麦胚蛋白酶活力呈先升高后下降的趋势,其最适反应温度为50℃(图2a)。当蛋白酶于30℃水浴保温30 min后,活力无显著下降(P<0.05),但是在高于30℃时,蛋白酶活力缓慢下降(图2b)。当酶处于低温条件下,其活力未被激活而较低;但是处于过高温度下时,酶蛋白因空间结构被破坏而失去催化活性,合适的反应温度对于酶反应至关重要。本研究的麦胚蛋白酶最适反应温度与Singh等[14]的研究相似。有研究发现休眠黑麦种子蛋白酶最适温度为40~45℃,且在60℃条件下保温150 min,其蛋白酶活力为最初活力的40%[15]。麦胚蛋白酶反应环境温度温和,且不耐热。

图2 温度对酶活力及其稳定性的影响
2.3 最适pH和pH稳定性
由图3a可知,以酪蛋白为底物,麦胚蛋白酶具有pH 5.5和pH 7.5 2个催化组分。随着pH值的升高,蛋白酶活力先升高,然后急剧下降。当pH 7.0时,酶活力仅为pH 5.5时的50%左右,可能是因为粗提液中蛋白酶种类复杂,在pH 7.0各种蛋白酶活力均较低。在碱性条件下,pH 7.5时的蛋白酶活力均高于其他pH下的活力。图3b显示,当蛋白酶在pH 5.5条件下保温30 min后,其活力无显著下降,而在其他pH条件下保温30 min后酶活力显著下降。可见过低或过高的pH都会导致蛋白酶失活。
有研究发现,在大麦中,天冬氨酸蛋白酶和半胱氨酸蛋白酶、丝氨酸蛋白酶以及金属蛋白酶最适反应条件为酸性、中性及碱性条件[3]。本研究中蛋白酶在pH 5.5和7.5时具有较高活性。有研究报道,小麦、高粱和大麦半胱氨酸蛋白酶的最适反应pH分别为 4.0[12]、3.8[6]及 4.0[16],丝氨酸蛋白酶的最适pH分别为 7.5[17]、7.9[18]及 8.0[19]。
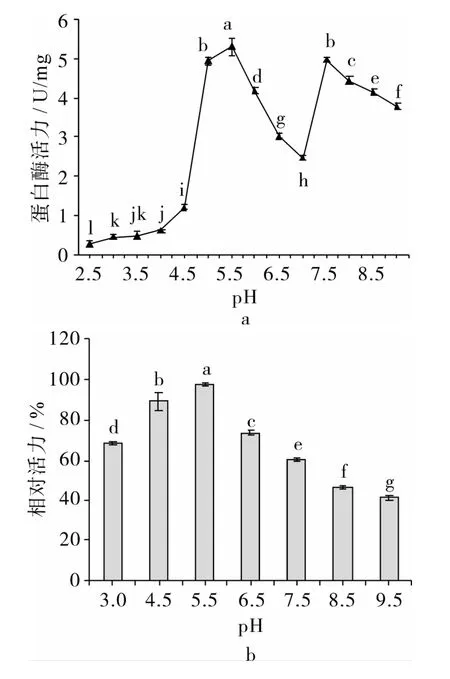
图3 pH对蛋白酶活力及稳定性的影响
2.4 金属离子对蛋白酶活力的影响
从表1可以看出,在pH为5.5时,2 mmol/L的Li+、Ca2+和 Cu2+使蛋白酶活力分别提高 10.69%、13.31%和 100.07%,而 Mg2+、Mn2+和 Ba2+使蛋白酶活力分别降低5.52%、4.72%和9.64%;当pH为7.5时,Cu2+显著激活蛋白酶活力,而 Zn2+、Mn2+和Ba2+强烈抑制其活力。

表1 金属离子对蛋白酶活力的影响
某些金属离子作为酶的辅酶是通过改变酶蛋白的空间结构影响酶的活性。业已证明Cu2+和Ca2+能有效促进蛋白酶活力,而某些重金属离子严重抑制蛋白酶活力[6]。本研究发现,当 pH 5.5时,Cu2+显著促进蛋白酶活力,这与Fahmy等[12]报道的结果相反,可能是由于酶反应体系不同所导致。当pH 7.5时,金属离子对蛋白酶的影响轻微,说明金属离子不为丝氨酸蛋白酶所必需。
2.5 添加物对蛋白酶活力的影响
从表2可以看出,在pH 5.5和pH 7.5,Pepstatin A、IAA、PMSF和EDTA均抑制麦胚蛋白酶活力。当pH 5.5时,碘乙酸对蛋白酶活力有明显的抑制作用,当pH 7.5时,PMSF明显抑制蛋白酶活力。β-ME和DTT在pH 5.5时明显促进蛋白酶活力,而其他物质对蛋白酶活力没有显著影响。说明麦胚蛋白酶中存在4种蛋白酶。IAA和PMSF分别在pH 5.5和pH 7.5时显著抑制麦胚蛋白酶活性,这表明主要的蛋白酶种类为半胱氨酸蛋白酶和丝氨酸蛋白酶。Fahmy等[12]报道了小麦半胱氨酸蛋白酶能被碘乙酸盐(iodoacetate)和p-HMB强烈抑制,最适反应温度为50℃。Wang等[20]从小麦种子中发现了丝氨酸蛋白酶,其活性被PMSF强烈抑制。在其他植物中也发现了丝氨酸蛋白酶如铁海棠[18]、蘑菇[17]等。在小麦中,天冬氨酸蛋白酶和金属蛋白酶的研究鲜见报道。而 Fontanini等[21]和 Jones[3]从绿麦芽中分离得到一种碱性蛋白酶,此蛋白酶为金属蛋白酶且最适反应pH为8.0。本研究中,pepstatin A和EDTA分别在pH 5.5和7.5时对蛋白酶有轻微的抑制作用,表明少量的天冬氨酸蛋白酶和金属蛋白酶存在于小麦胚芽中。

表2 添加物对麦胚蛋白酶活力的影响
2.6 对不同底物的水解能力
麦胚蛋白酶对不同底物的水解能力由表3显示。pH 5.5时,蛋白酶对不同底物的亲和力顺序为酪蛋白、牛血清蛋白、明胶和卵蛋白。而当pH 7.5时,蛋白酶对不同底物的亲和力顺序为酪蛋白、牛血清蛋白、卵蛋白和明胶。在不同的pH条件下,酶的活性及底物溶解度不同。本研究中蛋白酶种类复杂,且具有不同的反应pH值,从而导致酶对不同底物的水解能力截然不同。Jaouadi等[22]研究结果显示,短小芽孢杆菌碱性蛋白酶对不同底物的水解能力顺序为:酪蛋白(100%)>明胶(95%)>偶氮酪蛋白(80%)>角质素(65%)>偶氮角质素(63%)>牛血清蛋白(52%)>麦谷蛋白(20%)>卵清蛋白(15%)。本研究中,麦胚蛋白酶对酪蛋白的水解能力均大于明胶、牛血清蛋白及卵清蛋白。

表3 麦胚蛋白酶对不同底物的相对活力
2.7 动力学常数
图4显示,当pH为5.5和7.5时,麦胚蛋白酶对酪蛋白的米氏常数分别为0.562和4.935 mg/mL,说明麦胚蛋白酶在酸性条件下对酪蛋白的亲和力比碱性条件下高。通过专一抑制剂对酶活力影响可知,麦胚蛋白酶由天冬氨酸蛋白酶、半胱氨酸蛋白酶、丝氨酸蛋白酶及金属蛋白酶4种蛋白酶组成,其米氏常数受许多因素影响,如底物种类、测定时的pH值等。在pH 8.0条件下,以偶氮清蛋白及N-succinyl-Ala-Ala-Ala-p-nitroanilide为底物时,乳胶半胱氨酸蛋白酶的 Km分别为(22.0±0.5)mmol/L及(4.1±0.25)mmol/L[23],表明特定的蛋白酶对不同底物的Km值不同。Yadav等[18]报道,以酪蛋白为底物,铁海棠丝氨酸蛋白酶的Km为33.3μmol/L。本研究中,麦胚蛋白酶Km值为0.562 mg/g及4.935 mg/g,可能是由于在不同pH条件下各种蛋白酶被激活的程度不同。

图4 pH 5.5及pH 7.5时酶的Km值
3 结论
麦胚中存在天冬氨酸蛋白酶、半胱氨酸蛋白酶、丝氨酸蛋白酶及金属蛋白酶,其中以半胱氨酸蛋白酶及丝氨酸蛋白酶为主,两者最适反应温度均为50℃,最适反应pH分别为5.5和7.5,当pH 5.5时,麦胚蛋白酶可被Cu2+、Ca2+及 Li+强烈激活,当 pH 7.5时,被 Zn2+强烈抑制。麦胚蛋白酶对酪蛋白的亲和力高于牛血清蛋白、卵蛋白和明胶,且pH 5.5时麦胚蛋白酶对酪蛋白的亲和力高于pH 7.5时的亲和力。
[1]李翠娟.糙米发芽过程中内源蛋白酶特性及主要含氮物质变化研究[D].南京:南京农业大学,2011
[2]Enari T M,Sopanen T.Mobilisation of endospermal reserves during the germination of barley[J].Journal of the Institute of Brewing,1986,92(1):25-31
[3]Jones B L.Endoproteases of barley and malt[J].Journal of Cereal Science,2005,42(2):139-156
[4]Finn E,Pursifull A,Limardi L,et al.Complexity of the immune response to a protease and implications for the safety assessment of novel enzyme-containing products[J].Toxicology Letters,2003,144 s33
[5]Ratnaparkhe S M,Egertsdotter E U,Flinn B S.Identification and characterization of a matrix metalloproteinase(Pta1-MMP)expressed during Loblolly pine(Pinus taeda)seed development,germination completion,and early seedling establishment[J].Planta,2009,230(2):339-354
[6]Ogbonna A,Obi S,Okolo B,et al.Purification and some properties of a protease from sorghum malt variety KSV8-11[J].Journal of the Institute of Brewing,2003,109(3):179-186
[7]Timotijevic'G S,Milisavljevic'M-D,Radovic'SR,et al.Various forms of aspartic proteinases in buckwheat seeds[C].Proceeding of the9th International Symposium on Buckwheat,2004,158-166
[8]Yoshida C,Danno G.Partial purification and some properties of protease from wheat germ and flour[J].Agricultural and Biological Chemistry,1991,55(9):2401-2402
[9]Hu L,Song R,Gu Z.An antioxidant peptide produced by autolysis reactions from wheat germ[J].African Journal of Biotechnology,2012,11(15):3640-3648
[10]Yang R,Zou Y,Yu N,et al.Accumulation and identification of angiotensin-converting enzyme inhibitory peptides from wheat germ [J].Journal of Agricultural and Food Chemistry,2011,59(8):3598-3605
[11]Wen H,Cao X,Gu Z,et al.Effects of components in the culture solution on peptides accumulation during germination of brown rice[J].European Food Research and Technology,2009,228(6):959-967
[12]Fahmy A S,Ali A A,Mohamed S.A.Characterization of a cysteine protease from wheat Triticum aestivum(cv.Giza164)[J].Bioresource Technology,2004,91(3):297-304
[13]Yang R,Yin Y,Guo Q,et al.Purification,properties and cDNA cloning of glutamate decarboxylase in germinated faba bean(ViciafabaL.)[J].Food Chemistry,2013,138 1945-1951
[14]Singh A N,Shukla A K,Jagannadham M,et al.Purification of a novel cysteine protease,procerain B,fromCalotropisprocerawith distinct characteristics compared to procerain[J].Process Biochemistry,2010,45(3):399-406
[15]Brijs K,Bleukx W,Delcour J A.Proteolytic activities in dormant rye(Secale cereale L.)grain[J].Journal of Agricultural and Food Chemistry,1999,47(9):3572-3578
[16]Mohamed SA,Abdel-Gany SS,Fahmy A S.Purification and characterization of two cysteine proteases from germinated barley seeds[J].Bulletin of the National Research Centre(Cairo),2005,30(1):73-93
[17]Zhang X,Liu Q,Zhang G,et al.Purification and molecular cloning of a serine protease fromthe mushroomHypsizigusmarmoreus[J].Process Biochemistry,2010,45(5):724-730
[18]Yadav SC,Pande M,Jagannadham M.Highly stable glycosylated serine protease from the medicinal plant Euphorbiamilii[J].Phytochemistry,2006,67(14):1414-1426
[19]Chen TE,Huang DJ,Lin Y H.Isolation and characterization of a serine protease from the storage roots of sweet potato(Ipomoeabatatas[L.]Lam)[J].Plant science,2004,166(4):1019-1026
[20]Wang R,Liu S,Wang J,et al.Purification,characterization and identification of a senescence related serine protease in dark-induced senescent wheat leaves[J].Phytochemistry,2013,95 118-126
[21]Fontanini D,Jones B.Study of metallopeptidase isozymes from malted barley(Hordeumvulgarecv.Morex)[J].Journal of Agricultural and Food Chemistry,2001,49(10):4903-4911
[22]Jaouadi B,Ellouz-Chaabouni S,Rhimi M,et al.Biochemical and molecular characterization of a detergent-stable serine alkaline protease from Bacillus pumilus CBSwith high catalytic efficiency[J].Biochimie,2008,90(9):1291-1305
[23]Kumar Dubey V,Jagannadham M.Procerain,a stable cysteine protease from the latex ofCalotropisprocera[J].Phytochemistry,2003,62(7):1057-1071.
Main Properties of Wheat Germ Endogenous Protease
Yang Runqiang Wang Shufang Gu Zhenxin
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095)
Proteases properties of wheat germ were investigated in the paper.Proteolytic enzymes in the wheat germ extract were proved to be concentrated in 20%~60%saturation of ammonium sulfate precipitate.Casein was utilized as substrate,and the preliminarily purified protease could found to have the optimal activity at 50℃,maximal temperature stability at 30℃.The protease had a higher activity at pH 5.5 and pH 7.5.It could keep the maximum activity for 30 min at pH 5.5.The protease was inhibited by Mg2+,Mn2+,Ba2+,pepstatin A,IAA,PMSF and EDTA,and stimulated by Li+,Ca2+,Cu2+,2-ME and DTT.In addition,with casein as substrate,pepstatin A,IAA,PMSF and EDTA decreased protease activity significantly at pH 7.5.At pH 5.5 and 7.5,the enzyme had Kmof 0.562 and 4.935 mg/mL,respectively.The protease had the higher affinity to casein than bovine serum albumin,ovalbumin and gelatin.As a result,wheat germ proteases mainly were cysteine protease and serine protease.
wheat germ,endogenous protease,main properties
Q556+.3
A
1003-0174(2015)09-0001-06
2014-04-23
杨润强,男,1984年出生,讲师,食品中功能成分的富集技术
顾振新,男,1956年出生,教授,生物技术与功能食品
