酶法提取罗非鱼内脏鱼油及脂肪酸组成分析
2015-12-20王倩倩陆剑锋姜绍通
王倩倩 吕 顺 陆剑锋 姜绍通 林 琳
(合肥工业大学生物与食品工程学院安徽省农产品精深加工重点实验室,合肥 230009)
酶法提取罗非鱼内脏鱼油及脂肪酸组成分析
王倩倩 吕 顺 陆剑锋 姜绍通 林 琳
(合肥工业大学生物与食品工程学院安徽省农产品精深加工重点实验室,合肥 230009)
对酶法提取罗非鱼内脏鱼油的工艺条件进行研究,并对提取鱼油的基本理化性质和脂肪酸组成进行分析。考察了酶种类、酶解温度、pH、液料比、加酶量和酶解时间对罗非鱼内脏鱼油提取率的影响,通过单因素试验和响应面法优化得到酶法提取罗非鱼内脏鱼油的最佳工艺条件为:酶解温度50℃、pH 7.5、液料比5∶1、加酶量3 400 U/g、酶解时间1 h。在此条件下,鱼油提取率达到88.95%,酸价达到SC/T 3502—2000的粗鱼油一级标准。罗非鱼内脏鱼油中饱和脂肪酸相对质量分数为36.66%,单不饱和脂肪酸和多不饱和脂肪酸分别占总脂肪酸质量的38.13%和25.18%,表明罗非鱼内脏鱼油是一种营养品质较高的油脂。
罗非鱼 胰蛋白酶 鱼油 响应面法 脂肪酸
罗非鱼(Tilapia)俗名非洲鲫鱼,属于硬骨鱼类纲鲈形目丽鱼科罗非鱼属,原产非洲,肉质洁白,营养丰富,味道鲜美,备受人们的青睐。2008年我国罗非鱼产量达到110万t[1]。罗非鱼是我国淡水养殖产量提高最快的品种,出口产量主要以冷冻鱼片为主。由于罗非鱼体型较扁,鱼片利用率只占整条鱼的46%,而鱼片加工废弃物却占54%,其中鱼头占26.5%,内脏占6.8%,鱼排占16.5%,鱼鳞占2.2%[2]。罗非鱼在加工过程中产生大量的可食用和不可食用的副产物,充分利用这些物质,不仅可以提高鱼类生产加工的附加值,还能够有效减少环境污染,带来更大的经济效益。鱼内脏中含有大量油脂,是优质鱼油的生产原料。鱼油中富含各种不饱和脂肪酸、脂溶性维生素及其他成分,其中ω-3型多不饱和脂肪酸具有特殊的生物活性,在生物系统中有广泛的功能。临床研究已经证实,ω-3型多不饱和脂肪酸有促进大脑发育、降低患心血管疾病的风险、抗炎抗肿瘤等生理作用[3-5]。
随着人们认识的不断深入,鱼油相关产品越来越畅销,进一步刺激了人们对于鱼油提取及浓缩方法的研究[6]。酶解法是利用蛋白酶对蛋白质进行水解,破坏蛋白质和脂肪的结合关系,从而释放出油脂。酶法提油技术以其温和的提取条件不仅保护了油脂的有效成分及增加油脂的溶出[7],而且为淡水产品的附加值和资源的利用提供了一种行之有效的方法。该法生产的鱼油质量高,同时可以充分利用蛋白酶水解产生的酶解液(含有小肽和氨基酸)生产各种功能性多肽和海鲜调味料等产品。因此利用酶解法提取罗非鱼内脏鱼油对于淡水鱼废弃物的综合利用和环境保护具有重要意义。本研究以罗非鱼内脏为原料,通过蛋白酶酶解法,运用响应面法优化鱼油提取条件,旨在找出一条适合于工业化生产罗非鱼鱼油的方法,同时对提取鱼油的理化性质和脂肪酸组成进行初步分析,以期为罗非鱼内脏的高值化综合利用提供参考。
1 材料与方法
1.1 材料与试剂
罗非鱼内脏:广东省明基水产品有限公司。
风味蛋白酶(2.5×104U/g):北京索莱宝科技有限公司;胃蛋白酶(0.5×104U/g):上海源聚生物科技有限公司;胰蛋白酶(5×104U/g):国药集团化学试剂有限公司;木瓜蛋白酶(7.7×105U/g):南宁庞博生物工程有限公司;碱性蛋白酶(5×104U/g)、中性蛋白酶(5×104U/g):北京奥博星生物技术有限责任公司。
1.2 仪器与设备
FSH-2A可调高速匀浆机:江苏金坛市荣华仪器制造有限公司;PHS-3C精密pH计:上海大谱仪器有限公司;CT15RT台式高速冷冻离心机:上海天美生化仪器设备工程有限公司;FA1104N电子分析天平:上海民桥精密科学仪器有限公司;Saturn2200气质联用仪:美国Varian公司。
1.3 试验方法
1.3.1 鱼油提取工艺流程

1.3.2 操作要点
1.3.2.1 原料的预处理
将罗非鱼内脏取出,鱼胆中有分解鱼油的成分,会影响鱼油的提取率,因而要小心去除鱼胆。用自来水反复清洗,除去血渍杂物等,将表面水分沥干后,内脏置于匀浆机中搅碎,使样品处于均匀一致的状态。
1.3.2.2 内脏鱼油的提取
称取一定量预处理后的罗非鱼内脏,置于锥形瓶中,加水调节液料比(mL/g),用 4 mol/L NaOH或者HCl调节至一定初始pH,然后加入一定量胰蛋白酶,置于水浴锅中,于一定温度下酶解一定时间,90℃灭酶5~15 min。在酶解过程中,每隔一段时间摇1次。随后趁热在5 000 r/min离心15 min,将离心管垂直放于-20℃冷冻2 h后,分离出上层油脂即为粗鱼油,以鱼油提取率为指标来考察提取效果。

式中:原料中鱼油的质量/g,即为粗脂肪含量,粗脂肪测定参照GB/T 5009.6—2003,以无水乙醚为溶剂,采用索氏抽提法进行测定。
1.3.3 罗非鱼内脏鱼油提取工艺条件的确定
1.3.3.1 单因素试验
根据前期预试验的试验结果,分别考察酶种类、酶解温度、酶解时间、pH、料液比和加酶量对罗非鱼内脏鱼油提取率的影响。
1.3.3.2 酶法提取罗非鱼内脏鱼油工艺条件优化
在单因素试验结果的基础上,采用Box-Behnken试验设计,以罗非鱼鱼油提取率Y为目标函数,分别以酶解温度、pH、液料比、加酶量对应4个独立变量X1、X2、X3、X4,采用四因素五水平的响应面分析法优化酶解罗非鱼鱼油提取工艺条件,试验因素水平见表1。模型选用二阶方程:

式中:Y为因变量;β0为常数项;βi为一次项系数;βii为二次项系数;βij为交互项系数;Xi、Xj为自变量。

表1 Box-Behnken试验因素水平表
1.3.4 罗非鱼内脏鱼油理化性质测定
将优化条件下提取的罗非鱼内脏鱼油的理化性质进行测定,其中感官评定:参照SC/T 3502—2000;水分及挥发物含量测定:参照GB/T 5528—2008,直接干燥法;酸价测定:参照GB/T 5530—2005,热乙醇测定法;过氧化值测定:参照GB/T 5538—2005,硫代硫酸钠滴定法;碘价测定:参照GB/T 5532—2008,硫代硫酸钠滴定法;不溶性杂质含量测定:参照GB/T 15688—2008,坩埚式过滤器法。
1.3.5 罗非鱼内脏鱼油脂肪酸组成分析
样品甲酯化[6]:称取提取的鱼油样品约0.4 g置于锥形瓶中,加入0.5 mol/L氢氧化钾-甲醇溶液4 mL,置于60℃水浴锅上皂化30 min(油珠完全消失),冷却后加入12.5%硫酸-甲醇溶液40 mL,于60℃水浴上酯化5 min,冷却,将之倒入盛有45 mL蒸馏水的分液漏斗中,加入正己烷2 mL,放掉下层,用饱和氯化钠水溶液2 mL洗涤至少3次,取上清液再加入适量无水硫酸钠颗粒,混匀、静置后取上清液在4 000 r/min条件下离心10 min,用0.22μm微孔过滤膜过滤后贮存于试剂瓶中(-20℃),待GCMS分析。
GC条件:cp-sil8CB毛细管柱(30 m×0.25 mm×0.25μm);载气:高纯氦;分流比:50∶1;流速:1.0 mL/min;进样口温度260℃;程序升温条件:起始温度50℃,以12℃/min升温至260℃,保持8 min,再以30℃/min升温至300℃,保持5 min。MS条件:电离方式EI;离子源温度150℃;电离能量70 eV;扫描质量范围30~650。通过对 NIST谱库检索,对脂肪酸进行定性,然后通过面积归一化法确定其相对百分含量。
2 结果与讨论
2.1 罗非鱼内脏鱼油提取水解用蛋白酶的筛选
在酶各自建议水解条件下,液料比为4∶1,加酶量为1 000 U/g的条件下对罗非鱼内脏酶解3 h,不同酶解处理对罗非鱼内脏鱼油提取率的影响见表2。从表2可以看出,采用的蛋白酶不同,鱼油的提取率也有所不同,其中胰蛋白酶处理的鱼油提取率最高,达到了85.51%。不同蛋白酶的水解能力不同,主要是因为不同蛋白酶对肽键的专一性不同。胰蛋白酶的专一性广泛,能很好地随机水解肽键,从而有效破坏脂肪分子与蛋白质分子的结合关系,释放出油脂[8],从而提高鱼油提取率。所以采用胰蛋白酶进行后续试验,对胰蛋白酶水解罗非鱼内脏提取鱼油的工艺条件进行优化。

表2 不同蛋白酶对鱼油提取率的影响
2.2 酶解温度对鱼油提取率的影响
在胰蛋白酶酶解时间3 h、pH 7.5、液料比4∶1、加酶量1 000 U/g的条件下,分别在酶解温度为40、45、50、55、60℃时提取鱼油,考察酶解温度对鱼油提取率的影响,结果见图1。由图1可知,40~50℃范围内,鱼油提取率随着温度的升高而增加。随着温度的升高,加速酶解反应处于主导地位,鱼油提取率表现出来的趋势是上升的。当温度超过50℃时,酶解速度加快的同时,酶失活的速度更快,此时提取率表现出来的趋势是下降的。因此选择50℃为适宜的酶解温度。

图1 酶解温度对鱼油提取率的影响
2.3 酶解时间对鱼油提取率的影响
在胰蛋白酶酶解温度50℃、pH 7.5、液料比4∶1、加酶量1 000 U/g的条件下,分别在酶解时间为0.5、1.0、1.5、2.0、2.5、3.0 h时提取鱼油,考察酶解时间对鱼油提取率的影响,结果见图2。由图2可知,酶解反应前1 h内鱼油提取率有较大变化,在1 h时达到84.67%,这主要是由于随着酶解时间的延长,使得酶与底物的作用比较彻底,能够充分破坏脂肪和蛋白质的关系,释放出脂肪分子。此后随着酶解时间的延长,鱼油提取率逐渐增加,但增加不明显。另外,酶解时间越长,鱼油中的多不饱和脂肪酸越易发生氧化,会降低鱼油的品质。因此,从工作效率及设备利用、能耗、提油率增加量等经济衡量的角度考虑,选择1 h为适宜的酶解时间,在响应面试验中不作为主要因素考察。

图2 酶解时间对鱼油提取率的影响
2.4 酶解pH对鱼油提取率的影响
在胰蛋白酶酶解温度50℃、酶解时间3 h、液料比4∶1、加酶量1 000 U/g的条件下,分别在酶解pH为5、6、7、8、9时提取鱼油,考察酶解pH对鱼油提取率的影响,结果见图3。由图3知,酶解pH在5.0~7.0范围内,随着pH的提高,提取率也增加,这表明提高pH可促进脂肪组织水解,将更多的油脂释放出来。当酶解pH为7.0时,提取率最高,而随着pH的进一步提高,提取率反而降低。每种酶都有特定的适用pH范围,而显著的酶活性只发生在非常窄的pH范围内,因为蛋白酶和底物蛋白质均有解离基团,只有这些解离基团处于特定的解离状态时,酶分子与底物蛋白质分子才会快速结合,生成产物的速度也最快[12],所以只有在特定的pH范围条件下,酶解效果才会最好。因此,选择pH 7.0为适宜的酶解pH。

图3 酶解pH对鱼油提取率的影响
2.5 液料比对鱼油提取率的影响
在胰蛋白酶酶解温度50℃、酶解时间3 h、pH 7.5、加酶量1 000 U/g的条件下,分别在液料比为1∶2、1∶1、2∶1、3∶1、4∶1(V/W,mL/g)时提取鱼油,考察料液比对鱼油提取率的影响,结果见图4。由图4可知,随着液料比的增大,提取率呈现先上升后下降的趋势,当液料比达到3∶1时鱼油提取效果最好。当液料比较低时,溶质的流动性差,酶和底物结合不充分,反应不易进行。随着液料比的升高,溶质的流动性增强,鱼油提取率增加。当液料比过大时,虽然使得底物分散更均匀,溶解度增加,但酶和底物的浓度均下降,二者接触的机会就减少,影响油脂的释放,从而影响鱼油提取率。实际上,当液料比过大时,不仅使得鱼油提取率降低,而且增加了之后离心分离的难度及浓缩的成本。考虑到酶解效果和经济成本等条件,选择液料比为3∶1。

图4 液料比对鱼油提取率的影响
2.6 加酶量对鱼油提取率的影响
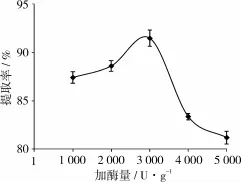
图5 加酶量对鱼油提取率的影响
在胰蛋白酶酶解温度50℃、酶解时间3 h、pH 7.5、液料比 4∶1,分别在加酶量为 1 000、2 000、3 000、4 000、5 000 U/g时提取鱼油,考察加酶量对鱼油提取率的影响,试验结果见图5。由图5可知,随着酶量的增加,鱼油提取率逐渐升高,主要是因为酶解蛋白质后,被蛋白质包被的脂肪被释放,随着酶添加量增加被释放的脂肪量也增加。当加酶量为3 000 U/g时,提取率最高,而随着酶量的进一步增加,提取率反而降低。当酶过量时,由于酶本身的相互水解作用加强,会阻碍酶对底物的水解,从而使得鱼油提取率降低。因此,选择加酶量为3 000 U/g。
2.7 酶解工艺参数的响应面优化
在单因素试验结果的基础上,采用 Box-Behnken试验设计,响应面试验设计及结果见表3。对表3中数据进行回归拟合,得到罗非鱼内脏鱼油提取率Y对酶解温度(X1)、pH(X2)、液料比(X3)和加酶量(X4)4个因素的二次多元回归方程为:


表3 响应面试验设计及结果
运用Design-expert V8.0软件,得到罗非鱼内脏鱼油提取率回归方程的方差分析如表4所示。由表4可知,模型的决定性系数R2=0.90较大,说明二次多项式回归效果好,失拟项P=0.173 9>0.05,失拟项不显著。模型的变异系数CV=1.06%<10%,表明具有较好的试验稳定性。整体模型的P<0.000 1,说明该二次方程模型达到极显著水平。综合以上分析可知,各因素值和响应值间的关系可以用此模型函数化。模型的一次项X2极显著,X3和X4高度显著;二次项X22极显著,X32和X42高度显著,X12显著;交互项和其他各项均不显著。由此可以看出各因素对于罗非鱼鱼油提取率的影响不是简单的线性关系。剔除回归方程中的不显著项,简化后的方程为:


表4 回归模型显著性检验及方差分析
根据回归方程,做出响应面和等高线,考察拟合响应曲面的形状,分析各参数对罗非鱼内脏鱼油提取率的影响。由图6可以看出:酶解pH对罗非鱼内脏鱼油提取率的影响最为显著,曲线变化幅度较大;其次为加酶量和液料比,两因素对鱼油提取率的影响近似相同;酶解温度对鱼油提取率的影响最小,曲线变化幅度平缓。由图6a、图6d、图6e可知:pH值较低时,随着pH的升高,鱼油提取率呈上升趋势,而超过一定的pH值,鱼油提取率反而下降,由试验分析得出的结论与理论上酶存在最适pH的性质是一致的;等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,圆形则相反。由图6可知,酶解温度、pH、液料比、加酶量4个因素之间的交互作用均较小,这与方差分析的结果相符。


图6 各两因素交互作用的响应曲面和等高线图
为了进一步确证最佳的酶解工艺条件,将所得回归方程分别对各自变量取一阶偏导等于零,得到最佳酶解工艺条件为:酶解温度49.45℃、pH 7.47、液料比4.61∶1、加酶量 3 390 U/g。此时预测值为90.34%。考虑到实际操作的便利,将酶解工艺参数修正为酶解温度50℃、pH 7.5、液料比5∶1、加酶量3 400 U/g。为了检测该模型预测的可靠性,对优化条件进行验证试验,重复3次,得到罗非鱼鱼油提取率平均值为88.95%,与理论预测值无著性差异(P>0.05)。
2.8 罗非鱼内脏粗鱼油理化性质测定
最佳提取条件下得到的粗鱼油外观呈浅黄色,稍有浑浊,具有浓鱼腥味,其理化性质分析见表5。由表5可以看出,粗鱼油的过氧化值偏高,超过粗鱼油的二级标准,这可能是由于鱼类内脏中含有丰富的金属离子促进了多不饱和脂肪酸的氧化而导致过氧化值较高。酸价较低,达到粗鱼油的一级标准。碘价低于粗鱼油的二级标准,这可能是由于罗非鱼属于淡水鱼类,多不饱和脂肪酸含量比较低,而且加热过程中的热处理使得不饱和脂肪酸氧化变质,从而使得碘价偏低[9]。粗鱼油中的水分及挥发物、杂质含量偏高,还需进一步精制除去,从而提高鱼油质量,以达到工业或食用的目的。

表5 罗非鱼内脏粗鱼油理化性质
2.9 罗非鱼鱼油脂肪酸组成分析
对酶法提取的罗非鱼鱼油进行气相色谱分离,并采用质谱仪分析其脂肪酸组成,结果见表6。分析结果表明,罗非鱼鱼油主要由C14~C22脂肪酸组成,饱和脂肪酸相对质量分数为36.66%,其中以棕榈酸为主;不饱和脂肪酸相对质量分数为63.31%,其中单不饱和脂肪酸主要由油酸和棕榈油酸组成,占脂肪酸质量分数的38.13%;多不饱和脂肪酸相对质量分数为25.18%,其中亚油酸的含量最高,其次为DHA、γ-亚麻酸,同时还含有少量的EPA。张立坚等[10]通过GC-MS对罗非鱼内脏鱼油的脂肪酸组成进行研究,主要脂肪酸组成为油酸28.03%、棕榈酸20.97%、亚油酸13.41%、棕榈油酸11.54%,与本测定结果略有差别,这可能是由于罗非鱼体内的脂肪酸随产地、季节等的变化而略微有变化。

表6 罗非鱼鱼油脂肪酸组成
3 结论
本试验以响应面法优化了胰蛋白酶酶解罗非鱼内脏制备鱼油的最佳工艺条件,得到最佳工艺条件:酶解温度50℃,pH 7.5,液料比5∶1,加酶量3 400 U/g,酶解时间1 h,实际测得鱼油提取率为88.95%,与预测值90.34%无显著性差异。因此,基于响应面分析所得的优化提取工艺参数准确可靠,对于罗非鱼废弃物的再利用具有实用价值。在最佳工艺条件下,得到的粗鱼油呈浅黄色、稍有浑浊,具有鱼腥味,粗鱼油的理化指标中酸价达到了SC/T 3502—2000标准的粗鱼油一级标准。GC-MS检测分析表明,酶法提取的鱼油中饱和脂肪酸相对质量分数为36.66%,以棕榈酸为主;单不饱和脂肪酸相对质量分数为38.13%,以油酸和棕榈油酸为主,多不饱和脂肪酸相对质量分数为25.18%,以亚油酸为主,其中DHA和EPA分别为1.95%和2.87%,表明罗非鱼内脏鱼油是一种营养品质较高的油脂。
[1]郝向举,译.全球罗非鱼的生产与消费[J].中国水产,2012(3):43-44
[2]吴燕燕,李来好,岑剑伟,等.酶法由罗非鱼加工废弃物制取调味料的研究[J].南方水产,2006,2(1):50-53
[3]Eckert GP,Franke C,Noldner M,et al.Plant derived omega-3-fatty acids protect mitochondrial function in the brain[J].Pharmacological Research,2010,61(3):234-241
[4]Micallef M A,Garg M L.Beyond blood lipids:phytosterols,statins and omega-3 polyunsaturated fatty acid therapy for hyperlipidemia[J].The Journal of Nutritional Biochemistry,2009,20(12):927-939
[5]Benais-Pont G,Dupertuis Y M,Kossovsky M P,et al.O-mega-3 polyunsaturated fatty acids and ionizing radiation:combined cytotoxicity on human colorectal adenocarcinoma cells[J].Nutrition,2006,22(9):931-939
[6]张伟伟,陆剑锋,焦道龙,等.钾法提取斑点叉尾鮰内脏油的工艺研究[J].食品科学,2009,30(24):42-46
[7]卢时勇,钱俊青,邹小明.酶法提取米渣蛋白工艺的研究[J].中国粮油学报,2005,20(2):1-4
[8]刘书成,章超桦,洪鹏志,等.酶解法从黄鳍金枪鱼鱼头中提取鱼油的研究[J].福建水产,2007,(1):46-50
[9]吉宏武,洪鹏志,章超桦,等.罗非鱼油的制备及其脂肪酸组成分析[J].福建水产,2005,(2):51-57
[10]张立坚,杨会邦,蔡春.3种淡水鱼油脂肪酸的含量分析[J].食品研究与开发,2011,32(4):115-117.
Extraction of Fish Oil from Tilapia Viscera by Enzyme and Analysis of Fatty Acid Composition
Wang Qianqian LüShun Lu Jianfeng Jiang Shaotong Lin Lin
(College of Biotechnology and Food Engineering,Key Laboratory for Agriculture Products Processing of Anhui Province,Hefei University of Technology,Hefei 230009)
The technology of extracting fish oil from tilapia viscera by enzyme has been optimized in the paper.The basic physical and chemical characteristics and fatty acid composition were analyzed.The effects of enzyme species,temperature of hydrolysis,pH value,liquid-material ratio and enzyme concentration of fish oil extraction rate were researched.The single factor experiment and response surface methodology were used to determine the optimum conditions to extract fish oil from the tilapia viscera.The optimal temperature,pH,liquid-material ratio and enzyme concentration were 50℃,7.5,5∶1 and 3 400 U/g,respectively.On the conditions,the fish oil extraction rate was 88.95%with its acid value attached the primary standard of crude fish oil(SC/T 3502—2000).The relative content of saturated fatty acid of fish oil extracted from tilapia viscera was 36.66%.Monounsaturated fatty acids and polyunsaturated fatty acids were 38.13%and 25.18%respectively.The results indicated that the fish oil extracted from tilapia viscera could be regarded as a fat of high nutritional quality.
tilapia,trypsin,fish oil,response surface methodology,fatty acid
TS254.9
A
1003-0174(2015)09-0072-07
国家农业科技成果转化资金(2012GB2C300 202),广东省教育部产学研结合重点项目(2012B09 1000121)
2014-04-01
王倩倩,女,1990年出生,硕士,粮食、油脂与植物蛋白工程
林琳,女,1978年出生,副教授,水产品加工副产物综合利用
