原发性骨肉瘤18F-FDG PET/CT影像特征及预后评价
2015-12-20FENGJin
冯 瑾 FENG Jin
王争明2 WANG Zhengming
张连娜1 ZHANG Lianna
杨 芳1 YANG Fang
原发性骨肉瘤18F-FDG PET/CT影像特征及预后评价
冯 瑾1FENG Jin
王争明2WANG Zhengming
张连娜1ZHANG Lianna
杨 芳1YANG Fang
作者单位
1.北京积水潭医院核医学科 北京 100035
2. 解放军第二炮兵总医院PET/CT中心 北京100088
目的 探讨骨肉瘤18F-FDG PET/CT显像的影像学特征,及其对评价骨肉瘤患者预后的价值。资料与方法 回顾性分析经病理证实的30例原发性骨肉瘤患者的同机PET/CT影像学特点,获得肿瘤病灶最大标准化摄取值(SUVmax)和CT值,计算肿瘤体积;根据有无肿瘤复发、转移或死亡计算无病生存时间;比较CT表现为不同组织成分的SUVmax,分析各部位SUVmax与对应CT值的相关性及影响预后的因素。结果 28例CT表现为骨质破坏、20例斑片样或棉絮样低密度瘤骨、24例软组织肿块及16例骨膜反应均表现为18F-FDG摄取增高,17例象牙质等高密度瘤骨呈低摄取。高密度瘤骨SUVmax低于骨质破坏、低密度瘤骨、软组织肿块SUVmax(F=5.196,P<0.01)。骨质破坏、低密度瘤骨、高密度瘤骨、软组织肿块SUVmax与对应的CT值呈负相关(r=-0.315,P<0.01)。30例患者平均无瘤生存时间为(36.9±14.9)个月。Kaplan-Meier曲线分析显示,SUVmax≥9患者的无病生存时间较SUVmax<9患者长(χ2=0.696,P<0.05)。Cox回归分析显示SUVmax是影响预后的独立因素(Wald=4.213,P<0.05)。结论18F-FDG PET/CT实现了对原发性骨肉瘤解剖结构改变和代谢变化的优势互补,结合半定量分析有助于找到复杂结构肿瘤中生物活性最高的部分,低密度/高代谢瘤骨提示高度恶性;骨肉瘤原发病灶的SUVmax越高,患者预后越差。
骨肉瘤;正电子发射断层显像术;体层摄影术,X线计算机;氟脱氧葡萄糖F18;预后
骨肿瘤来源于有成骨潜能的间叶细胞,是常见的肿瘤之一,其诊断及治疗依赖临床、影像学检查和病理检查相结合,近20年来,随着外科技术、影像技术及化疗的进展,保肢术逐渐成为治疗肢体恶性骨肿瘤的首选方法,而对肿瘤的定性诊断、侵袭范围、监测复发、治疗效果、评价预后等方面的准确评估意义重大,目前主要依赖影像学方法,其中X线、CT及MRI为主要检查手段,PET功能影像的发展提供了新的诊断思路,需要将功能影像与解剖影像结合起来,为骨肉瘤的诊断及治疗提供更有力的技术支持[1-2]。PET/CT可以用于评价多种恶性肿瘤的预后[3-4],但用于骨肉瘤患者预后的研究较少。本研究拟讨论原发性骨肉瘤18F-FDG PET/CT显像的特征、骨肉瘤不同CT表现的SUVmax差异及其与CT值的关系,探讨骨肉瘤原发病灶SUVmax评价骨肉瘤患者预后的价值。
1 资料与方法
1.1 研究对象 选择2007年12月—2011年2月在北京积水潭医院接受手术治疗的30例肢体原发性骨肉瘤患者,男14例,女16例;年龄8~43岁,平均(17.6±9.5)岁。纳入标准:①肢体原发骨肉瘤,术前穿刺活检诊断明确,并经术后病理证实;②病变部位无病理性骨折;③病变部位无手术史;④化疗前接受全身PET/CT检查;⑤均接受瘤段截除或瘤段截除关节置换术,术后获得瘤段截除标本的病理结果。肿瘤部位:肱骨上段4例,股骨上段2例,股骨下段14例,胫骨上段6例,腓骨上段4例。
1.2 PET/CT显像仪器与方法 采用GE Discovery STE PET/CT显像仪,显像剂为18F-FDG注射液(北京原子高科医药有限公司),放化纯>90%。患者空腹6 h以上,静脉注射18F-FDG 3.70~5.55 MBq/kg,饮水1000 ml,安静休息60 min,排尿后行螺旋CT平扫及PET发射扫描,扫描范围从脚底至颅顶。CT扫描参数:电压140 kV,电流120 mA,螺距0.875 mm,层厚3.75 mm;PET发射扫描采用二维采集3 min/床位。
1.3 PET/CT图像重建与融合 PET图像重建采用有序子集最大期望值迭代法(0SEM),图像衰减校正采用CT采集数据。CT采用标准法重建,矩阵512×512,分别重建为层厚3.75 mm及1.25 mm图像,3.75 mm层厚图像用于与PET图像通过Xeleris工作站进行融合,1.25 mm层厚图像包括软组织窗和骨窗,用于分析肿瘤CT征象。
1.4 影像分析
1.4.1 影像特征分析 由2名主治以上放射科医师及核医学医师采用盲法分别独立阅片,再共同分析PET/CT图像。CT影像特征包括骨质破坏、肿瘤骨、骨膜反应或骨膜三角和软组织肿块,分析同机PET影像,包括放射性浓集部位、程度、范围、形状等。由放射科医师及核医学医师共同阅片,对照PET与CT同机融合影像,分析CT影像不同组织成分区域PET代谢特征。
1.4.2 肿瘤体积测量 由2名放射科医师及核医学医师独立在PET/CT各扫描方位上选取最大层面,得出肿瘤的最大长轴、冠状轴、矢状轴,并根据肿瘤的椭球模型计算肿瘤体积[5],肿瘤体积=π/6×长轴×冠状轴×矢状轴。
1.4.3 SUVmax及CT值的获得 选取PET/CT影像矢状断层骨肉瘤最大截面,手工勾画感兴趣区,获得病灶SUVmax。在同机融合PET/CT影像定位骨质破坏区、肿瘤骨、软组织肿块区,进行点测量,其中肿瘤骨根据其CT影像组织密度不同分为等于或大于正常骨皮质密度肿瘤骨(以下简称高密度瘤骨)及低于正常骨皮质密度肿瘤骨(以下简称低密度瘤骨),获得不同组织成分SUVmax及CT值。
1.5 随访 30例患者均采用电话或定期门诊随访,随访终点包括肿瘤复发、转移、死亡或最近的随访时间点,根据有无肿瘤复发、转移或死亡计算患者的无病生存时间。
1.6 统计学方法 采用SPSS 17.0软件,根据Shapiro-Wilk正态性检验,各组数据呈正态分布。CT表现为不同组织成分的SUVmax行单因素方差分析,两两比较采用LSD法;各部位SUVmax与对应的CT值的相关性行Pearson相关分析;以SUVmax和病灶体积为变量指标,进行Cox回归分析;对原发灶SUVmax及无病生存时间进行Kaplan-Meier分析,绘制无瘤生存曲线,P<0.05表示差异有统计学意义。
2 结果
2.1 PET/CT影像学特征 骨肉瘤CT表现为骨质破坏、肿瘤骨、软组织肿块或肿胀、层状骨膜反应或骨膜三角,对应以上不同表现PET影像呈现不同的代谢状态,并可通过测量SUVmax量化不同部位的代谢程度,见表1及图1~7。其中因软组织肿胀非肿瘤细胞侵犯部位、骨膜反应及骨膜三角面积较小,均未测量SUVmax。
2.2 骨肉瘤不同组织成分SUVmax比较 30例患者原发性骨肉瘤病灶平均SUVmax为8.7±5.1(2.7~21.6),病灶SUVmax位于软组织肿块14例,位于骨破坏区8例,位于瘤骨区8例,不同组织成分SUVmax平均值见表2。

表1 30例原发性骨肉瘤患者的PET/CT特征

图1 女,19岁,左股骨下骨肉瘤。A~C分别为横断面PET图像、CT图像、PET/CT融合图像,CT所见溶骨破坏区(箭,B)在PET图像上表现为葡萄糖代谢增高(箭,A),SUVmax为7.0,对应的CT值为85.4 HU

图2 男,13岁,右肱骨上段骨肉瘤。A~C分别为横断面PET图像、CT图像、PET/CT融合图像,CT所见溶骨破坏区(箭,B)PET表现为葡萄糖代谢减低(箭,A),SUVmax为2.8,对应的CT值为44.6 HU

图3 女,38岁,右股骨远端骨肉瘤。A~C分别为横断面PET图像、CT图像、PET/CT融合图像,CT所见象牙质高密度瘤骨(箭,B)PET表现为葡萄糖代谢稀疏区(箭,A),SUVmax为2.2,对应的CT值为1201.8 HU

图4 女,8岁,左腓骨上段骨肉瘤。A~C分别为横断面PET图像、CT图像、PET/CT融合图像,CT所见棉絮样低密度瘤骨(箭,B)PET表现为葡萄糖代谢明显增高(箭,A),SUVmax为8.0,对应的CT值为147 HU
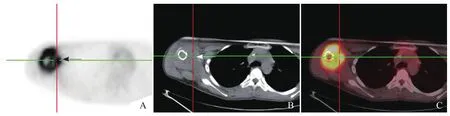
图5 男,13岁,右肱骨上段骨肉瘤。A~C分别为横断面PET图像、CT图像、PET/CT融合图像,CT示软组织肿块(箭,B)PET表现为葡萄糖代谢明显增高(箭,A),SUVmax为13.6,对应的CT值为37.2 HU

图6 女,21岁,左股骨下段骨肉瘤。A~C分别为横断面PET图像、CT图像、PET/CT融合图像,CT示软组织水肿(箭,B)PET未见明显葡萄糖代谢增高(箭,A),SUVmax为2.3,对应的CT值为17.3 HU
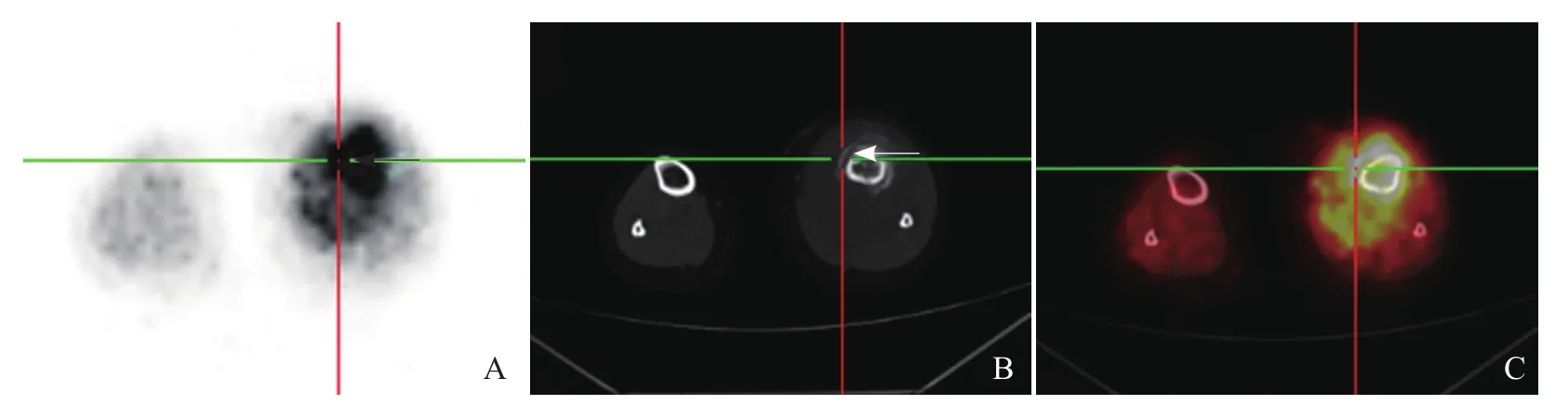
图7 男,11岁,左胫骨上段骨肉瘤。A~C分别为横断面PET图像、CT图像、PET/CT融合图像,CT示骨膜反应(箭,B)PET呈葡萄糖代谢增高(箭,A),与周围肿瘤组织相延续

表2 骨肉瘤不同组织成分SUVmax比较
不同组织成分SUVmax比较:骨肉瘤溶骨破坏、高密度瘤骨、低密度瘤骨、软组织肿块SUVmax差异有统计学意义(F=5.196,P<0.01)。两两比较结果显示,溶骨破坏区、低密度瘤骨、软组织肿块SUVmax高于高密度瘤骨,差异有统计学意义(P<0.05);低密度瘤骨、软组织肿块、溶骨破坏区SUVmax比较,差异无统计学意义(P>0.05)。
Pearson相关分析结果显示,各部位SUVmax与对应的CT值呈负相关(r=-0.315,P<0.01),见图8。
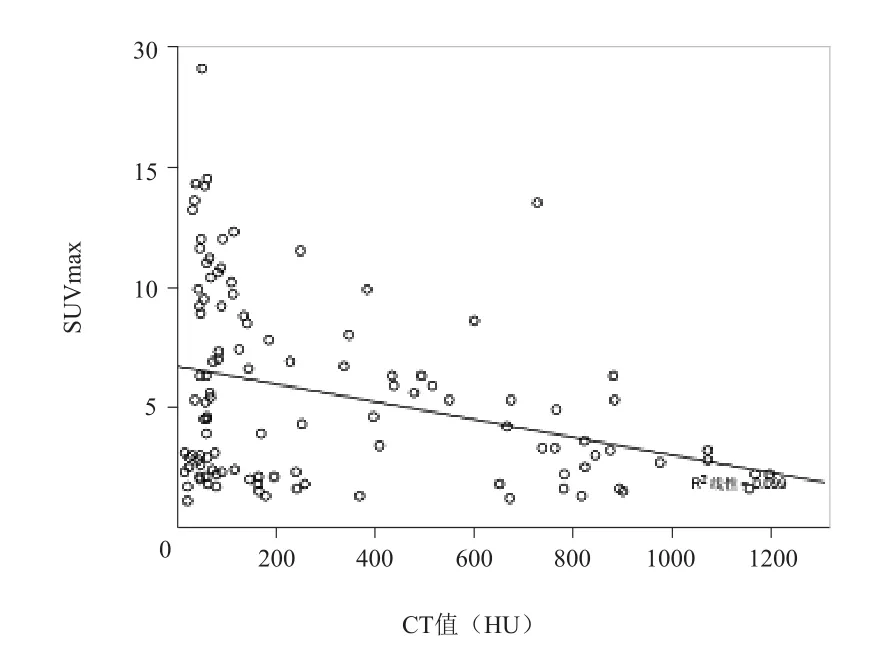
图8 骨肉瘤SUVmax与CT值的相关性
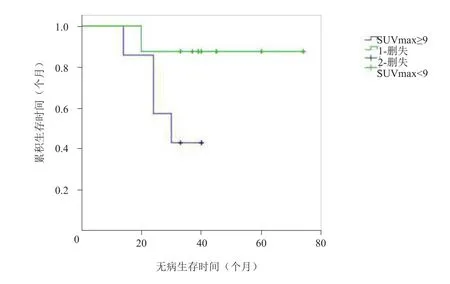
图9 Kaplan-Meier生存曲线分析
2.3 随访结果 30例患者随访至2014年2月,其中2例患者术后发现肺转移,2例出现局部复发,6例死亡,20例无瘤生存,无瘤生存时间为14~74个月,平均(36.9±14.9)个月。
2.4 SUVmax、肿瘤体积与预后的关系 Cox回归分析结果显示,30例骨肉瘤患者原发病灶的SUVmax范围为2.7~21.6,平均8.7±5.1,作为连续性变量进入Cox回归模型,SUVmax是影响预后的独立危险因子,病灶SUVmax越高,预后越差(Wald=4.213,P<0.05);病灶体积范围为1.4~642.5 cm3,平均(220.8±22.0)cm3,非影响预后的独立因素(Wald=0.759,P>0.05)。见表3。
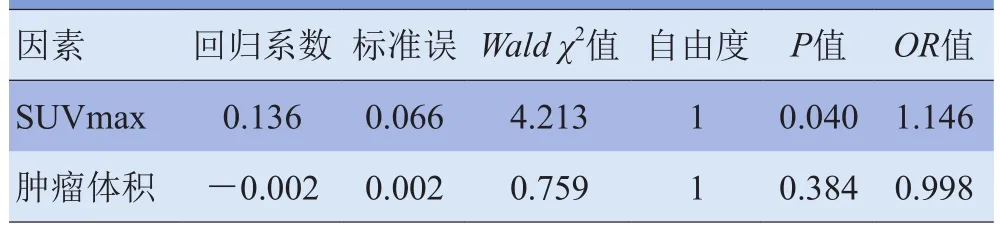
表3 肿瘤病灶SUVmax及体积与患者预后的Cox回归分析
Kaplan-Meier曲线分析显示,对SUVmax界值为5~10的患者进行无病生存时间分析,结果显示SUVmax界值为8、9、10者无病生存时间差异有统计学意义,但以SUVmax界值为9者χ2值最大(χ2=0.696,P<0.05),故选择9为SUVmax界值。SUVmax≥9的14例患者平均无病生存时间为(30.3±15.0)个月(95% CI 25.3~35.2),SUVmax<9的16例患者平均无病生存时间为(67.3±14.0)个月(95% CI 48.0~65.6),两者差异有统计学意义(χ2=0.696,P<0.05),见图9。
3 讨论
绝大多数恶性肿瘤细胞具有高代谢特点,尤其是恶性肿瘤细胞的分裂增殖比正常细胞快,能量消耗相应地增加,葡萄糖为组织细胞能量的主要来源之一,恶性肿瘤细胞的异常增殖需要葡萄糖的过度利用,因此,肿瘤细胞内可积聚大量18F-FDG,经PET显像可显示肿瘤的部位、形态、大小、数量及肿瘤内的放射性分布,对于鉴别骨和软组织肿瘤的良恶性、病变定位、评价恶性程度、确定活检部位、评估治疗效果和判断预后等方面可以提供重要信息[1,6]。18F-FDG PET/CT结合了CT和代谢显像,不仅可以反映骨肉瘤的病理分级及侵袭性,而且弥补了单纯PET分辨率低、定位差的不足,可以清晰地显示骨肉瘤的骨质破坏、肿瘤骨、骨膜反应或骨膜三角及软组织肿块等征象[7],为肿瘤的定性提供了重要的影像学征象。
3.1 骨肉瘤18F-FDG PET/CT影像特征 本研究分析了原发性骨肉瘤不同肿瘤组织的CT表现及代谢特征。CT所示骨质破坏区PET表现为葡萄糖代谢明显增高,其中可见部分放射性分布稀疏区,考虑为肿瘤出血坏死区域或肿瘤低活性区,CT平扫出血坏死区域与周围骨质破坏区较难鉴别,增强扫描无强化,PET代谢影像表现为葡萄糖代谢减低区。肿瘤骨是成骨肉瘤的组织学特征,也是最重要的X线及CT表现。CT可表现为毛玻璃样、棉絮状、象牙质、放射状、颗粒状等。本研究根据CT所示瘤骨密度不同将其分为两组,即密度等于或高于正常骨皮质密度的肿瘤骨和密度低于正常骨皮质密度的肿瘤骨,象牙质成骨和部分呈颗粒状高密度成骨归于前者,毛玻璃样、棉絮状成骨归于后者。两组瘤骨在PET影像表现差别比较明显,前者表现为放射性低于周围肿瘤组织,呈相对放射性分布稀疏区,后者则表现为明显放射性分布增高。病理学方面,毛玻璃样密度增高区是生长较活跃、分化最差的肿瘤骨;棉絮状瘤骨密度均匀而边缘模糊是分化较差的肿瘤骨;象牙质瘤骨密度最高,边界清楚,生长缓慢,是分化较好的瘤骨。肿瘤骨的PET表现与病理恶性程度有很好的一致性[8]。软组织肿块常偏于病骨一侧或围绕病骨生长,CT表现为边缘模糊,与正常的肌肉、神经和血管分界不清,当肿块坏死、囊变时密度不均匀。增强扫描肿块呈不均匀强化,坏死囊变区不强化,有时可见粗大的肿瘤血管[2];PET影像表现为放射性明显增高,既往研究[9]认为软组织肿块是骨肉瘤不同组织成分中代谢最高的。软组织肿胀则表现为放射性摄取减低,因此PET影像骨肉瘤软组织肿块代谢活性范围显示清晰。
3.2 骨肉瘤SUVmax与代谢活性 良性骨肿瘤及恶性骨肿瘤摄取18F-FDG的程度有显著差异,恶性骨肿瘤SUV>2.0~2.5[10],但目前尚无可靠的SUV界值来鉴别原发骨肿瘤的良恶性。本研究中,骨肉瘤不同肿瘤组织SUVmax量化了PET代谢影像的表现特征,象牙质瘤骨(密度极高的瘤骨,为无结构的团块状致密硬化区,肿瘤细胞分化较好)SUVmax明显低于其他肿瘤组织,即其代谢活性和恶性程度低于骨质破坏区、软组织肿块和密度较低(磨玻璃样、棉絮样)的瘤骨。相关分析结果显示,CT值与SUVmax呈负相关,肿瘤骨越成熟、肿瘤细胞分化越好,CT密度越高,而18F-FDG摄取越低。因此,低密度/高代谢瘤骨常提示高度恶性[11]。但既往研究亦发现骨质破坏区及软组织肿块内存在SUVmax较低的区域,与放射性分布稀疏区相对应,考虑为肿瘤的出血或坏死区[12]。18F-FDG PET/CT代谢影像的半定量分析有助于找到复杂结构肿瘤中生物活性最高的部分,与CT解剖图像融合有助于确定活检部位,降低了低估肿瘤恶性程度及不当治疗的可能性[10]。
3.3 骨肉瘤SUVmax与预后的关系 骨肉瘤SUVmax与肿瘤的恶性程度及预后存在相关性,既往研究[13-14]显示骨肉瘤代谢活性越高,预后越差。Fuglø等[13]研究显示骨肉瘤SUVmax≤10的患者5年生存率为81%,而SUVmax>10的患者5年生存率为33%。Franzius等[14]利用PET显像参数肿瘤/非肿瘤放射性计数比(tumorto-nontumor ratios,T/NT)研究了骨肉瘤代谢活性与预后的关系,认为T/NT小于中位数的患者无病生存时间明显长于T/NT大于中位数者。本研究结果与以上研究结果相近,显示骨肉瘤的代谢活性,即SUVmax是影响预后的独立因素,本研究对SUVmax界值5~10进行分析,发现SUVmax界值为8、9、10差异均有统计学意义,SUVmax界值为9差异有显著统计学意义,考虑SUVmax与预后呈渐进的相关性,无绝对的阈值,即SUVmax越大,预后越差。作为半定量分析指标,SUVmax与T/NT均能反映肿瘤的代谢活性,SUVmax较T/NT受主观因素影响小,更客观、真实地反映组织葡萄糖代谢水平。而骨肉瘤的体积与预后无明显相关性。既往研究[15-16]显示骨肉瘤预后与肿瘤大小无关。
总之,18F-FDG PET/CT实现了对原发性骨肉瘤解剖结构改变和代谢变化的优势互补,半定量分析SUVmax量化了骨肉瘤PET代谢影像特征,可以反映不同组织成分的代谢活性及恶性程度,有助于找到复杂结构肿瘤中生物活性最高的部分,低密度/高代谢瘤骨提示高度恶性,可以指导骨肉瘤组织活检。骨肉瘤原发病灶的SUVmax越高,预后越差。
[1] Aoki J, Endo K, Watanabe H, et al. FDG-PET for evaluating musculoskeletal tumors: a review. J Orthop Sci, 2003, 8(3): 435-441.
[2] Kundu ZS. Classification, imaging, biopsy and staging of osteosarcoma. Indian J Orthop, 2014, 48(3): 238-246.
[3] 赵芬, 张秀丽, 孙晓蓉, 等. 原发灶18F-FDG PET/CT肿瘤代谢体积与晚期非小细胞肺癌患者预后的相关性研究. 中国医学影像学杂志, 2011, 19(4): 252-256.
[4] 王玉婷, 黄钢, 蒋瑾, 等.18F-FDG PET用于肿瘤治疗疗效评价的meta分析进展. 国际放射医学核医学杂志, 2012, 36(6): 334-338.
[5] Shin KH, Moon SH, Suh JS, et al. Tumor volume change as a predictor of chemotherapeutic response in osteosarcoma. Clin Orthop Relat Res, 2000, (376): 200-208.
[6] Peterson JJ. F-18FDG-PET for detection of osseous metastatic disease and staging, restaging, and monitoring response to therapy of musculoskeletal tumors. Semin Musculoskelet Radiol, 2007, 11(3): 246-260.
[7] Kumar R, Halanaik D, Malhotra A. Clinical applications of positron emission tomography-computed tomography in oncology. Indian J Cancer, 2010, 47(2): 100-119.
[8] Kneisl JS, Patt JC, Johnson JC, et al. Is PET useful in detecting occult nonpulmonary metastases in pediatric bone sarcomas? Clin Orthop Relat Res, 2006, 450: 101-104.
[9] Brenner W, Bohuslavizki KH, Eary JF. PET imaging of osteosarcoma. J Nucl Med, 2003, 44(6): 930-942.
[10] Franzius C, Sciuk J, Brinkschmidt C, et al. Evaluation of chemotherapy response in primary bone tumors with F-18 FDG positron emission tomography compared with histologically assessed tumor necrosis. Clin Nucl Med, 2000, 25(11): 874-881.
[11] Charest M, Hickeson M, Lisbona R, et al. FDG PET/CT imaging in primary osseous and soft tissue sarcomas:a retrospective review of 212 cases. Eur J Nucl Med Mol Imaging, 2009, 36(12): 1944-1951.
[12] Costelloe CM, Chuang HH, Madewell JE, et al. FDG PET/ CT of primary bone tumors. Am J Roentgenol, 2014, 202(6): W521-W531.
[13] Fuglø HM, Jørgensen SM, Loft A, et al. The diagnostic and prognostic value of 18F-FDG PET/CT in the initial assessment of high-grade bone and soft tissue sarcoma. A retrospectivestudy of 89 patients. Eur J Nucl Med Mol Imaging, 2012, 39(9): 1416-1424.
[14] Franzius C, Bielack S, Flege S, et al. Prognostic significance of F-18-FDG and Tc-99m-methylene diphosphonate uptake in primary osteosarcoma. J Nucl Med, 2002, 43(8): 1012-1017.
[15] 祁伟祥, 何爱娜, 汤丽娜, 等. 儿童骨肉瘤与青年骨肉瘤临床特点比较及预后影响因素分析. 中国肿瘤临床, 2011, 38(21): 1330-1334.
[16] 张蕾, 杨振燕, 汤如勇, 等. 骨肉瘤MRI与p53表达及其存活期的相关研究. 中国医学影像技术, 2003, 19(10): 1333-1335.
(本文编辑 张春辉)
Imaging Characteristics and Prognostic Value of18F-FDG PET/CT in Primary Osteosarcoma
Purpose To discuss the imaging characteristics and prognostic value of18F-FDG PET/CT in primary osteosarcoma. Materials and Methods Thirty patients with osteosarcoma confirmed by pathology were enrolled in the study. The imaging characteristics of preoperative whole body18F-FDG PET/CT were analyzed retrospectively. The max standard uptake values (SUVmax) and CT values of lesions were obtained, and tumor volume was calculated; disease-free survival duration was calculated according to the reoccurrence and metastasis of tumor and death; the SUVmax of different components was compared, and the SUVmax in each position was analyzed in terms of the correlation with the corresponding CT value and factors influencing the prognosis. Results CT images showed that 28 patients with primary osteosarcoma had bone destruction, 20 had ground-glass or cotton-like neoplastic bone, 24 with soft tissue mass and 16 with periosteal reaction had increased18F-FDG uptake, and 17 with high-density neopalstic bone had low18F-FDG uptake. The SUVmax of high-density neoplastic bone was significantly lower than that of bone destruction, low-density neoplastic bone and soft tissue mass (F=5.196, P<0.01). There was a weak negative correlation between the SUVmax of various parts such as bone destruction, low-density neoplastic bone, high-density neoplastic bone and soft tissue mass and the corresponding CT value (r=-0.315, P<0.01). The disease free survival time was (36.9±14.9) months. The Kaplan-Meier curve analysis showed that the disease free survival time was longer in patients with SUVmax≥9 than in those with SUVmax<9 (χ2=0.696, P<0.05). The Cox regression analysis presented that SUVmax had independent prognostic value (Wald=4.213, P<0.05). Conclusion18F-FDG PET/CT has advantages in presenting the anatomical structure changes and metabolic changes in primary osteosarcoma. Combined with semi-quantitative analysis of SUVmax, PET/CT can be helpful in finding out the highest biological activity part from the complex tumor structures. Neoplastic bone with low density/high metabolism suggests high malignancy. The higher the SUVmax, the worse the prognosis is in patients with primary osteosarcoma.
Osteosarcoma; Positron-emission tomography; Tomography, X-ray computed; Fluorodeoxyglucose F18; Prognosis
10.3969/j.issn.1005-5185.2015.05.014
杨 芳
Department of Nuclear Medicine, Beijing Jishuitan Hospital, Beijing 100035, China
Address Correspondence to: YANG Fang
E-mail: yf_hyx@sina.com
2014-10-15
2015-01-16
中国医学影像学杂志
2015年 第23卷 第5期:377-382,387
Chinese Journal of Medical Imaging 2015 Volume 23(5): 377-382, 387
