PP333对非洲菊试管丛生芽离体低温保存的影响
2015-12-19王晓红谭晓风胡芳名
王晓红,谭晓风,胡芳名,杨 伟
(中南林业科技大学,湖南 长沙 410004)
PP333对非洲菊试管丛生芽离体低温保存的影响
王晓红,谭晓风,胡芳名,杨 伟
(中南林业科技大学,湖南 长沙 410004)
为了延长非洲菊离体低温保存周期,以非洲菊Gerbera jamesoniiBolus的试管丛生芽为材料,研究生长延缓剂PP333的质量浓度和保存时间对非洲菊离体低温保存的影响。结果表明:低温结合PP333的使用对非洲菊丛生芽的生长有显著影响,PP333质量浓度与丛生芽高度、增殖系数、黄化率呈显著的负相关,与褐化率呈显著的正相关。离体保存时间延长,黄化率显著提高,以低温保存6个月后取出复壮1次为宜。在MS+6-BA 0.5mg/L的培养基中添加1.0mg/L的PP333,在低温12 ℃离体保存效果最佳。
非洲菊;生长延缓剂PP333;组织培养;离体低温保存
非洲菊Gerbera jamesoniiBolus别名扶郎花,菊科扶郎花属多年生宿根草本花卉,原产南非。其花朵硕大,花色丰富艳丽,花枝粗壮挺拔,切花保鲜期长,具有很高的观赏价值,是世界十大切花之一[1]。在温室条件下周年开花,既可作盆栽观赏又可作切花生产,经济价值可观,商业价值高,是目前国际花卉市场上常见的花卉。切花非洲菊已具有很大的市场[2],盆花非洲菊也将具有很大的发展潜力[3]。
非洲菊在长期高频率的继代过程中,产生大量变异,不利于保持品种的优良性状。而且非洲菊的试管苗生长快,在常温下保存则每个月就需继代1次,繁琐耗时,浪费人力物力。为了探索一条既可延长继代时间又能保持品种优良特性的种质保存途径,本试验中通过在培养基中加入适量的生长延缓剂PP333,在低温下进行非洲菊试管苗的种质保存,研究PP333的质量浓度和保存时间对非洲菊离体低温保存的影响。
1 材料与方法
1.1 材 料
以非洲菊‘Festival’品种的离体快速繁殖的丛生芽为植物材料。
1.2 方 法
1.2.1 离体保存条件与方法
取健壮均匀的丛生芽切单芽后接种在含有培养基的无菌瓶中。培养基为MS+0.5mg/L 6-BA+PP333,PP333设5个水平,分别是0、0.5、1.0、2.0、5.0mg/L。在恒温光照箱内进行离体培养和保存,设置低温12 ℃,光强300 lx,光周期12 h。低温保存时间设3个水平,分别为3个月、6个月、9个月。每个组合接种30瓶,重复3次。
1.2.2 离体保存植株生长与指标测定
离体培养的第3、6、9个月后分别统计增殖系数、丛生芽高度、叶片黄化率、褐化率4个指标,测定保存6个月后的丛生芽叶绿素含量。叶绿素含量的测定采用分光光度法。先称取叶片鲜质量0.2 g,每样品各3份,剪碎后,放入10 mL离心管中,加5 mL丙酮和无水酒精(2∶1)的混合液,暗反应2 h,取上清液,沉淀物中再加入5 mL,暗反应2 h,之后合并上清液,定容至10 mL。然后,取样品吸入光径为1cm的比色杯内,提取液为空白对照,设定检测波长为663、645 nm,测定吸光度。最后按照以下公式计算,求得不同提取液中叶绿素a(Ca)、叶绿素b(Cb)和总叶绿素(CT)的质量浓度。再按照“叶绿体色素的含量=色素浓度×提取液体积×稀释倍数÷样品鲜质量”来计算组织单位质量中各色素的含量。
Ca(mg/L)= 12.7×OD663- 2.69×OD645;
Cb(mg/L)= 22.9×OD645- 4.86×OD663;
CT(mg/L)= 12.7×OD663- 2.69×OD645;
叶 绿 素 A 的 含 量(mg/g) =Ca×10×(1/1000)÷0.2 =Ca×0.05;
叶 绿 素 B 的 含 量(mg/g) =Cb×10×(1/1000)÷0.2 =Cb×0.05;
总叶绿素含量(mg/g)=Ca+Cb。
2 结果与分析
2.1 PP333质量浓度及保存时间对非洲菊丛生芽生长的影响
分别将经过3个月、6个月、9个月离体低温保存的非洲菊丛生芽取出,统计相关指标。结果表明,生长延缓剂PP333和保存时间对非洲菊丛生芽的生长影响较大,分别表现在丛生芽的增殖、植株高度、叶片黄化和植株褐化方面,对叶片中的叶绿素含量也有明显影响。
首先,PP333对低温下的非洲菊丛生芽的分化和增殖具有明显的抑制作用。随着PP333质量浓度增高,增殖系数明显下降(见图1)。同时,随着离体低温保存时间的延长,增殖系数不再升高,即第6个月和第9个月与第3个月相比,增殖系数不再增加,说明保存后期芽的增殖和分化已停止。
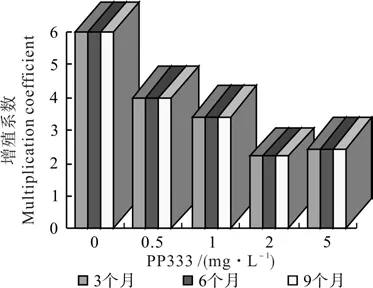
图1 PP333质量浓度及离体低温保存时间对非洲菊芽增殖系数的影响Fig. 1 Effects of PP333 mass concentration and low temperature preservation time in vitro on multiplication coef fi cient of buds in G. jamesonii
其次,PP333缩短节间伸长、矮化非洲菊芽丛的作用显著(见图2)。在低温下不添加PP333的对照组中,芽的平均高度在3.36~4.02cm之间,而且随着保存时间的延长,对照组的芽在低温下还在增高,但随着PP333质量浓度增高,芽体平均高度开始下降(见图3)。随着培养时间的延长,这种抑制芽伸长的作用变得不再显著。经5mg/L的PP333处理后,非洲菊的丛生芽高度比接种时芽体矮很多,经3个月后新产生的芽高0.61cm,第6、9个月后,芽体高度平均值为0.6cm。分析其中还有一个原因,在统计高度时,是以活的芽体高度作为基数,但由于有褐化死亡的材料,因此统计高度上会有少量误差。
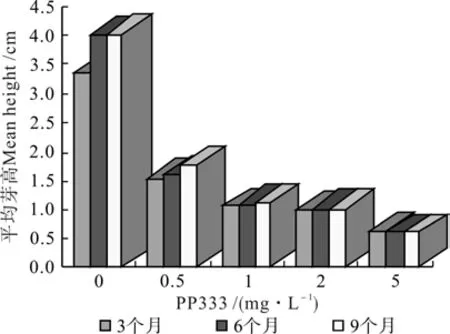
图2 PP333质量浓度及离体低温保存时间对非洲菊增殖芽高的影响Fig. 2 Effects of PP333 mass concentration and low temperature preservation time in vitro on height of multiplication buds in G. jamesonii

图3 不同质量浓度的PP333对非洲菊增殖芽低温保存的影响Fig. 3 Effect of different mass concentrations of PP333 on low temperature preservation of multiplication buds in G. jamesonii
植物在低光照度的环境中,叶片会发黄,表现出光合速率低的症状。试验中低温保存的光照强度为300 lx,光强弱,因此出现大量黄化苗,叶色浅绿或黄,叶薄,而且随着时间延长,这种现象愈加显著。对照组中,从第3、6、9个月后,统计的黄化率分别为5.2%、16.7%、68.4%,说明低温保存时间对对照组的黄化率的影响具有极显著的差异。随着PP333质量浓度增加,非洲菊芽的黄化率总体呈现降低趋势(见图4)。叶色变得深绿,叶色变得肥厚。随着离体培养时间延长,黄化率也逐渐增高。在9个月的统计结果中发现,添加有PP333的组合中虽然黄化率比对照组低,但是与同质量浓度的6个月的黄化率相比,差异很大,黄化率都迅速增加。这可能与营养成分已被消耗尽和PP333的有效作用时间相关。因此作为离体保存,为减少黄化苗的发生,应该在6个月低温保存后取出复壮1次。
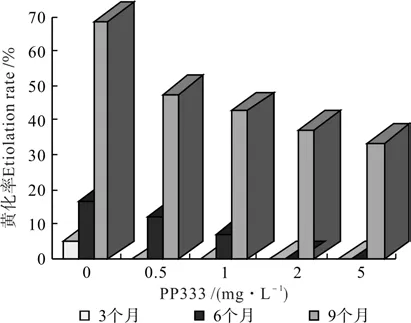
图4 PP333质量浓度及离体低温保存时间对非洲菊增殖芽黄化率的影响Fig. 4 Effects of PP333 mass concentration and low temperature preservation time in vitro on etiolation rate of multiplication buds in G. jamesonii
在非洲菊离体低温保存中,除了叶片黄化现象外,叶片和植株褐化现象也存在。褐化的原因很多,本试验中褐化的产生是因为PP333对植株生长的胁迫作用而导致组织死亡。从图5中可以看出,褐化率的变化随PP333质量浓度的增加而在升高,在同一处理质量浓度下也随着低温保存时间的延长而增加。在对照组中,一直没有出现褐化现象,而在PP333质量浓度高达5mg/L时,9个月后的褐化率高达33.3%。

图5 PP333质量浓度和离体低温保存时间对非洲菊增殖芽褐化率的影响Fig. 5 Effects of PP333 mass concentration and low temperature preservation time in vitro on browning rate of multiplication buds in G. jamesonii
2.2 PP333质量浓度对非洲菊叶绿素含量的影响
叶绿素含量是植物生长状态的一个反映,当植物受到逆境胁迫时,各种生理过程都会受到影响,如遇低温植物的光合酶活性和光合电子传递速率下降,从而削弱植物利用光能的能力,引起光抑制现象[4]。此时植物叶绿素的含量和组成发生改变,植物的光合速率下降[5-6]。本试验中取离体低温保存6个月经不同PP333质量浓度培养的丛生芽,测定幼叶的叶绿素a(Ca),叶绿素b(Cb)和总叶绿素含量(CT),统计结果见表1。从表1中可以看出,随着PP333质量浓度的升高,叶绿素a、叶绿素b和总叶绿素含量均成比例地升高,PP333质量浓度为1.0mg/L时,总叶绿素含量相对最高(0.571mg/g),光合速率最强。随着质量浓度的进一步升高,叶绿素含量开始缓慢下降,说明PP333高于1.0mg/L对非洲菊离体保存苗来说开始受抑制,光合速率也开始下降。
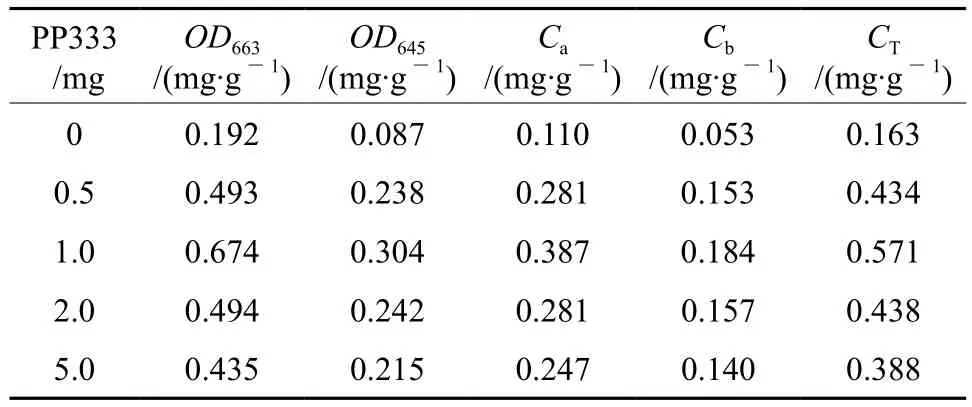
表1 PP333质量浓度对非洲菊叶片叶绿素含量的影响Table 1 Effects of PP333 mass concentrations on chlorophyll contents in G. jamesonii leaves
3 结论与讨论
(1)非洲菊丛生芽在MS+6-BA 0.5mg/L的培养基中添加1.0mg/L PP333,低温12 ℃离体保存效果最佳,6个月后复壮1次。通过低温和一定浓度的生长抑制剂PP333的共同作用,不仅能获得健壮的试管苗,而且能使保存时间延长至6个月之久。
(2)离体低温保存是在低温下通过改变培养基成分和光照条件保存缓慢生长离体培养物的方式。缓慢生长离体保存成功的重要机制之一是增加了叶肉细胞的紧密度,提高了试管苗的抗氧化能力[7]。植物离体低温保存可以收集和保存种质资源,减少多次继代带来的种质变异,同时节约空间,节约人力物力。种质资源低温保存泛指超低温保存(-80 ℃以下)和低温保存(4 ℃以下),而对植物而言,低温常常是指那些比常温稍低一些的温度。离体低温保存技术在许多园艺植物中得到了应用[8-9],如桉树的花粉在低温(-20 ℃)和超低温(-80 ℃)冷冻真空条件下储藏1 a,花粉活力依然能保持50%以上[10]。试验通过低温结合生长延缓剂和减少光照3个方面来共同抑制生长和控制芽体高度,使芽体更加健壮。这种保存方法叫缓慢生长保存(slow growth conservation),适合于植物中短期保存。影响离体低温保存的因素还有很多,就缓慢生长保存而言,还有增加蔗糖、甘露醇等高渗物质抑制培养材料的生长,延缓细胞生长,或采用适当的封口膜等措施[11],另外保存材料的生长状态及基因型等也会影响低温保存的质量。今后可以考虑在影响非洲菊离体低温保存的因素上进行优化设计,同时通过细胞学和分子手段来检测低温保存材料的遗传和变异。
(3)非洲菊为热带花卉,15 ℃以下生长不良,在10 ℃以下则停止生长,5 ℃以下低温则受害严重,因此,试验中选择12 ℃作为非洲菊低温保存温度。为避免非洲菊幼苗在短时间内受低温伤害,接种后对处理材料进行了低温炼苗,实施逐级降温法,提高幼苗的抗冻能力。先后在18、15 ℃中炼苗一段时间后,最后才在12 ℃恒温光控培养箱中保存培养。离体保存条件下,植株存活率高,生长相对缓慢,保存时间较长,则适合该物种离体保存[7]。本试验中经低温保存后的材料受到不同程度的伤害,主要表现在老叶变褐色,叶片水渍状受害。过度低温会破坏叶绿素结构[12],叶绿素活性受到抑制,甚至叶绿素本身开始降解,叶绿素总含量降低,这是低温逆境下光合机能的破坏导致植物死亡的原因之一。在9个月后受伤材料已过半,而将低温保存6个月的材料在常温弱光下培养1周后,再继代入新鲜培养基中,在正常光照下培养,经形态学观察发现,幼苗生长正常。
[1]Parthasarathy VAV Nagaraju.In vitropropagation inGerbera jamesoniiBolus[J]. Indian Journal of Horticulture, 1999,56: 82 - 85.
[2]Broek Van Den L, Haydu JJ, Hodges AW,et al. Production,marketing and distribution of cut flowers in the United States and Brazil[C]//Annual Report of Florida Agricultural Experiment Station. University of Florida, 2004:1 - 19.
[3]王晓红.荷兰盆栽非洲菊欲征服美国市场[J].中国花卉园艺,2014, (2):58 - 59.
[4]卢广超,许建新,薛 立,等.低温胁迫对4种幼苗的叶绿素荧光特征的影响[J].中南林业科技大学学报,2014,34(2):44-49.
[5]杨柳青,张 柳,廖飞勇,等.低温胁迫对南美天胡荽光合作用和叶绿素荧光的影响[J].经济林研究,2014,32(4):99-102.
[6]孙晓方,何家庆,黄训端,等.不同光强对加拿大一枝黄花生长和叶绿素荧光的影响[J].西北植物学报,2008,28(4):752-758.
[7]潘学军,李 霞,张文娥.离体保存对野生毛葡萄试管苗生长及叶片抗氧化酶活性的影响[J].果树学报,2013,30(4):615-620.
[8]Besseanhinder J J E, Staritsky G, Zandvoort E A. Loytennin vitrostorage ofColornsia esculentaunder minimal growth [J].Plant Cell, Tissue and Organ Culture, 1993, 33(2):121 - 127.
[9]赵艳华,吴雅琴,程和禾,等.李离体茎尖的超低温保存[J].园艺学报,2008,35(3):426-426.
[10]刘丽婷,武海霞,莫晓勇,等.不同处理和储藏条件下桉树花粉活力变化研究[J].中南林业科技大学学报, 2011, 31(8): 56-60.
[11]王海平,李锡香,沈 镝,等.离体保存技术在无性繁殖蔬菜种质资源保存中的应用[J].植物遗传资源学报, 2010, 11(1):52-56.
[12]刘 芬,姜清彬,马英姿.7个短枝木麻黄种源耐寒评价及综合分析[J].中南林业科技大学学报,2015,35(6):40-44.
Effects of PP333 on low-temperature preservation ofGerbera jamesoniiBolusin vitro
WANG Xiao-hong, TAN Xiao-feng, HU Fang-ming, YANG Wei
(Central South University of Forestry & Technology, Changsha 410004, Hunan, China)
In order to extend the low temperature preservation period ofGerbera jamesoniiBolusin vitro, using clump budsin vitroas materials, the effects of growth retardant PP333 on mass concentration and preservation time on low temperature conservationin vitrowere researched. The results showed that PP333 had a signi fi cant in fl uence on bud growth combined with low temperature. Evidently, PP333 mass concentration was negatively correlated with shoot height, multiplication coefficient, and etiolation rate, but positively correlated with browning rate. With extending preservation timein vitro, etiolation rate was increased signi fi cantly, thus to rejuvenate after low-temperature preservation for six months was suitable. It was best to conserve clump buds in MS media with BA 0.5mg/L and PP333 1.0mg/L at 12 ℃.
Gerbera jamesoniiBolus; growth retardant PP333; tissue culture; low-temperature preservationin vitro
S682.1
A
1003—8981(2015)04—0086—04
10.14067/j.cnki.1003-8981.2015.04.015
2015-05-05
湖南省科技厅自然科学基金项目(09JJ4013);中南林业科技大学青年科学基金项目(2009052B)。
王晓红,副教授,博士,硕士研究生导师。E-mail:wxhznl@126.com
王晓红,谭晓风,胡芳名,等.非洲菊离体低温保存研究[J].经济林研究,2015,33(4):86-89.
[本文编校:闻 丽]
