水霉菌感染鲤诱导氧化应激发生的研究
2015-12-18黄建汤茜姚卓凤张俊梅顾泽茂袁军法
黄建 汤茜 姚卓凤 张俊梅 顾泽茂 袁军法


摘要:以感染水霉病的鲤(Cyprinus carpio)为研究对象,测定了患病鲤血浆中氧化应激相关指标,包括总抗氧化能力(T-AOC)、脂质过氧化产物-丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT),同时随机取患病组鲤的肝胰脏、脾脏和肾脏组织进行组织病理分析,旨在探讨氧化应激同水霉菌致病机理的关联。结果表明,①患病组相对于对照组,鱼体血浆T-AOC极显著降低(P<0.01);MDA含量和GSH含量无显著变化;SOD和CAT活性极显著降低(P<0.01);GPx活性显著升高(P<0.05),表明鲤患水霉病后鱼体内氧化水平-抗氧化水平失衡,鱼体产生氧化应激。②组织病理学分析显示患水霉病鲤的肝脏细胞相对于对照组出现严重的急性坏死症状,细胞出现空泡化现象严重;脾脏和肾脏细胞出现不同程度的炎症,细胞开始凋亡。
关键词:水霉病;鲤(Cyprinus carpio);氧化应激;组织病理
中图分类号:S965.116;S941.43+1 文献标识码:A 文章编号:0439-8114(2015)22-5677-05
Abstract:In this study, plasma from diseased or healthy common carps (Cyprinus carpio) was collected to evaluate the effect of infection with Saprolegniasis on oxidative stress. Several bio-chemical markers of oxidative stress, including the total antioxidant capacity (T-AOC),lipid peroxidation- malondialdehyde (MDA),superoxide dismutase (SOD), glutathione (GSH),glutathione peroxidase (GPx),and catalase (CAT) were measured among controls and infected common carps. Compared with the healthy common carps,some biomarkers of the common carps infected with Saprolegniasis, including T-AOC,SOD and CAT,were decreased significantly (P<0.01),and the plasma GPx was increased significantly (P<0.05). Other biomarkers of plasma MDA and GSH showed no significant change after the infection with Saprolegniasis. These results indicated that oxidative stress has occurred upon Saprolegniasis infection. The histopathology damage of liver, spleen, and kidney tissues from diseased fish were also observed after hematoxylin and eosin (HE) staining. Liver cells of common carps infected with Saprolegniasis was presented with the symptom of acute necrosis, and became vacuolization seriously;spleen and kidney cells was presented with inflammations of different severity,senescence and apoptosis.
Key words:Saprolegniasis;common carp(Cyprinus carpio);oxidative stress;histopathology
水霉病(Saprolegniasis)由寄生于水生鱼类体表及卵上的真菌引起,现已成为水产养殖业的主要疾病之一,对水产养殖业造成巨大的经济损失[1]。常见的种类主要是卵菌纲(Oomycetes)水霉目(Saprolegniales)水霉科(Saprolegniaceae)的一些成员,包括水霉属(Saprolegnia)、绵霉属(Achlya)、丝囊菌属(Aphanomyces)[2,3]。患病水生鱼类食欲减退、行动呆滞;头部、吻端、尾部、躯干或鳍条,甚至鳃部有水霉菌寄生,并黏附污泥和藻类,其状如覆盖棉絮,故俗称“白毛病”。在鱼卵孵化过程中,该病也经常发生,内菌丝侵入卵膜内,丛生大量外菌丝,为“卵丝病”。被寄生的鱼卵,内外菌丝呈放射状,有“太阳子”之称[4]。在生产中一直以孔雀石绿治疗该病,疗效较好,但孔雀石绿具有高毒性、高残留、高致癌和致畸性。2002年中华人民共和国农业部发布的193号公告以及NY5072-2002标准《无公害食品渔用药物使用准则》中明確规定在渔业领域禁用孔雀石绿,但目前还缺乏安全有效的替代药物[5]。
水霉菌温度适应范围广,分布范围大,无宿主特异性[6]。当鱼类体表受伤或者免疫力降低、水温骤变等时,水霉菌寄生在伤口处,通过伤口吸收营养,将菌丝侵入到肌肉、真皮等组织,造成组织坏死,从而诱发水霉病[7]。研究表明,感染水霉菌后可上调促炎相关因子的表达[8];也有研究表明,水霉菌感染大西洋鲑后可抑制先天性免疫相关基因的表达,从而使鱼体产生严重的炎症[9]。
氧化应激是微生物感染导致的组织损伤的病理机制之一[10,11],氧化应激和炎症在维持机体稳态的免疫反应过程中密切相关[12]。氧化应激参与了肥胖、癌症、衰老和肿瘤等病理过程[13,14],阻断氧化应激的发生,成为对抗微生物感染和减少组织损伤的新思路[15,16]。氧化应激是指当机体遭受有害刺激时,体内活性氧自由基和活性氮自由基产生过多,氧化程度超过抗氧化物质的清除能力,导致机体内氧化抗氧化水平失衡[17]。关于鱼类感染微生物诱导氧化应激发生的报道很少,仅见石斑鱼神经坏死病毒(Grouper nervous necrosis virus,RGNNV)和草鱼呼肠孤病毒(Grass carp reovirus,GCRV)感染诱发氧化应激反应的报道[18,19]。鲤春病毒血症病毒(Spring viremia of carp virus,SVCV)感染可诱导氧化应激[20,21]。为此,本研究通过测定感染水霉菌的鲤血浆中氧化应激相关指标,并结合患病鱼的组织病理学分析,初步探讨了鲤水霉病诱发氧化应激及其介导的病理变化,为水霉病的防治提供新思路。
1 材料与方法
1.1 材料
1.1.1 试验鱼类 健康鲤和患水霉病鲤取自华中农业大学水产学院实验教学基地。
1.1.2 试验试剂 总抗氧化能力T-AOC检测试剂盒(碧云天S0116)、脂质过氧化产物-丙二醛MDA检测试剂盒(碧云天S0131)、超氧化物歧化酶SOD检测试剂盒(南京建成A001-1)、还原性谷胱甘肽GSH检测试剂盒(南京建成A006-1)、过氧化氢酶CAT检测试剂盒(南京建成A007-1)、谷胱甘肽过氧化物酶GPx检测试剂盒(南京建成A005),波恩试液购自武汉博洪生物科技有限公司,组织病理切片由武汉谷歌生物科技有限公司制作。
1.2 方法
1.2.1 患病鲤体表水霉菌丝的显微观察 用镊子轻轻刮取患病鲤体表水霉菌丝置于培养皿中,用70%乙醇漂洗3 s,用无菌水冲洗2次,然后用微吸管吸取水霉菌丝置于载玻片上显微镜观察。
1.2.2 患水霉病鲤和健康鲤血浆氧化应激指标的测定 采集患病组和对照组鲤的全血(加肝素钠抗凝)4 ℃ 2 500 r/min,离心得到血浆,分别测定血浆总抗氧化能力(Total antioxidant capacity,T-AOC)、脂质过氧化产物-丙二醛(Malondialdehyde,MDA)含量、还原性谷胱甘肽(Glutathione,GSH)含量、超氧化物歧化酶(Superoxide dismutase,SOD)活性、过氧化氢酶(Catalase,CAT)活性和谷胱甘肽过氧化物酶(Glutathion peroxidase,GPx)活性。具体测定方法按照试剂盒说明书进行,结果以SPSS(17.0)进行Duncan法单因素ANONA分析。
1.2.3 患病鲤的组织病理学分析 随机取患病组和对照组的鲤各3尾,分别取其肝胰脏、肾脏和脾脏组织固定于波恩试液(饱和苦味酸∶甲醛∶冰醋酸=15∶5∶1,V/V/V)中,以常规法制作石蜡切片,并进行苏木精-伊红(HE)染色,显微镜下观察组织病理变化。
2 结果与分析
2.1 患病鲤体表水霉菌丝的形态观察
患病鲤体表水霉菌丝为透明管状结构,中间无横隔,分枝较少,菌丝细长(图1A)。其游动孢子囊多呈棒状,游动孢子发育成熟后从孢子囊顶端释放出来, 并迅速游离(图1B)。
2.2 患水霉病鲤和健康鲤血浆氧化应激指标的测定
测定鱼体的氧化及抗氧化系统两方面的指标来评估鲤遭受水霉菌感染后是否诱发氧化应激。患水霉病鲤与健康鲤相比,血浆总抗氧化能力T-AOC极显著降低(P<0.01),超氧化物歧化酶SOD和过氧化氢酶CAT活性极显著降低(P<0.01),谷胱甘肽过氧化物酶GPx活性显著升高(P<0.05),还原型谷胱甘肽GSH含量无显著变化,脂质过氧化产物-MDA含量无显著变化,鲤感染水霉菌后机体抗氧化水平极显著降低,氧化水平无显著变化(表1)。结果表明,鲤遭受水霉菌侵袭后机体的氧化-抗氧化系统失衡,遭受氧化应激胁迫,可能同其致病性相关。
2.3 组织病理学观察
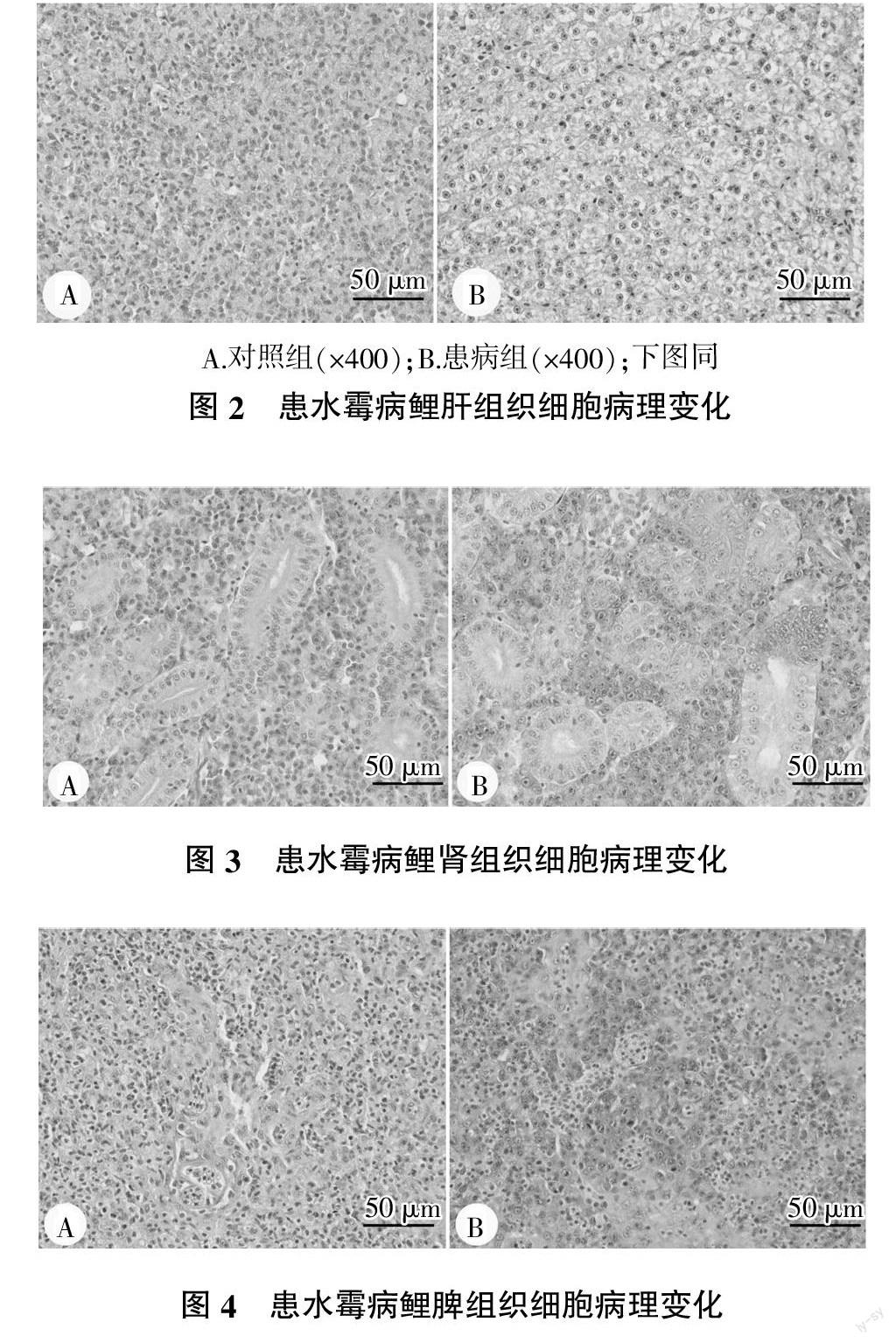
与对照组相比,患水霉病鲤肝脏组织细胞细胞质溶解,细胞界限模糊,出现严重的急性坏死症状,细胞空泡化现象严重(图2A、图2B);肾小球肿胀,间质细胞核变大,染色质凝集,细胞嗜碱性增强,肾小管上皮细胞的细胞核变大,部分肾小球结构丧失(图3A、图3B);脾脏组织细胞出现嗜中性粒细胞炎症,未成熟红细胞处于衰老状态,含铁血黄素逐渐形成(图4A、图4B),肾脏和脾脏组织出现不同程度的炎症和衰老症状,细胞开始凋亡。
3 小结与讨论
微生物感染能引起氧化应激的发生,如风疹病毒(Rubella virus,RV)[22]、人类免疫缺陷病毒(Human immunodeficiency virus,HIV)[23]以及白色念珠菌(Candida barbicans)[24]和炭黑曲霉菌(Aspergillus carbonarius)[25]等,这些研究都表明微生物感染机体后会产生大量ROS。机体的抗氧化应激信号通路会被激活,产生抗氧化物质,用于清除ROS,避免机体因过度氧化损伤导致的死亡。如细菌内毒素(Lipopolysaccharides,LPS)可以通过產生大量活性氧ROS,诱导转录激活因子ATF3(Activating transcription factor3,ATF3)的上调来抑制高迁移率族蛋白B1(High-mobility group protein B1,HMGB1)的表达以保护机体[26]。若机体内氧化-抗氧化系统的失衡,会导致ROS在胞内的积聚,产生氧化应激,最终造成脂质、蛋白质和DNA等生物大分子的损伤。氧化应激作为微生物感染的致病机理之一,参与了许多疾病的病理过程。
本试验测定了患病鲤的氧化应激相关指标,表明鲤在感染水霉菌后也诱发了氧化应激。衡量机体氧化应激状态有两方面,一方面是氧化水平,主要包括活性氧自由基(Reactive oxygen species, ROS)、活性氮自由基(Reactive nitrogen species, RNS)、总抗氧化能力(Total antioxidant capacity, T-AOC)、脂质过氧化产物-丙二醛(Malondialdehyde,MDA)、蛋白质氧化损伤产物-蛋白质羰基含量和DNA氧化损伤产物-8-OHdG等;二是抗氧化水平,主要包括抗氧化酶类-超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathion peroxidase,GPx)和过氧化氢酶(Catalase,CAT),非酶类抗氧化剂-还原性谷胱甘肽(Glutathione,GSH)、维生素E和维生素C等[27]。患水霉病鲤与健康鲤相比,血浆总抗氧化能力T-AOC极显著降低,超氧化物歧化酶SOD和过氧化氢酶CAT活性极显著降低,谷胱甘肽过氧化物酶GPx活性显著升高,还原型谷胱甘肽GSH含量无显著变化;脂质过氧化产物-MDA含量无显著变化。鲤感染水霉菌后遭受不同程度的氧化损伤,由于DNA和蛋白的氧化损伤,合成抗氧化酶类的机制受损[28],从而使超氧化物歧化酶SOD和过氧化氢酶CAT活性极显著降低,最终造成总抗氧化能力T-AOC极显著降低。抗氧化水平的降低,又进一步加重组织细胞损伤[29]。谷胱甘肽过氧化物酶GPx活性显著升高,可能是代偿性升高,由于氧化应激的产生激活核转录因子NRF2,从而导致下游抗氧化基因的表达,避免组织细胞遭受过度氧化损伤[30,31]。GPx能降解脂质过氧化物,防止细胞脂质过氧化损伤,在GPx作用下脂质过氧化产物转化为较为稳定的羟基化合物(ROH),阻断了脂质过氧化的自由基链式反应,从而导致脂质过氧化产物-丙二醛的含量没有显著性变化[32]。GPx在清除ROS和脂质过氧化的过程需要将大量的还原型谷胱甘肽氧化成氧化型谷胱甘肽GSSG,机体为了保证充足的底物供应,在谷胱甘肽还原酶的作用下,将GSSG还原成GSH,因而GSH含量无显著性变化[33]。水霉菌感染鲤后机体的氧化-抗氧化系统失衡,抗氧化水平极显著降低,不能有效清除机体内产生的ROS,机体产生了氧化应激[34]。
组织病理学分析表明,感染水霉菌的鲤呈现出明显的病理变化,其中肾脏和脾脏细胞出现不同程度的炎症和衰老症状,细胞开始凋亡。炎症反应能促进ROS的产生,同时激活相关炎性细胞,导致相关促炎因子的表达,并且ROS也能激活NF-κB,从而上调各种炎症介质和促炎因子的表达。ROS在机体内的蓄积诱导氧化应激的发生,造成机体严重的氧化损伤,又进一步加重了机体的炎症反应[12]。细胞凋亡在机体生长发育和衰老等许多生理和病理过程中有着重要作用,研究发现氧化应激能通过多种途径诱导细胞凋亡的发生[35]。组织病理变化分析表明水霉菌感染鲤机体后产生严重的炎症反应,可能是由于机体产生氧化应激激活了核转录因子-κB(Nuclear factor-κB,NF-κB),NF-κB调控机体炎症反应,能够上调各种炎症介质和相关促炎因子的表达,其中环氧合酶2(Cyclooxygenase -2,COX-2)的表达上调又可以合成前列腺素E2(Prostaglandin E2)来介导炎症病理过程[8,9,36,37]。患病鲤组织出现的细胞凋亡也与氧化应激密切相关,氧化应激产生的ROS的蓄积导致NF-κB的活化也能够诱导细胞凋亡[35]。NF-κB的活化能够促进相关促炎因子的表达,从而激活丝裂原活化蛋白激酶细胞凋亡信号通路[38],诱导细胞凋亡的发生。氧化应激指标测定结果表明,感染水霉菌的鲤机体抗氧化水平极显著降低,不能有效清除机体产生的ROS,造成机体内ROS的蓄积,诱发了氧化应激,同时组织病理学分析表明机体产生了严重的炎症反应和细胞凋亡现象。这些都说明水霉菌感染鲤后产生大量的ROS,机体遭受氧化应激胁迫,造成机体组织细胞氧化损伤[39]。
鲤感染水霉菌后,氧化应激的产生诱导了炎症和细胞凋亡的发生,共同介导了其病理过程,因此,可以通过阻断氧化应激的发生来预防和治疗真菌感染,通过提高机体的抗氧化水平来清除机体内产生的大量ROS,从而避免组织细胞遭受过度的氧化损伤,并且也能一定程度上缓解炎症反应和细胞凋亡的发生。如在水产养殖中,通过添加抗氧化剂,可增强鱼体的抗氧化能力。后续将进一步评价抗氧化剂或抗氧化应激信号通路的激活剂抵抗水霉菌的作用[20,40]。
参考文献:
[1] 周志明,朱俊杰.水霉病研究概况[J].现代渔业信息,2009,24(5):9-12,27.
[2] 王 浩,张 楠,杨先乐,等.水霉菌环介导等温扩增检测方法的建立[J].微生物学通报,2012,39(12):1835-1843.
[3] 熊 刚,尹思璐,梁永增,等.河鲈水霉病病原菌的研究[J].安徽农业科学,2013,41(8):3411-3413,3439.
[4] 尹伦甫,陈昌福.水霉病的预防与诊治方法[J].科学养鱼,2009(1):76.
[5] 張世奇.抗水霉药物的筛选及其制剂的应用效果研究[D].上海:上海海洋大学.2011.
[6] 陈本亮,张其中.水霉及水霉病防治的研究进展[J].水产科学,2011,30(7):429-434.
[7] 曹海鹏,卫若鹏.关于水产养殖动物水霉病防治的探讨[J].当代水产,2011,36(4):76-78.
[8] BRUIJIN I D, BELMONTE R, ANDERSON V L, et al. Immune gene expression in trout cell lines infected with the fish pathogenic oomycete Saprolegnia parasitica[J]. Dev Comp Immunol, 2012,38(1):44-54.
[9] BELMONTE R,WANG T,DUNCAN G J,et al.Role of pathogen-derived cell wall carbohydrates and prostaglandin E2 in immune response and suppression of fish immunity by the oomycete Saprolegnia parasitica[J]. Infection and Immunity, 2014, 82(11): 4518-4529.
[10] CICCAQLIONE A R, MARCANTONIO, TRITARELLI E, et al. Activation of the ER stress gene gadd153 by hepatitis C virus sensitizes cells to oxidant injury[J]. Virus Research,2007, 126(1-2): 128-138.
[11] GOODY R J, HOYT C C, TYLER K L. Reovirus infection of the CNS enhances iNOS expression in areas of virus-induced injury[J]. Exp Neurol, 2005, 195: 379-390.
[12] 俞卓偉,保志军,阮清伟,等.氧化应激-炎症-衰老及其与ApoE基因相关性研究进展[J].生理学报,2013,65(3):338-346.
[13] BHIMARAJ K, TANQ W H. Role of oxidative stress in disease progression in Stage B, a pre-cursor of heart failure[J]. Heart Fail Clin, 2012, 8(1): 101-111.
[14] FUJII H, NAKAI K, FUKAGAWA M. Role of oxidative stress and indoxyl sulfate in progression of cardiovascular disease in chronic kidney disease[J]. Ther Apher Dial, 2011, 15(2):125-128.
[15] BOLFA PF, LEROUX C, PINTEA A, et al. Oxidant-antioxidant imbalance in horses infected with equine infectious anaemia virus[J]. The Veterinary Journal, 2012, 192(3): 449-454.
[16] VLAHOS R, STAMBAS J, SELEMIDIS S. Suppressing production of reactive oxygen species (ROS) for influenza A virus therapy[J]. Trends Pharmacol Sci, 2012, 33(1): 3-8.
[17] 施志慧,史训龙,周海燕,等.病毒感染与氧化应激的关系[J].复旦学报(医学版),2012(1):80-85.
[18] CHANG C W, SU Y C, HER G M, et al. Betanodavirus induces oxidative stress-mediated cell death that prevented by anti-oxidants and zfcatalase in fish cells[J]. PLoS ONE, 2011, 6(10): e25853.
[19] JIA R, CAO L P, DU J L, et al. Grass carp reovirus induces apoptosis and oxidative stress in grass carp (Ctenopharyngodon idellus) kidney cell line[J]. Virus Research, 2014, 185(25): 77-81.
[20] YANG Y, HUANG J, LI L, et al. Up-regulation of nuclear factor E2-related factor 2 upon SVCV infection[J]. Fish & Shellfish Immunology, 2014, 40(1): 245-252.
[21] YUAN JF, SU N, WANG M, et al. Down-regulation of heme oxygenase-1 by SVCV infection[J]. Fish & Shellfish Immunology, 2012, 32(2): 301-306.
[22] CLAUS C, SCHONEFELD K, HUBNER D, et al. Activity increase in respiratory chain complexes by rubella virus with marginal induction of oxidative stress[J]. Journal of Virology, 2013, 87(15): 8481-8492.
[23] DESHMANE SL, MUKERJEE R, FAN S, et al. Activation of the oxidative stress pathway by HIV-1 Vpr leads to induction of hypoxia-inducible factor 1alpha expression[J]. J Biol Chem, 2009, (17): 11364-11373.
[24] DANTAS A D S, DAY A, LKEH M, et al. Oxidative stress responses in the human fungal pathogen,Candida albicans[J]. Biomolecules, 2015, 5(1): 142-165.
[25] SHELEF A, CHIN B. Effect of phenolic antioxidants on the mutagenicity of aflatoxin B1[J]. Applied and Environmental Microbiology, 1980, 40(6): 1039-1043.
[26] LAI P F, CHENG C F, LIN H, et al. ATF3 protects against LPS-Induced inflammation in mice via inhibiting HMGB1 expression[J/OL]. Evidence-based Complementary and Alternative Medicine: ECAM,http://dx.doi.org/1o.1155/2013/716481, 2013, 20(4): 301-301.
[27] 王秋林,王浩毅,王樹人.氧化应激状态的评价[J].中国病理生理杂志,2005,21(10):2069-2074.
[28] 丛晓楠,王府民,邢少华,等.PCV2感染对仔猪抗氧化功能的影响[J].畜牧与兽医,2011,43(9):51-54.
[29] 易 勤,张谊芝.病毒感染患者的氧化应激状态的研究[J].国际皮肤性病学杂志,2004,30(6):384-386.
[30] 王艳艳,姚俊杰,梁正其,等.Pb2+对建鲤幼鱼抗氧化酶活性和总抗氧化能力的影响[J].淡水渔业,2013,43(1):55-58.
[31] 谢飞舟,施冬云,肖 玲,等.2型糖尿病葡萄糖应激与抗氧化代偿的变化[J].复旦大学学报(医学版),2009,36(1):23-27.
[32] 陈兴祥.PCV2感染、氧化应激与硒的相互作用关系及其机理研究[D].南京:南京农业大学,2012.
[33] 李 航.Nrf2-ARE信号通路对Ⅰ型糖尿病小鼠肾脏氧化应激的影响及其作用机制的研究[D]. 石家庄:河北医科大学, 2010.
[34] YIN J,REN W,LIU G, et al.Birth oxidative stress and the development of an antioxidant system in newborn piglets[J].Free Radical Research,2013, 47(12): 1027-1035.
[35] 田晓华.氧化应激与细胞凋亡[J].国外医学(卫生学分册),1997(2):302-305.
[36] 官 媛,郑强荪,单兆亮,等.炎症和氧化应激标志物在犬心房颤动模型中的变化及意义[D].西安:第四军医大学,2010.
[37] 周 敬.慢性间歇低氧大鼠体内氧化应激、炎症反应、内皮细胞功能障碍及N-乙酰半胱氨酸干预作用的机制研究[D].上海:复旦大学, 2009.
[38] KARIN M,CHANG L, HONDA S, et al. Reactive oxygen species promote TNFα-induced death and sustained JNK activation by inhibiting MAP kinase phosphatases[J].Cell,2005,120:649-661.
[39] 杨红英.实验性糖尿病大鼠脑组织病变与氧化应激关系的研究[D].昆明:昆明医学院,2009.
[40] GAO J, KOSHIO S, ISHIKAWA M, et al. Effect of dietary oxidized fish oil and Vitamin C supplementation on growth performance and reduction of oxidative stress in red sea bream pagrus major[J]. Aquaculture Nutrition, 2012, 19(1): 35-44.
(责任编辑 屠 晶)
