胍基乙酸对建鲤生产性能、体成分及肌肉能量代谢关键酶的影响
2015-12-18乔丽红唐志刚刘文斌周岩民
洑 琴 乔丽红 唐志刚 温 超 刘文斌,2 周岩民
(南京农业大学动物科技学院1,南京 210095)
(江苏省水产动物营养重点实验室2,南京 210095)
胍基乙酸对建鲤生产性能、体成分及肌肉能量代谢关键酶的影响
洑 琴1乔丽红1唐志刚1温 超1刘文斌1,2周岩民1
(南京农业大学动物科技学院1,南京 210095)
(江苏省水产动物营养重点实验室2,南京 210095)
研究胍基乙酸(guanidinoacetic acid,GAA)对建鲤生产性能、体成分及肌肉能量代谢的影响。选取600尾平均体重为(23.23±0.14)g的建鲤随机分为4组,每组5个重复,每个重复30尾,分别投喂基础饲料(对照组)和在基础饲料中添加250、500和1 000mg/kg GAA的试验饲料,试验为期42 d。结果表明:与对照组相比,添加250、500mg/kg GAA可显著降低饵料系数(P<0.05),但对体重、特定生长率、增重率、平均日采食量和成活率均无显著影响(P>0.05)。添加GAA可显著提高脏体指数(P<0.05),对肝体指数无显著影响(P>0.05)。GAA对肌肉中粗脂肪、粗蛋白和粗灰分含量无显著影响(P>0.05)。250mg/kg GAA组可显著降低肌肉中丙酮酸激酶活性(P<0.05);250、500mg/kg GAA组显著降低琥珀酸脱氢酶活性(P<0.05);1 000mg/kg GAA组显著降低肌酸激酶活性(P<0.05);GAA组均显著提高肌糖原含量(P<0.05)。结果表明,饲料中添加胍基乙酸可降低肌肉中能量代谢关键酶的活性来改善其能量代谢,提高饲料转化率,以添加250mg/kg GAA效果较好。
胍基乙酸 建鲤 生产性能 体成分 能量代谢
胍基乙酸,又称胍乙酸(guanidinoacetic acid,GAA),是机体内合成肌酸的主要内源性物质,由甘氨酸和L-精氨酸形成,所以亦称甘氨酸衍生物,分布于机体各个组织器官中,是尿中的常规成分[1]。肌酸是细胞内能量新陈代谢的重要分子,能量暂时储存的场所,它和磷酸肌酸一起组成磷酸原系统,在ATP供能不足时,提供P供ADP重新合成ATP促进肌肉能量代谢[2]。肌酸能增强人的耐受力和降低疲劳感,增强肌肉运动能力[3]。但肌酸不稳定,且价格昂贵,难以在饲料中推广应用,而GAA是合成肌酸的前体,稳定且能被机体吸收。研究表明,GAA能提高动物对能量的利用率、促进动物生长和提高饲料利用率[4-6]。目前,有关GAA的研究尚处在起步阶段,且主要应用于肉鸡和育肥猪配合饲料中,而在水产饲料中的应用研究则鲜见报道。为此,本研究以建鲤为实验动物,通过在基础饲料中添加不同水平的GAA,研究其对建鲤生产性能、体成分及肌肉能量代谢的影响,以期为GAA在水产养殖中的合理应用提供参考依据。
1 材料与方法
1.1 材料
GAA:南京苏科农业开发有限公司,纯度99%;基础饲料:江苏宜兴苏南饲料有限公司,均制成颗粒饲料,配方及营养水平见表1。
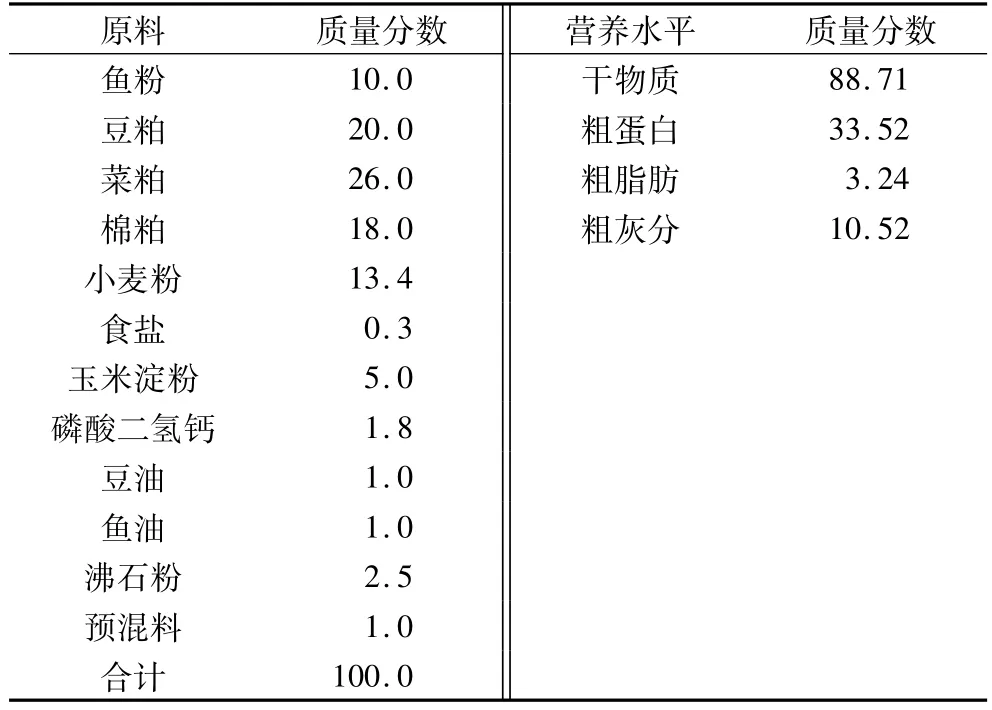
表1 基础饲料配方及营养水平(风干基础,%)
1.2 方法
选取体重为(23.23±0.14)g的建鲤600尾,随机分成4组,每组5个重复,每重复30尾,分别饲喂基础饲料(对照组)和在基础饲料中额外添加250、500和1 000mg/kg GAA的试验饲料。网箱规格为1.5 m×1.5 m×1.5 m,网目1.5 cm,带盖。相邻网箱间隔2 m,并列置于池塘中。
1.3 饲养管理
试验在中国水产科学研究院淡水渔业研究中心宜兴试验基地进行。试验期间每日定时(8∶00、12∶00和16∶00)投喂饲料,日投喂量为建鲤体质量的2%~4%,根据具体摄食情况调整;每日观察建鲤的健康状况;每日定时(8∶00和16∶00)测定网箱内水体的水温、溶氧和pH,当水中溶氧量低于5.0mg/L时,开启微孔曝气机供氧;测定氨氮和亚硝酸盐(8∶00),每周给池塘注入约1/3的新水;试验期间水温24~28℃,溶氧>5.0mg/L,pH为6.9~7.1、氨氮<0.5mg/L、亚硝酸盐<0.20mg/L;其他均按常规管理。在正式饲养开始前,驯化7 d,试验期42 d。
1.4 样品采集及处理
试验结束时于每个网箱中随机取鱼2尾,取背鳍下方测线以上的白肌5 g左右,装于自封袋内-20℃保存。取部分肌肉组织,105℃烘干后粉碎,装于自封袋内-20℃保存,用于测定肌肉成分;称取0.2 g肌肉组织,按1∶9(m/V)加4℃生理盐水,冰浴下匀浆,离心后取上清液分装入离心管中,-20℃冷藏备用,测定前于4℃冰箱中自然化冻,用于测定能量代谢关键酶。上清液中的蛋白含量用BCA试剂盒(南京建生生物工程研究所)测定。
1.5 测定指标及方法
1.5.1 生产性能
饲养试验开始和结束时,记录每个网箱中鱼的尾数和总质量,饲养试验结束后禁食24 h,测定特定生长率、增重率、平均日采食量、成活率和饵料系数。计算公式如下:
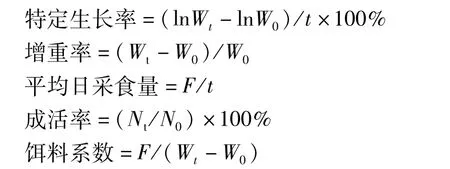
式中:W0为试验开始时鱼体质量/g;Wt为试验结束时鱼体质量/g;t为饲养时间/d;N0为初始尾数;Nt为终末尾数;F为饲料摄入量/g。
1.5.2 形体指标
测定每个网箱里随机取的2尾鱼的体长,解剖并逐尾称取体重、肝胰脏重和去内脏的鱼体重,以计算建鲤的肝体指数、脏体指数和肥满度。计算公式如下:
肝体指数=肝胰脏质量/体质量×100%
脏体指数=内脏质量/体质量×100%
肥满度=体质量/体长3×100%
1.5.3 鱼体成分的测定
粗脂肪采用索氏抽提法(GB/T 6433—2006)、粗蛋白采用全自动凯氏定氮仪测定(FOSS:Kjeltec 2300)、粗灰分采用马福炉灼烧法(GB/T 6438—2007)进行测定。
1.5.4 肌肉能量代谢关键酶的测定
肌肉能量代谢关键酶活性采用试剂盒测定。丙酮酸激酶(PK)活性测定原理:在ADP存在下PK催化磷酸烯醇式丙酮酸产生丙酮酸;酶活单位定义:在37℃,pH 7.6时,1 g组织蛋白将1μmol的PEP转变成丙酮酸为一个酶活力单位。琥珀酸脱氢酶(SDH)活性测定原理:SDH催化底物反应,该反应与2,6-DPIP的还原相偶联,测定2,6-DPIP的还原速度计算SDH的活力;酶活单位定义:1mg蛋白1 min使反应体系的吸光度降低0.01为一个比活性单位。肌酸激酶(CK)活性测定原理:CK催化三磷酸腺苷和肌酸生成磷酸肌酸,三磷酸腺苷和二磷酸腺苷稳定,加入钼酸铵还原成钼蓝,根据生成无机磷的量计算酶的活力。肌糖原浓度采用蒽酮比色法测定。
1.6 数据处理
试验数据用Excel进行初步处理,采用SPSS16.0软件进行统计,采用单因素方差分析(One-way ANOVA,Duncan)进行差异显著性检验和多重比较,结果以“平均值±标准误(X±SE)”表示。
2 结果
2.1 GAA对建鲤生产性能的影响
添加250、500和1 000mg/kg GAA组使饵料系数分别比对照组降低12.76%(P<0.05)、10.20%(P<0.05)和7.14%(P>0.05),而对末均重、特定生长率、增重率、平均日采食量和成活率均无显著影响(P>0.05),但试验组均高于对照组(表2)。

表2 GAA对建鲤生产性能的影响
2.2 GAA对建鲤形体指标及体成分的影响
添加250、500和1 000mg/kg GAA组分别使肝体指数比对照组提高14.63%(P>0.05)、22.44%(P>0.05)和8.78%(P>0.05);脏体指数提高10.63%(P<0.05)、10.13%(P<0.05)和7.65%(P<0.05),各试验组之间差异不显著(P>0.05);各组肥满度、肌肉中粗脂肪、粗蛋白和粗灰分含量无显著差异(P>0.05)(表3)。
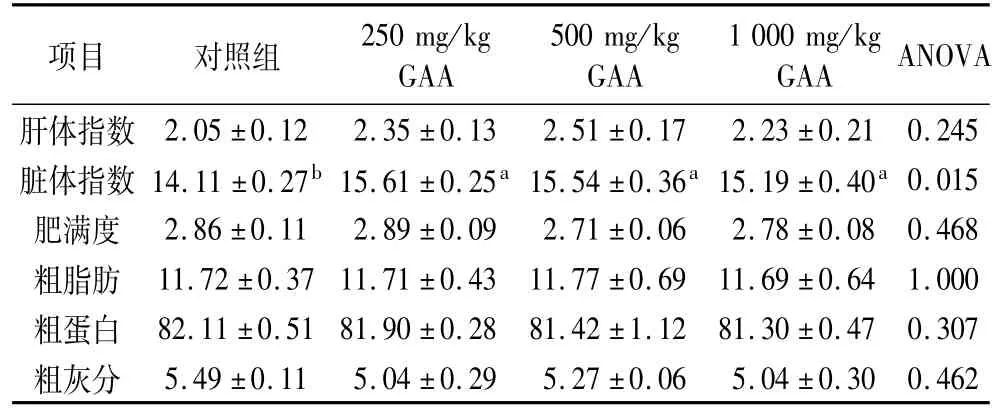
表3 GAA对建鲤形体指标及体成分的影响
2.3 GAA对建鲤肌肉能量代谢关键酶的影响
250、500和1 000mg/kg GAA组分别使PK活性比对照组降低21.14%(P<0.05)、15.75%(P>0.05)和12.31%(P>0.05),SDH活性降低31.66%(P<0.05)、21.64%(P<0.05)和7.97%(P>0.05),CK活性降低42.48%(P>0.05)、31.26%(P>0.05)和49.40%(P<0.05),肌糖原含量提高198.94%(P<0.05)、125.53%(P<0.05)和132.98%(P<0.05)(表4)。

表4 GAA对建鲤肌肉能量代谢关键酶的影响
3 讨论
3.1 GAA对建鲤生产性能的影响
GAA是机体内合成肌酸的主要内源性物质,饲料中添加的GAA作为肌酸的有效前体可以促进肌肉的能量代谢,减少碳水化合物、脂肪和蛋白质的分解供能,从而加快动物生长,提高饲料转化率[4-6]。Lemme等[4]在肉鸡日粮中添加200、400、600mg/kg GAA,结果表明,400、600mg/kg GAA组可显著降低料重比。江涛等[5]在日粮中添加200、400、600、800mg/kg GAA,其中600、800mg/kg GAA组显著提高了肉鸡日增重,降低了料重比。祁永旺等[6]发现,500、1 000mg/kg GAA显著提高了育肥猪日增重,降低了料重比。刘加合等[7]和张堂田等[8]试验表明,育肥猪日粮中添加800mg/kg GAA可显著提高日增重。本试验中,添加250、500mg/kg GAA显著降低建鲤的饵料系数,对建鲤末均重、特定生长率、增重率、平均日采食量和成活率均有改善作用,其适宜添加量较低,可能是动物种属差异所致。GAA能有效提高饲料利用率原因可能是增加了肌酸来源,近而增加磷酸肌酸和ATP含量,促进能量代谢,提高能量利用率[9],同时促进蛋白质的合成代谢,但分解代谢没有变化[9-10],最终提高利用率。
3.2 GAA对建鲤形体指标及体成分的影响
形体指标反映鱼体的健康状况、营养水平等[11]。对于相同规格的鲤鱼,肥满度升高表示鲤鱼体型好、增重快[11]。肝胰脏是鱼类中间代谢和营养储存的重要器官,肝体指数是对长期和短期营养方式均较敏感的指标,随着营养发生变动肝脏重量也会发生明显变化[11-12]。本试验中,GAA使肝体指数无变化,表明GAA在机体内作为直接供能物质,其代谢过程并没有加重鱼体肝胰脏的代谢负担;脏体指数显著升高,其原因有待于进一步研究。饲料中GAA的添加对建鲤形体指标影响较小,对肌肉营养成分无影响,表明GAA不影响其体形和食用价值。
3.3 GAA对建鲤肌肉能量代谢关键酶的影响
PK是糖酵解反应过程中的关键酶,可调节细胞中ATP、ADP和糖酵解的中间产物,其活性的变化能迅速反映糖酵解能力的水平[13]。SDH是三羧酸循环的标志酶,可间接反映线粒体功能和组织的供氧情况[14],其活性变化能迅速反映有氧代谢能力的水平[15]。CK是一个与细胞内能量运转、肌肉收缩、ATP再生有直接关系的重要激酶,它可逆地催化磷酸肌酸与ATP之间高能磷酸键的转化,其活性的变化反映肌肉组织能量储存和转换功能状况的改变[16]。Michiels等[17]研究表明,饲料中添加GAA能增加动物肌肉中肌酸含量;Casey等[18]和吴娟等[16]发现,肌肉细胞中肌酸水平的提高伴随着磷酸肌酸水平的提高,磷酸肌酸供给ADP磷酸化反应生成ATP,当贮存的磷酸肌酸被消耗完后,才改由糖原酵解供给ADP的磷酸化反应。本试验中,250mg/kg GAA组显著降低PK和SDH活性、增加肌糖原含量,这可能是GAA是合成肌酸的前体物质,直接增加磷酸肌酸和ATP含量,减少葡萄糖的分解供能,从而使糖酵解的PK和三羧酸循环中的SDH活性降低,同时也使葡萄糖更多的以糖原形式贮存于肌肉,这与吴娟等[16]和Eijnde等[19]的结果相一致。CK活性降低,这可能是此时肌细胞处于能量充盈状态,致使肌酸向肌酐转化的代谢能力增强,而肌酸与磷酸肌酸之间的转化变弱,这与夏伟光等[20]和吴娟等[16]的结果相一致。500、1 000mg/kg GAA组对能量代谢的影响弱于250mg/kg GAA添加组,可能与建鲤对肌酸的吸收能力有关。机体对肌酸的吸收主要通过钠-氯依赖性肌酸转运载体(CreaT1)进行,补充过多肌酸会抑制CreaT1蛋白的表达[21],还抑制内源性肌酸合成[22]。且鱼体背鳍下方的白肌属于酵解型纤维,肌酸在糖酵解型纤维(Ⅱb型)中吸收又是最低的[23]。
4 结论
在本试验条件下,饲料中添加GAA可通过降低建鲤肌肉能量代谢关键酶活性而改善其能量代谢,提高饲料转化率,以添加250mg/kg GAA效果较好,添加量进一步降低效果是否更佳有待继续研究。
[1]王连生,张圆圆,单安山.胍基乙酸的体内代谢及在动物生产中的应用[J].中国畜牧兽医,2010,37(6):13-16
[2]魏源.补充肌酸对运动能力和健康的影响[J].沈阳体育学院学报,2005,24(2):12-14
[3]Wyss M,Kaddurah-Daouk R.Creatine and creatininemetabolism[J].Physiological Reviews,2000,80(3):1107-1213
[4]Lemme A,Ringel J,Sterk A R,et al.Supplemental guanidine acetic acid affects energy metabolism of broilers[C]. Proceedings 16th European Symposium on Poultry Nutrition. Strasbourg France,2007:26-30
[5]江涛,戴燊,李小燕,等.胍基乙酸对AA肉仔鸡生长性能和屠宰性能的影响[J].饲料研究,2012(4):8-10
[6]祁永旺,王昕陟,侯华,等.胍基乙酸对育肥猪生产性能和胴体品质的影响[J].黑龙江畜牧兽医,2011(6):65-66
[7]刘加合,王益仓.胍基乙酸(GAA)和甜菜碱及N-甲基-D-天冬氨酸(NMDA)对育肥猪生长和肉质的影响试验[J].浙江畜牧兽医,2012(3):3-5
[8]张堂田,孟秀丽,江涛,等.胍基乙酸和N-甲基-D-天冬氨酸对育肥猪生长和肉品质的影响[J].湖南农业科学,2011(23):121-123
[9]程灵豪,高峰,周光宏.肌酸对动物生产性能、胴体组成和肉品质的影响研究[J].中国粮油学报,2009,24(6):93-97
[10]Young JF,Bertram H C,Theil PK,et al.In vitro and in vivo studies of creatinemonohydrate supplementation to Duroc and Landrace pigs[J].Meat Science,2007,76(2):342-351
[11]王晶晶,刘文斌,徐维娜,等.热应激建鲤饲料中吡啶甲酸铬的适宜添加量[J].动物营养学报,2011,23(7):1209-1216
[12]孟祥林,丁庆秋.鱼类肝胆综合症的发病原因及防治方法[J].水利渔业,2004,24(3):65
[13]汪玉松,邹思湘,张玉静.现代动物生物化学[M].第三版.北京:高等教育出版社,2005:466-490
[14]Nakatani T,Nakashima T,Kita T,et a1.Succinate dehydrogenase activities of fibers in the rat extensor digitorum longus,soleus,and cardiac muscles[J].Archives of Histology and Cytology,1999,62(4):393-399
[15]冯炜权.运动生物化学原理[M].北京:北京体育大学出版社,1995:229
[16]吴娟.一水肌酸对肉鸭胴体组成、肉品质及宰后肌肉能量代谢的影响研究[D].南京:南京农业大学,2011
[17]Michiels J,Maertens L,Buyse J,et al.Supplementation of guanidinoacetic acid to broiler diets:effects on performance,carcass characteristics,meat quality and energy metabolism[J].Poultry Science,2012,91:402-412
[18]Casey A,Greenhaff P L.Does dietary creatine supplementation play a role in skeletalmusclemetabolism and performance?[J].The American Journal of Clinical Nutrition,2000,72(2):607-617
[19]Eijnde B O,Richter E A,Henquin JC,et al.Effect of creatine supplementation on creatine and glycogen content in rat skeletal muscle[J].Acta Physiologica Scandinavica,2001,171(2):169-176
[20]夏伟光,左建军,冯定远.肉鸡饲粮中添加一水肌酸对骨骼肌肌酸吸收和代谢的影响[J].动物营养学报,2013,25(2):372-381
[21]Guerrero-ontiveros M L,Wallimann T.Creatine supplementation in health and disease.Effects of chronic creatine ingestion in vivo:down-regulation of the expression of creatine transporter isoforms in skeletalmuscle[J].Molecular and Cellular Biochemistry,1998,184:427-437
[22]李显,肖海涛,艾华.补充肌酸对生长发育期雌、雄大鼠内源性肌酸合成的影响[J].中国运动医学杂志,2008, 27(1):61-66
[23]Brannon T A,Adams G R,Conniff C L,et al.Effects of creatine loading and training on running performance and biochemical properties of rat skeletalmuscle[J].Medicine and Science in Sports and Exercise,1997,29(4):489-495.
Effects of Guanidinoacetic Acid on Growth Performance,Body Composition and Key Enzymes of Energy Metabolism of Muscle in Jian Carp(Cyprinus carpiovar.Jian)
Fu Qin1Qiao Lihong1Tang Zhigang1Wen Chao1Liu Wenbin1,2Zhou Yanmin1
(College of Animal Science and Technology,Nanjing Agricultural University1,Nanjing 210095)
(Key Laboratory of Aquatic Animal Nutrition and Feed Science of Jiangsu Province2,Nanjing 210095)
The study has been conducted to evaluate the effects of guanidinoacetic acid(GAA)supplementation in growth performance,body composition and energymetabolism ofmuscle in Jian carp(Cyprinus carpiovar.Jian). A total of 600 fish[average weight(23.23±0.14)g]were randomly divided into 4 groups and each group had 5 replicates with 30 fish per replicate.Fish were fed a basal diet(control group),the other group with the samewhile supplemented with 250,500 or 1 000mg/kg GAA respectively.The results showed that the supplementation of GAA did not affect the weight,specific growth rate,weight gain rate,average daily feed intake or survival rate of fish(P>0.05).However,the gain ratiowas reduced significantly by 250 and 500mg/kg GAA(P<0.05).GAA supplementation did not affect hepatosomatic index,while increased viscero-somatic index(P<0.05).Therewere no significant differences observed in themuscle crude fat,crude protein,and crude ash contents among the treatment groups(P>0.05).Compared with the control group,the activity of pyruvate kinase in muscle was reduced by 250mg/kg GAA(P<0.05),succinate dehydrogenase activity was reduced by 250 and 500mg/kg GAA(P<0.05),and creatinekinase activity was reduced by 1 000mg/kg GAA(P<0.05).The glycogen content in muscle in all GAA groupswas larger than that in the control group(P<0.05).The study indicated that the diets supplemented with GAA can reduce the feed gain ratio and improve energymetabolism inmuscle by reducing the activities of energy metabolism’PerillaLs key enzymes.The optimal level of GAA for Jian carp was suggested to be 250mg/kg.
guanidinoacetic acid,Cyprinus carpiovar.Jian,growth performance,body composition,energy metabolism
S965.116
A
1003-0174(2015)03-0085-05
现代农业产业技术体系建设专项(nycytx-49-21)
2013-11-07
洑琴,女,1988年出生,硕士,动物营养与饲料科学
周岩民,男,1963年出生,教授,博士生导师,动物营养与饲料科学
