地下咸水中Ca2+和Mg2+对CO2溶解度的影响
2015-12-16于青春
王 璐,于青春
(中国地质大学(北京)水资源与环境学院,北京 100083)
过量排放温室气体(CO2,CH4等)导致严重的环境灾害,CO2减排迫在眉睫。在地下深部咸水含水层中实施CO2储存是公认的应对温室效应最有前景的方案[1]。CO2在地下深部咸水中的储存机制主要包括:气态封存,溶解封存及矿化封存。其中,溶解封存是将超临界态CO2(温度高于31.4℃,压力高于7.38 MPa)溶解于地下咸水中,从而达到封存的目的[2],其封存量占据CO2地质封存总量的90%左右。
CO2溶解度是进行咸水含水层CO2储存能力评价、泄露风险评估等工作的重要参数。在沉积盆地含水层储存能力评价中,最重要的指标是CO2溶解储存容量[6]。在区域面积、沉积层厚度以及孔隙度给定的条件下,CO2溶解度是影响溶解储存容量的关键因素,其数值由储层温度、压力以及地下水成分共同控制。还有一种CO2储存能力估算方法是对不同盐水层圈闭控制区的储存容量进行加权求和[3],而各圈闭控制区内的容量系数只与溶解度与气体饱和度相关。在进行CO2储存安全评价时,需要考虑到CO2从储层中泄露的情况,获得水中CO2的溶解度是估算CO2在咸水中停留时间和研究逃逸机制的前提。CO2在地下水中迁移时,含有CO2的地下水存在密度驱动的对流,溶解的CO2会影响水的流动,进而影响CO2在地下水中的迁移。另外,确定CO2的溶解度也是很多研究课题的重点,如提高石油采收率,研究天然气水合物运移规律,海水淡化以及流体包裹体的形成和运移规律等[4]。
在模型方面,目前大部分CO2溶解度模型都是半经验模型,CO2在地下咸水中溶解度实验值的缺乏仍是制约模型精度的因素之一[5]。高精度CO2溶解度实验数据在验证模型正确性方面具有重要的价值。然而在高压条件下,具有高可信度,即绝对平均误差(绝对平均误差为对同一物理量进行多次测量,并对误差取绝对值后求得的平均值)小于3.5%的CO2溶解度实验数据很少,并且大多数研究主要针对CO2在纯水及NaCl溶液中的溶解度,这导致地下咸水中CO2溶解度实验数据的缺乏成为了评估咸水含水层的CO2储存能力和泄露风险的限制因素。
近年来,大量学者利用不同方法测定了CO2在地下咸水中的溶解度,Bamberger等[6]增设了透明窗口的高压釜观察汽水分离过程,并通过低压气体膨胀逸出的方法研究了313~353 K,0~14 MPa下,CO2在酸性地下咸水中的溶解度。Markham和Kenneth[21]通过Ostwald法(将已知体积CO2通入定量水中,测定剩余CO2体积)测得不同温度常压下 CO2在 K+,Na+,Mg2+溶液中的溶解度。Tong等[11]利用饱和溶液露点定量溶质和溶剂的方法测定了423 K和40 MPa以下的人工合成地下咸水中CO2的溶解度。
地下咸水的溶解性总固体会随着地层深度的增加而增加,在很深的地层和蒸发岩床附近,地下咸水中离子浓度能达到400 g/L[7],所以 Ca2+和Mg2+是地下水中的最常见离子,查明这两种离子对CO2溶解度的影响是否存在明显差异具有广泛的理论和实际意义。然而在高压条件下Ca2+、Mg2+对CO2溶解度的影响却鲜有人研究,许多CO2溶解度模型只将电子价态作为不同种类阳离子对溶解度影响的依据,认为 Ca2+与Mg2+对溶解度有同等的影响,且是Na+影响能力的2倍。但万玉玉[8]的实验数据表明,CO2在MgCl2溶液中的溶解度小于CaCl2溶液。而Akira和Fumitake[9]测定了一个大气压下CO2在不同阳离子溶液中的溶解度,认为CaCl2溶液中CO2的溶解度略小于MgCl2溶液。
本研究基于体积分析法建立了一套新的CO2溶解度测定装置,对达到溶解平衡的体系减压,通过测定逸出气体体积的方法获得CO2溶解度。克服了传统高压釜取样不便和实验重现性差的缺点。测定和对比了40~70℃,0~20 MPa下,0.1 mol/L、0.2 mol/L 和0.5 mol/L的CaCl2以及MgCl2溶液中 CO2溶解度。实验结果表明,CO2在Ca2+和Mg2+溶液中的溶解度存在差异,当溶液中离子浓度较低时(0.1 mol/L),上述差异并没有随温度和压力的改变显示出规律性的波动,随着离子浓度的升高,上述差异开始呈现一定的规律性。同时可以看出,当CO2达到超临界状态以后,Ca2+对 CO2的溶解度的影响小于 Mg2+。结合Krichevsky-Kasanovsy方程与阳离子“盐析效应”,分别对温度,压力对溶解度的影响做了理论分析,并对不同阳离子对溶解度的影响给出了比较合理的解释。
1 实验方法及其验证
目前测定高温高压条件下CO2溶解度常用的实验方法是向充有已知体积水样的高压釜中注入CO2,待CO2和水在规定的温度和压力下达到平衡后通过取样器从高压釜中取出一定体积的水样,测定水样的CO2含量,从而计算水溶液的CO2溶解度。这种方法的缺点在于直接从高压釜中取样时,CO2气体容易“穿透”液体大量进入取样器,使取样器中水的CO2含量不能反映高压釜中CO2的实际溶解度,从而只能舍弃某些样品的测试结果。为了克服上述困难,本研究设计了新的测试仪器。
1.1 实验原理
本研究设计仪器的核心部分是一个已知容积的高压釜(图1)。实验开始时首先向釜内注入V2体积的咸水,再利用高压泵向釜内注入一定量的CO2,CO2所占空间为V1。待釜内的CO2-H2O达到平衡时,记录高压釜的温度和压力。这时釜内CO2由超临界状态与溶解状态两部分组成,将超临界CO2摩尔数记为N1,溶解态CO2摩尔数记为N2。系统达到溶解平衡后,打开高压釜的放气阀门,缓慢释放釜内的CO2,由于釜内压力降低,溶解状态的CO2将从溶液中逸出。当釜内压力降到1atm时,结束排气过程。将此过程排出CO2的摩尔数记为N3,并将排气结束后恢复至常温常压的高压釜内水中溶解的CO2摩尔数记为N4。将1atm下CO2排出水的体积记为V3,利用V3可计算出N3。结束排气过程后,在高压反应釜内取体积为V4的水样(本实验中V4为10 mL),利用双指示剂滴定法测定水中CO2浓度并计算N4。由放气前后CO2摩尔数守恒可以得到式(1)。通过N2可以计算出CO2在一定温度以及压力下的溶解度。N1,N3以及N4的具体计算方法将在数据处理部分详细叙述。


图1 高压反应釜测定CO2溶解度原理图Fig.1 Schematic diagram of the CO2solubility determination
1.2 实验装置及基本方法
实验装置示意图见图2。主反应装置为高压反应釜。反应釜上部装有高精度压力表,反应釜整体置于精确控温水浴箱内。水浴箱工作温度范围为0~100℃。并配有搅拌装置,水浴温度波动小于0.2℃。
进气装置由CO2储罐、循环冷箱以及柱塞泵构成。各部分采用φ3 mm的不锈钢管路连接。经过标定得到高压反应釜内部总容量为0.500 1L(如图1所示,V1=3.10 ×10-3L,V2=0.4970 L),连通压力表和高压釜的管路体积为0.65×10-3L。
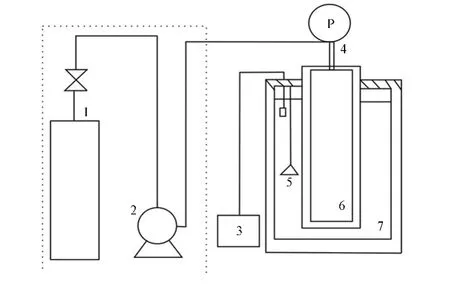
图2 实验装置示意图Fig.2 Schematic diagram of the apparatus
实验开始前,将0.497 0 L溶液加入反应釜并密封,启动恒温水浴系统并打开搅拌器,约3h后,装置将保持在指定温度。
将反应釜上部进气管路与柱塞泵连接。CO2由储气瓶进入冷箱并循环冷却至6℃以下。打开柱塞泵控制开关,将液态CO2注入高压反应釜。当压力表升至20 MPa左右,关柱塞泵和进气阀门。此时反应装置完全密封,5h后,反应釜内压力基本达到稳定,旋开压力反应釜的出口阀,对釜内压力进行调整,使其达到预设压力。静置足够长时间直至反应釜内达到反应平衡,根据 Caroll等[10]和 Yan 等[11]的实验观察,达到反应平衡所需时间约为12h。
排气过程结束后,打开反应釜底部,取10 mL样品,用双指示剂滴定法测定溶液中CO2浓度。分别用酚酞和甲基橙作为指示剂,达到两个滴定终点。先加入0.02 mol/L NaOH至酚酞由无色透明变为淡粉色,此时达到第1个滴定终点,溶液pH约为8.1,CO2转变为HCO3-。然后加入甲基橙试剂,用0.01 mol/L的盐酸溶液继续滴定,至甲基橙由黄色变为橙色时达到第2个终点,此时溶液pH约为4.3。将此次滴定过程中HCl体积记做V5。为了确保滴定结果的准确性,连续取样两次并滴定。
注入高压釜的CO2达到溶解平衡后将以溶解态和超临界态存在,连接压力表和高压釜的管路会储存少量超临界CO2。V1部分与管路连线的总体积为3.75 mL。超临界CO2摩尔数N1可由Peng-Robinson状态方程(PR 方程)得到[12]:

式中:Tc——CO2的临界温度,Tc=304.2 K;
Pc——CO2的临界压力,Pc=7.38 ×106Pa;
ω——CO2的偏心因子,ω =0.228;
V——在给定的温度与压力条件下CO2的摩尔体积/(m3·mol-1);
b——常数,由CO2临界温度与压力决定/(m3·mol-1)。
排气过程中排出CO2的摩尔数N3可以通过大气压下CO2的体积V3得到。而大气压下的气体摩尔体积V'随温度变化,N3的计算:
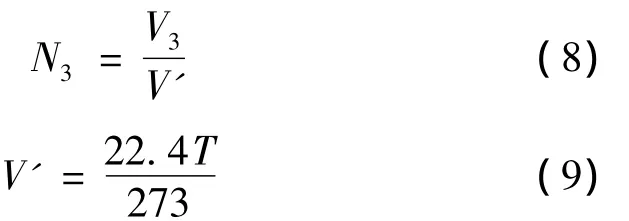
高压釜内水样中溶解的CO2摩尔数N4可用式(10)~(11)求得。式中V4为釜内水样的取样体积,在本实验中取样体积为10 mL。V2为反应釜中溶液体积,本实验装置液体体积为0.497 L。C为滴定溶液中HCO3-的浓度,CHCl为滴定样品所需HCl浓度(本实验为0.01 mol/L)。根据物质的量守恒定律,溶解在溶液中的CO2的摩尔数N2可以利用式(1)求得。CO2溶解度(以mol/L记):
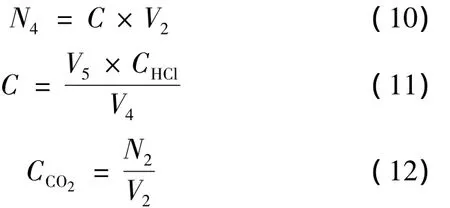
1.3 实验方法可靠性验证
为了验证实验装置及方法的可靠性,利用本研究装置测定了50℃时CO2在纯水中的溶解度,将测定值分别与 Duan 等[13]的模型计算值、Bamberger等[14]的实验值以及Liu等[15]的实验值进行了比较,对比结果见图3。本研究测定值与Duan等模型计算值的绝对平均误差为3.79%,与Bamberger等的实验值的绝对平均误差为2.11%,与Liu的实验值的绝对平均误差为4.95%。均在实验误差范围内。从上述对比可以看出本研究所采用的实验方法和装置有较高精确性,可以满足实验要求。

图3 50℃时CO2在纯水中的溶解度测定值与文献计算值和实验值的对比Fig.3 Comparison of CO2 solubility in pure water at 50℃with the Value in the literates
2 Ca2+、Mg2+溶液中 CO2溶解度
为了确定Ca2+、Mg2+离子对CO2溶解度的影响,本研究测定了40~70℃,0~20 MPa下,CO2在0.1 mol/L、0.2 mol/L和0.5 mol/L CaCl2以及MgCl2溶液中的溶解度。其测定结果如图4(a)~(f)所示。通过分析对比CO2在CaCl2和MgCl2、溶液中的溶解度值,得到Ca2+、Mg2+对CO2溶解度的影响区别。
2.1 CO2在CaCl2溶液中的溶解度
图4中CaCl2溶液中的CO2溶解度变化曲线显示,当压力与浓度固定时,溶解度随温度的升高而降低,然而降低的趋势随着温度的升高而减缓。在固定浓度条件下,温度对溶解度的影响程度随着压力的增大而减少。0.1 mol/L CaCl2溶液中,压力为3 MPa时温度从40℃升高至70℃,CO2溶解度变化量相比于压力为12.3 MPa时增大了5.15%。而在固定压力的情况下,随着离子浓度的升高,温度对溶解度的影响程度逐渐变小。固定压力为10 MPa,当温度从40℃升高至70℃,相比于0.1 mol/L CaCl2溶液,CO2在0.5 mol/L溶液中的溶解度变化量减小了37.56%。
当温度与浓度固定时,溶解度随着压力的增加而增加,但增加的趋势随着压力的增加而减缓。在固定温度的条件下,压力对溶解度的影响程度随着离子浓度的增大而减少。固定温度为40℃,压力为10 MPa时,0.5 mol/L CaCl2溶液中 CO2的溶解度相比0.1 mol/L CaCl2溶液减小了4.87%。
当温度与压力固定时,CO2溶解度随着Ca2+浓度的增大而减少。温度为50℃,压力为10 MPa条件下,溶液中CaCl2浓度从0.1 mol/L增大到0.2 mol/L时,溶解度减小0.098 mol/L。如果将浓度继续增加至0.5 mol/L,溶解度将减小0.13 mol/L。
2.2 CO2在MgCl2溶液中溶解度
CO2在MgCl2溶液中溶解度的变化规律与CaCl2溶液中溶解度的变化规律基本一致。但是与CaCl2溶液不同的是,当温度固定时,随着MgCl2浓度的升高,溶解度呈现出比较明显的变小趋势,当浓度继续升高时,这个趋势逐渐减缓;而在CaCl2溶液中,溶解度减缓的趋势是稳定的。在温度固定为50℃,压力为10 MPa的条件下,当MgCl2浓度从0.1 mol/L增大到0.2 mol/L时,溶解度减小0.27 mol/L,如果将浓度继续增加至0.5 mol/L,溶解度继续减小0.023 mol/L。对比两种溶液中溶解度的变化量得知,在MgCl2溶液中,CO2溶解度对离子浓度更加敏感。
2.3 CO2在MgCl2和CaCl2溶液中溶解度对比
CO2在相同浓度的CaCl2与MgCl2溶液中溶解度的差别见图4(a)~(f)所示。Ca2+、Mg2+对溶解度的影响程度有一定差别,这种差别随着温度的升高,压力与离子浓度的增大而更加明显。
当离子浓度为0.1 mol/L,温度在50℃以下时,Ca2+与Mg2+对溶解度的影响没有显著差别。在固定压力的条件下CO2在CaCl2溶液中的溶解度相对于MgCl2溶液变化了-0.78%(40℃)~1.25%(50℃)。
而当温度升高时,如图4(b)所示,CaCl2溶液中CO2的溶解度在7.32 MPa(CO2临界压力)以上则会大于MgCl2中溶解度。图4(c)~(f)显示,当离子浓度增大时,溶解度在压力低于临界压力时开始出现差别,故当溶液中阳离子含量较少时(低于0.1 mol/L),阳离子对CO2溶解度影响程度不大,并在超临界状态后才能明显体现;但是当离子浓度升高后,不同阳离子对溶解度的影响程度则在较低的温度和压力下就能明显体现。
当离子浓度为0.2 mol/L,压力条件在10 MPa条件下,CaCl2溶液中CO2溶解度相比于MgCl2溶液增大10.48%~17.21%(随温度而变化)。当离子浓度为0.5 mol/L,压力条件为10 MPa,CaCl2溶液中CO2溶解度相比于MgCl2溶液平均增大了1.10%~15.66%(随温度而变化)。由此可见,不同溶液中CO2溶解度有所区别。
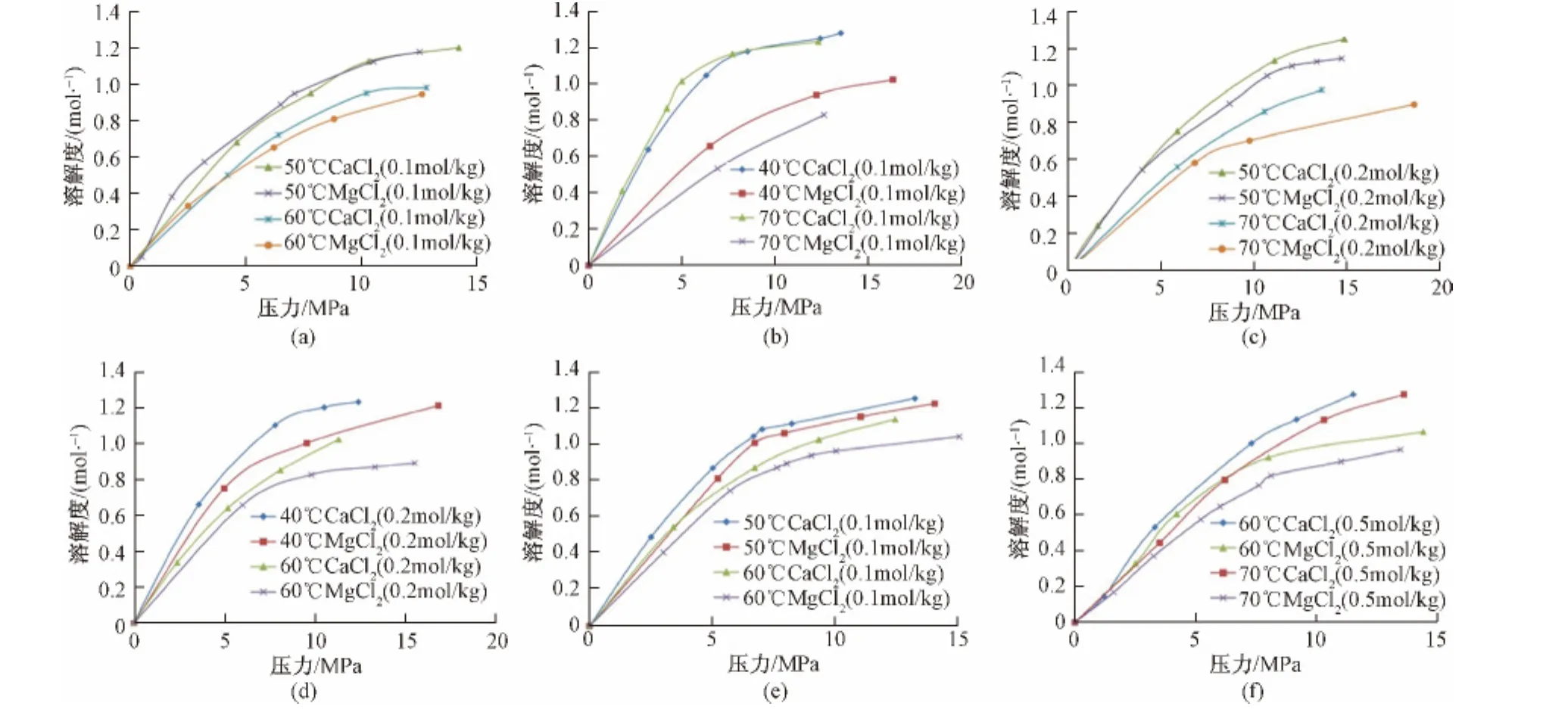
图4 不同温度和压力条件下MgCl2、CaCl2溶液中CO2溶解度对比Fig.4 Comparison of CO2 solubility of in MgCl2 and CaCl2solution
图5为MgCl2与CaCl2溶液中CO2溶解度的差值示意图。通过线性插值方法,可以利用已有的CaCl2中CO2溶解度数据计算在指定的温度和压力下CaCl2溶液中CO2的溶解度值,将该值与同等温度和压力下MgCl2溶液中CO2的溶解度值做差并对比,得到浓度为0.1 mol/L、0.2 mol/L和0.5 mol/L时,CaCl2相对于MgCl2对CO2溶解度影响趋势的柱状图。如图5所示,三种浓度的溶液中溶解度的差别依次增大。并且在离子浓度较小时,这种变化没有明显的规律,而随着离子浓度的增大,规律逐渐明显。在实验范围内,二者溶解度最大差值为18.53%。下面将分析系统达到溶解平衡后,温度,压力以及离子浓度对CO2溶解平衡的影响机理。

图5 CO2在CaCl2与MgCl2溶液中溶解度差值图Fig.5 Difference of the solubility of CO2 in aqueous CaCl2 and MgCl2solutions
为了较清楚地解释温度对溶解度的影响原理,可将溶液视为符合Henry定律的理想溶液。当系统达到平衡时:

式中:S——物质的熵/(kJ·kg-1·K-1);
X——物质在两相体系中的摩尔分数。
由式(13)所示,CO2溶解时的熵变量为其固有属性,若温度的变化范围不宽,气体溶解熵(Sl-Sg)可以看做一个常数。因此在其他条件不变时,温度是影响气体摩尔分数的唯一因素。
考虑压力对溶解度的影响。存在热力学关系如Krichevsky-Kasanovsy[12]方程所示:
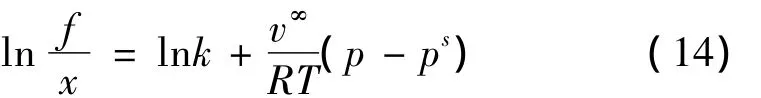
式中:f——物质的逸度/MPa,其与温度和压力的关系比较复杂,但是在本研究所考虑的温压范围内,可认为f变化不大。
X——物质在相应溶液中的摩尔分数;
v∞——气体在溶剂中的偏摩尔体积/(cm3·mol-1);
k——亨利常数/MPa。
由于k只依赖于温度以及CO2和H2O的属性,所以从等式右边看来,压力对溶解度的影响是依赖于温度的,温度越高的情况下,固定的压差所产生的溶解度差值也就越小。
离子浓度对溶解度的影响比较复杂。但可以类比于盐析现象。当离子溶于水时,会对水产生水化作用,也即离子的静电力破坏了原来的水分子结构,使其被极化。随着被极化的水分子增多,根据相似相容原理,非极性分子CO2便会从极性增强的溶液体系中逸出。在自由电子相同的情况下,如本研究中,不同离子具有的不同离子势(离子价态与离子半径的比值)影响了水的极化,进而影响着CO2-H2O相平衡,如Mg2+的离子势相比于Ca2+更大,所以极化力也就越大。不过研究表明[12],当离子加入体系内,有一部分交互作用区,在这个区域内(浓度非常小的时候),溶解度很难描述。
3 结论
(1)本研究建立了一套新的实验装置,改进了传统高温高压釜操作困难,重现性差,不得不舍去实验数据的缺点。为了验证新实验装置和方法的正确性,先测定了纯水中CO2的溶解度,并与文献值进行比较,所得实验值与文献实验值的绝对平均误差为3.53%,在实验允许误差范围之内(实验允许最大误差为7%)。
(2)设计实验测定了40~70℃,0~20 MPa下,0.1 mol/L、0.2 mol/L和0.5 mol/L CaCl2以及 MgCl2溶液中CO2的溶解度。分析了温度,压力以及离子浓度对溶解度的影响,以及三者的互相作用。通过对实验数据的对比分析,发现Ca2+和Mg2+对溶解度有不同程度的影响。在较低的浓度下(0.1 mol/L),CO2在不同溶液中的溶解度差别不明显,不过MgCl2在低浓度下对CO2溶解度的影响程度相对较大,具体体现为增加相同浓度的离子,MgCl2溶液中CO2溶解度会明显降低,而CaCl2溶液中CO2溶解度降低的趋势比较平缓。随着温度的和压力的升高,两种溶液中溶解度的差值逐渐增大,实验范围内二者最大差值为18.53%,当离子浓度较大时,不同离子溶液中的溶解度在较低的温度和压力条件下就能明显体现出差异。另外,随着CO2进入超临界状态,Ca2+对超临界CO2溶解度的影响普遍小于Mg2+。
(3)通过实验机理分析,对上述现象进行了理论解释。压力与温度对溶解度的影响是共同作用的,而离子浓度对溶解度的影响机理较为复杂,由于以往文献鲜有研究不同离子对CO2如果想要量化二者的影响程度,则需要进一步的研究论证。
[1] 郭朝斌,张可霓,鲁维丰,等.滞后现象对 CO2深部咸水层地质封存的影响[J].水文地质工程地质,2014,41(2):91-97.[GUO C B,ZHANG K N,LU W F,et al.Influence of hysteretic phenomena on the process of CO2injection into deep saline aquifers[J].Hydrogeology & Engineering Geology,2014,41(2):91-97.(in Chinese)]
[2] 卜繁婷,许天福,王福刚,等.储层温度对 CO2矿物封存的影响[J].水文地质工程地质,2014,41(1):101-105.[PU F T,XU T F,WANG F G,et al.The influence on CO2mineral sequestration of reservoir temperature[J]. Hydrogeology &Engineering Geology,2014,41(1):101-105.(in Chinese)]
[3] 张亮,任韶然,王瑞和,等.南海西部盐水层CO2埋存潜力评估[J].岩土力学,2010,31(4):1238-1242.[ZHANG L,REN S R,WANG R H,et al.Estimation of CO2storage capacity in saline aquifers in west ofSouth China Sea[J]. Rock and Soil Mechanics,2010, 31(4):1238-1242.(in Chinese)]
[4] Tong D L,Trusler J P M,Vega-Maza D.Solubility of CO2in aqueous solutions of CaCl2or MgCl2and in a synthetic formation brine at temperatures up to 423 K and pressures up to 40 MPa[J].Journal of Chemical and Engineering Data,2013,58(7):2116-2124.
[12] Mao S D,Zhang D H,Li Y Q,et al.An improved model for calculating CO2solubility in aqueous NaCl solutions and the application to CO2-H2O-NaCl fluid inclusions[J].Chemical Geology,2013,347:43-58.
[5] Ji X Y,Tan S P,Adidharma H,et al.SAFT1-RPM approximation extended to phase equilibria and densities of CO2-H2O and CO2-H2O-NaCl systems[J].Industrial and Engineering Chemistry Research,2005,44(22):8419-8427.
[6] Bamberger A,Sieder G,Maurer G.High-pressure(vapor+liquid)equilibrium in binary mixtures of(carbon dioxide + water or acetic acid)at temperatures from 313 to 353 K[J].Journal of Supercritical Fluids,2000,17(2):97-110.
[7] Bachu S,Bennion D B.Interfacial tension between CO2,freshwater,and brine in the range of pressure from(2 to 27)MPa,temperature from(20 to 125)C,and water salinity from(0 to 334 000)mg·L-1[J].Journal of Chemical& Engineering Data,2008,54(3):765-775.
[8] 万玉玉.鄂尔多斯盆地石千峰组咸水层CO2地质储存中的迁移转化特征[D].长春:吉林大学,2012.[WAN Y Y.Migration and transformation of CO2in CO2geological sequestration Process of saline aquifers in Orods Basion[D].Changchun:Jilin University,2012.(in Chinese)]
[9] Akira Y,Fumitake Y.Solubility of carbon dioxide in aqueous electrolyte solutions[J].Journal of Chemical and Engineering Data,1979,24(1):11-14.
[10] Carroll J J,Mather A E.The system carbon dioxidewater and the Krichevsky-Kasarnovsky equation[J].Journal of Solution Chemistry,1992,21(7):607-621.
[11] Yan W,Huang S L,Stenby E H.Measurement and modeling of CO2solubility in NaCl brine and CO2-saturated NaCl brine density[J].International Journal of Greenhouse Gas Control,2011,5(6):1460-1477.
[12] Peng D Y,Robinson D B.A new two-constant equation of state[J].Industrial and Engineering Chemistry Fundamentals,1976,15(1):59-64.
[13] Duan Z H,Sun R,Chen Z,et al.An improved model for the calculation of CO2 solubility in aqueous solutions containing Na+,K+,Ca2+,Mg2+,Cl-,and SO24-[J].Marine Chemistry,2006,98(2/4):131-139.
[14] Bamberger A,Sieder G,Maurer G.High-pressure(vapor+liquid)equilibrium in binary mixtures of(carbon dioxide + water or acetic acid)at temperatures from 313 to 353 K[J].Journal of Supercritical Fluids,2000,17(2):97-110.
[15] Liu Y H,Hou M Q,Yang G,et al.Solubility of CO2in aqueous solutions of NaCl,KCl,CaCl2and their mixed salts at different temperatures and pressures[J].The Journal of Supercritical Fluids,2011,56(2):125-129.
