小鼠FAM3C基因重组腺病毒载体的构建及其在肾系膜细胞中的表达
2015-12-16樊守艳王杨张晓燕王继浩
樊守艳 王杨 张晓燕 韦 祎 王继浩*
(1.海南医学院生理学教研室 海南海口 571199;2.北京大学医学部生理及病理生理学系 北京 100191;3.海南医学院中医学院 海南海口 571199)
FAM3(family with sequence similarity 3)家族是通过计算机模型在基因库中搜索含四螺旋束结构的细胞因子时发现的一组新的细胞因子家族,共有4个家族成员:FAM3A,FAM3B,FAM3C和FAM3D,各编码一含224-235氨基酸的多肽。人FAM3C基因定位于7号染色体(7q31)[1]。小鼠FAM3C 基因长度约为50kb,位于染色体6A3.1,含有10个外显子和9个内含子。人和小鼠FAM3C基因的启动子区域存在包括Nkx5.1、Sp1、Ap1、Ap2和GCbox在内的多个转录因子的结合位点,存在含有2个保守的甘氨酸残基的结构域(GGdomain)[2]。
FAM3C为白细胞介素样上皮间质转化诱导因子(interleukinlike epithelial-mesenChymal transition induCer ,ILEI),已被证明是参与上皮间质转化和肿瘤发生的重要细胞因子[3],广泛表达于多种组织,在多种临床疾病中发挥重要作用。研究表明,FAM3C在胚胎内耳细胞变异和增殖,脊椎动物视网膜的形成进程中起到重要的作用,在癫痫、肝癌的发病中也具有非常重要的意义。本研究建立了高效表达FAM3C基因的病毒表达系统,为进一步探讨FAM3C在各组织器官中的作用提供重要的研究工具。
1 材料与方法
1.1 材料
p A d E a s y-1腺病毒骨架质粒、含有绿色荧光蛋白标记pAdTrack-CMV穿梭质粒购自德国Merck公司。大肠杆菌JM109及BJ5183由本实验室保存。TaqDNA聚合酶、BglⅡ、PmeI、PacI、NotI以及脱氧核糖核酸(DNA)等酶购自TaKaRa公司。核糖核酸(RNA)抽提试剂盒购自武汉博士的生物试剂公司。引物由北京华大基因研究中心合成。人胚肾细胞系HEK293由本实验室保存。KM小鼠由北京大学医学部动物中心提供。
1.2 方法
1.2.1 引物设计及模板的制备
根据 GenBank中小鼠FAM3C基因序列(NM-IL216CDNA)设计一对F A M 3 C基因引物。引物序列为:上游引物5′-CGGGAGCGGCCG CTGGAGAC-3′;下游引物5′-AAGCAAGAGCGGCCGCAAG-3′。扩增产物的长度约707bp,划线部分为NotI的酶切位点。取KM小鼠5只(20-25g),腹部用75%酒精消毒后,切开取两侧肾脏,放入EP管中,并迅速投入液氮罐中保存,用试剂盒提取RNA,用分光光度计测试其浓度并逆转录为cDNA。采用上下游引物,以小鼠肾脏 cDNA 作为模板进行PCR扩增,采用五个退火温度梯度:57℃, 58℃, 59℃, 60℃, 61℃。RTPCR显示,其最佳退火温度为57oC。琼脂糖凝胶电泳鉴定,凝胶回收,纯化目的基因。
1.2.2 骨架质粒的构建
用限制性内切酶NotI切开骨架载体pEASY-1,用T3连接酶连入凝胶回收纯化的FAM3C,构建重组克隆质粒pEASY-T3-FAM3C。连接产物转化至大肠杆菌ColiJM109 Trans1-T1感受态细胞中,铺板(含氨苄青霉素抗性的LB培养板),37℃孵育过夜。挑取大而饱满的克隆,入氨苄LB培养液中,摇菌13h。BglII酶切,琼脂糖凝胶电泳鉴定,并送奥科公司测序。

图1 构建重组腺病毒过程
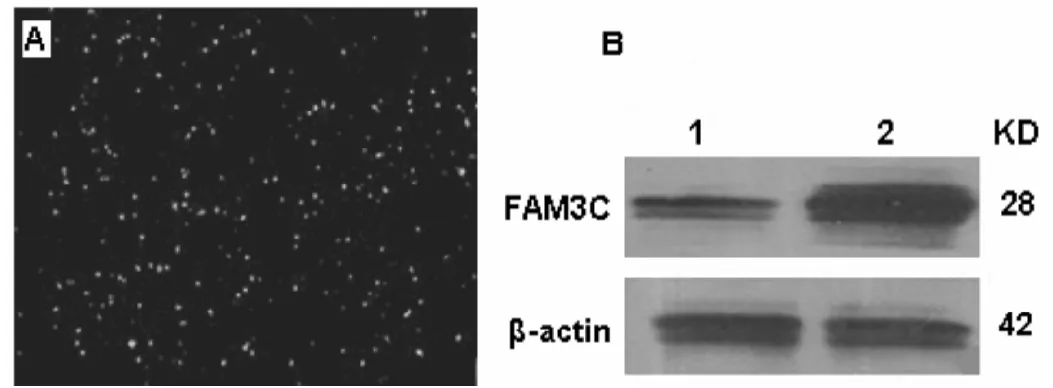
图2 pAd-FAM3C感染HEK293细胞
1.2.3 穿梭质粒的构建
用NotI酶切pEASY-T3-FAM3C载体, 获得的目的基因片段,去磷酸化处理后的pAdTraCk-CMV,采用NotI酶切,T4连接酶连接,构建重组腺病毒穿梭质粒pAdTraCk-CMV-FAM3C。连接体系转化至感受态细胞Trans5a,并铺板过夜。挑全部单克隆菌落,摇菌过夜,使其浓度达到OD600=0.5。菌液PCR鉴定,提取质粒。经BglⅡ酶切鉴定,酶切后产物凝胶电泳鉴定,并将提取质粒送奥科公司测序。由于使用的是单酶切,需要鉴定连接方向。使用克隆全长时的引物序列进行测序,用Han-DNAMAN6.0软件分析,选择连接方向正确的产物。
1.2.4 重组腺病毒载体Ad-FAM3C的构建
PmeI酶切重组pAdTraCk-CMV-FAM3C,进行线性化处理,酚-氯仿-异戊醇抽提。取50ul BJ5183-pAdEasy-1 与5ul PmeIPtraCk-Cmw-Peasy-T3-FAM3C,在2500V,200 Ohms,25miCro-FS,时间4.4S条件下,电穿孔共转化 BJ5183感受态菌。将产物放入1mlLB 溶液中并移取200 ul分别铺入四个培养皿中,37℃ ,24h。选取阳性克隆入含有氨苄青霉素的LB 溶液中,扩增并提取质粒, PaCI酶切鉴定重组质粒,琼脂糖凝胶电泳分析酶切图谱,证实FAM3C基因正确重组入腺病毒载体,将阳性克隆转化至DH5α中进行大量扩增,抽提制备大量Ad-FAM3C DNA。
1.2.5 重组腺病毒 Ad-FAM3C的包装及扩增
PaCI酶切质粒过夜,琼脂糖凝胶电泳确定酶切完全,定量测定线性DNA浓度。异丙醇沉淀回收线性化DNA。按阳离子脂质体转染lipofeCtamine 2000 4ul加DNA 2ug,加入60%覆盖率HEK293细胞中,37OC,培养细胞7天,显微镜下观察细胞全部变圆漂起,荧光显微镜下观察,细胞内显绿色荧光,收集上清和细胞,反复冻融3次,裂解细胞释放病毒,以病毒悬液为模板,用 PCR 检测其中是否含有FAM3C片段。将鉴定好的腺病毒感染 HEK293细胞。5天出现细胞病变效应 (CytopathiC effeCt,CPE),待大部分出现 CPE后,收集上清和细胞。用 IC50组织半感染法测定所获得病毒的滴度。
1.2.6 Western blot检测重组腺病毒介导的FAM3C蛋白的表达
以感染浓度为7 5 MOI的重组腺病毒感染小鼠肾系膜细胞(Mouse glomerular mesangial Cells,MMCs),24h后用蛋白裂解液于冰上裂解细胞,把细胞连同液体一起吸出入,超声处理,4℃高速离心收集上清。测定蛋白浓度,算出相应的总蛋白含量。将定量后的蛋白裂解液加上样缓冲液处理,SDS-PAGE电泳后转移到PVDF膜上,以兔抗小鼠FAM3C的抗体作为一抗(使用浓度1:800),以HRP标记的羊抗兔的抗体为二抗(使用浓度1:4000),采用Western blot法检测重组腺病毒介导的FAM3C蛋白在小鼠肾脏系膜细胞中的表达。
2 结果
2.1 重组腺病毒的构建过程
琼脂糖凝胶电泳鉴定,利用引物,PCR 扩增得到全长为707bp的 FAM3C目的基因片段(图1-A)。BglⅡ单酶切后,有两条电泳条带,一条337pb为正向连接,另一条4500 bp,为pEASY-1载体,序列分析结果显示,小鼠 FAM3C基因已经成功克隆入pEASY-1载体内(图1-B)。PacI酶切后,得到两条电泳条带,一条为FAM3C的DNA条带,约707bp; 一条为pAdTrack-CMV载体,约4500bp, 质粒测序,经Han-DNAMAN6.0软件分析序列正确。表明携带目的基因的穿梭质粒已经整合到腺病毒的基因组中(图1-C),重组腺病毒质粒构建成功。
2.2 重组腺病毒的包装及其在肾小球系膜细胞中的鉴定
经线性化处理的重组腺病毒质粒以Li-pofeCtamine 2000脂质体转染60%贴壁的HEK293细胞。荧光显微镜下观察,显示绿色荧光,第7天出现细胞病变(CytopathiC effeCts,CPE),表现为贴壁细胞变圆、变大,核浓缩和成串脱落,出现病毒空斑(图2-A),收集细胞。于-80℃及室温反复冻融3次裂解细胞, 离心后收集含病毒的上清。用75MOI的重组腺病毒Ad-FAM3C感染小鼠肾小球系膜细胞(MMCs),以不感染FAM3C重组腺病毒的细胞作为阴性对照。病毒感染48h后,收集蛋白,进行Western blot检测。结果显示,重组腺病毒介导的FAM3C基因在肾小球系膜中高效表达。而对照组细胞内仅检测到少量FAM3C蛋白的表达(图2-B)。由此证明构建的FAM3C病毒能够在宿主细胞肾系膜中高效表达 FAM3C。
3 讨论
FAM3家族是一个新的细胞因子家族,对该家族成员的研究刚刚起步[4]。对FAM3C的研究报道,主要集中于FAM3C基因定位,分子结构,表达和分泌的调节以及F AM3 C与肝癌的关系,目前FAM3C的生物学功能尚不清楚[5]。
有研究通过原位杂交的方法揭示,第15.5天小鼠胚胎内耳半规管的非感觉内皮中,存在FAM3C的优势表达,并且这种表达形式类似于我们已知的Nkx5.1同源基因。由于Nkx5.1在半规管发育中起重要作用,通过分析启动子区域,推测FAM3C是Nkx5.1转录因子的下游靶基因,并且在胚胎内耳细胞变异和增殖中起到非常重要的作用[6]。研究发现,FAM3C在视网膜细胞中高度表达,尤其是视网膜神经节细胞层。缺失FAM3C,则可导致视网膜光感受细胞缺失。而细胞层的不同不会影响FAM3C的功能。证明FAM3C关系到脊椎动物视网膜的形成进程[7]。资料表明通过蛋白组学研究颞叶性癫痫时,对脑脊液进行二维电泳和高效液相色谱-电子质谱分析,发现病人FAM3C表达显著降低,提示在该基因在癫痫的发病中具有一定作用,可作为癫痫病治疗的可能作用靶点[8]。Lahsnig等[9]研究表明,FAM3C可诱导上皮细胞向间叶细胞转化,过度表达原癌基因从而在肝癌的发生中起着重要作用。实验通过诱发永生化肝细胞上皮细胞恶性转化模型,通过显性失活的方法,发现FAM3C联合原癌基因Ras过表达可导致非转化生长因子(TGF)依赖性上皮细胞向间叶细胞转化,其作用通过PDGF(血小板源性生长因子)-R/β-Catenin and PDGF-R/Stat3 信号通路。并认为FAM3C可能取代转化生长因子(TGF-β)而成为恶性肿瘤发生的信号。而这一作用机制表明,FAM3C与非酒精性脂肪肝的发病也密切相关[10]。
本研究首先从小鼠肝脏中克隆出 FAM3C cDNA,利用不同的酶切位点再将FAM3C克隆至pAdEasy骨架载体上,构建重组腺病毒质粒p A d E a s y-F A M 3 C。经酶切后将其克隆至重组pAdTrack-CMV穿梭质粒中。经鉴定后反复转染 HEK 293细胞,进行重组腺病毒载体的包装及扩增。经检测病毒滴度后感染小鼠肾小球系膜细胞。pAdEasy-FAM3C自身携带绿色荧光蛋白基因,荧光显微镜观察到转染细胞胞浆和胞核内均有特异性绿色的荧光蛋白的表达,以Western blot法证实FAM3C在小鼠肾系膜细胞中的高表达。本实验为FAM3C的基础性研究,为进一步阐明FAM3C的功能及作用机制,探讨其病理生理意义起着重要的作用。
[1]Yang J, Guan Y, “Family with sequence similarity 3 gene family and nonalcoholic fatty liver disease,” Gastroenterol Hepatol. vol. 28, pp. 105- 111, Jan 2013.
[2]Jinhu Guo, Haipeng Cheng, Shouyuan Zhao, et al, “GG: A domain involved in phage LTF apparatus and implicated in human MEB and non-syndromic hearing loss diseases,” FEBS Letters. Vol. 580, pp. 581-584, Jan 2006.
[3]Johansson P, Bemstrom J, Gorman T, et al, “FAM3B PANDER and FAM3C ILEI represent a distinct class of signaling molecules with a non-cytokine-like fold,” Cell. Vol. 21, pp. 306-313, Feb 2013.
[4]Gao ZH, Lu C, Wang ZN, Song YX, “ILEI:a novel marker for epithelial-mesenchymal transition and poor prognosis in colorectal cancer,” Histopathology. vol. 65, pp. 527-538, Oct 2014.
[5]Zhang L, Choi HJ, Estrada K, et al, “Multistage genomewide association meta-analyses identified two new loci for bone mineral density,” Human molecular genetics. Vol. 23,pp.1923-1933, Apr 2014.
[6]Valentina V Pilipenko, Alisa Reecea, Daniel I Chooa, “Genomic organization and expression analysis of the murine Fam3C gene,” Gene. Vol. 23, pp. 159-168, Oct 2004.
[7]Tatsuya Katahira, Shiho Nakagiri, Koji Terada, “SeCreted factor FAM3C (ILEI) is involved in retinal laminar formation,”Biochemical and Biophysical Research Communicatio. Vol.392,pp. 301-306, Mar 2010.
[8]Fei Xiao, Dan Chen, Yang Lu, “Proteomic analysis of cerebrospinal fluid from patients with idiopathic temporal lobe epilepsy,” ELSEVIER. Vol . 55, pp. 180-189, Dec 2009.
[9]Lahsnig, M Mikula, M Petz, “ILEI requires oncogenic Ras for the epithelial to mesenchymal transition of hepatocytes and liver carcinoma progression,” Biochemical and Biophysical Research Communicatio. Vol. 28, pp. 638-650, May 2009.
[10]Yang J,Guan Y, “Family with sequence similarity 3 gene family and nonalcoholic fatty liver disease,” Journal of gastroenterology and hepatology. vol. 28, pp. 1105-1111, Aug 2013.