安太堡露天矿植被恢复过程中土壤生态肥力评价
2015-12-16李晋川岳建英王宇宏郭春燕杨生权
李晋川,王 翔,岳建英,王宇宏,郭春燕,卢 宁,杨生权
(山西省生物研究所,太原030006)
露天采矿对土地带来的直接破坏是一个十分严重且日益受到高度重视的问题[1]。平朔露天矿区地处黄土高原东部,属黄土丘陵强烈侵蚀生态脆弱系统[2]。该区是我国生态最脆弱、水土流失最严重的地区之一。在此地区进行大规模的露天开采,更加剧了水土流失。恢复和重建业已退化的生态系统,维持人类生存环境的稳定和持续发展是现代生态学研究的重要课题。矿区土地复垦与生态重建已成为解决人地矛盾、改善生态环境的一项重要措施,同时也是露天采矿企业可持续发展的保障[3]。
目前,在矿山植被恢复方面很多研究取得了较好的经济与环境效益,如山西省生物研究所黄土高原露天煤矿矿区生态的恢复工艺技术研究、内蒙古农业大学草原露天煤矿矿区的生态恢复和植被恢复工作以及中科院沈阳生态所土壤基质改良等研究[4]。目前国内对于矿区生态恢复的研究工作主要集中在植被的恢复、土壤的 改 良 等 方 面[5-8]。 李 晋 川 等[9]的 研 究表明:在已有二十余年安太堡煤矿废弃地复垦的植被研究中,选择豆科牧草作为先锋植物,以草灌乔复合种植,既可增加植被控制水蚀、风蚀等危害的作用,又同时保证了重建后生态系统的稳定,有利于矿区生产的可持续性发展。也有学者研究认为沙棘、刺槐等植物可以作为排土场的优良生态恢复植被物种,并应结合排土场的特点来选择复垦最优方式[10]。目前对于不同植被恢复模式对土壤质量影响的研究更多局限于碳氮等理化指标,而对于露天矿区不同植被恢复模式的土壤生态恢复效果进行生物学质量的综合评价尚无报道。土壤生态肥力是指在一定环境条件下,土壤及其生物群落(包括动物和微生物)之间长期协同进化、相互适应、相互作用而表现出的一种和谐共融特性,以及在该特性状态下土壤保证植物生长所需物质与能量的可获得性和可持续性的一种功能与能力[11]。而土壤肥力是土壤质量的重要组成部分,是林地生产力的基础[12]。因此,本文以安太堡露天矿复垦地不同植被恢复模式为研究对象,对植被恢复过程中土壤碳氮等理化性质、酶活性和微生物多样性等指标进行测定,分析植被恢复对土壤生态系统影响,为评价植被恢复效果和种植模式筛选提供依据。
1 材料与方法
1.1 研究区概况
平朔矿区地处黄土高原晋陕蒙接壤的黑三角地带,山西省北部朔州市境内,地理坐标:东经112°11′—113°30′,北纬39°23′—39°37′[13]。平朔矿区属于典型的温带半干旱大陆型季风气候区,冬春干旱少雨、寒冷、多风,夏秋降水集中、温凉少风。矿区年平均气温4.8~7.8℃,最高温度为37.9℃,最低温度为-37.4℃,日温差为18~25℃。无霜期约115~130d。平朔矿区地带性土壤为栗钙土与栗褐土的过渡带,矿区地带性植被类型属于草原,目前总体上呈农业耕作景观[2]。
1.2 采样方法
供试土壤采自朔州市平鲁区安太堡露天矿复垦地,采样地分别为刺槐林地(1992年种植,CH)、油松—刺槐—柠条混交林(1992年种植,YCN)和油松—刺槐混交林(1992年种植,YC)。采样地点具体信息见表1。在距植被50cm的地方按照S型多点采集土样,取样深度分别为0—10cm和10—20cm。各样地内取5个重复,将土壤样品带回实验室,除去石块与植物残体,分成两部分。一部分于4℃下储存,用于土壤含水量、细菌、真菌、固氮菌、硝化细菌和反硝化细菌数量测定以及细菌、真菌多样性检测;另一部分风干后过筛,充分混匀后储藏,用于土壤pH、有机碳、全氮和碱解氮含量以及蔗糖酶、脲酶、过氧化氢酶和多酚氧化酶活性测定。采样时间为2010年10月。
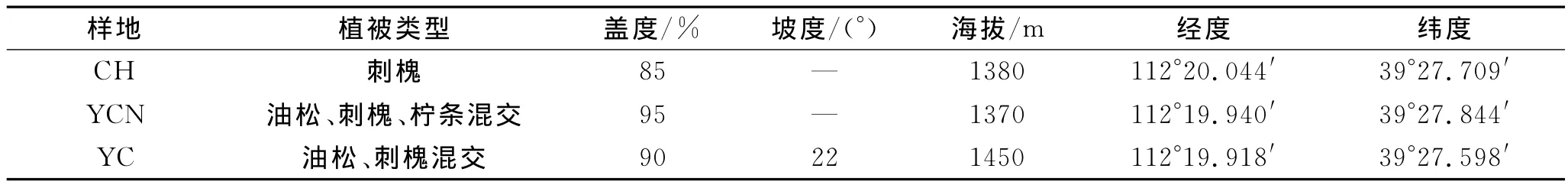
表1 样地基本特征
1.3 测定项目与方法
土壤酸碱度的测定采用电位法,含水量的测定使用烘干法。土壤有机碳采用重铬酸钾氧化法、全氮采用凯氏法、碱解氮采用碱解扩散法[14]。蔗糖酶的测定采用硫代硫酸钠滴定法,脲酶的测定采用苯酚钠比色法,过氧化氢酶的测定采用高锰酸钾滴定法,多酚氧化酶的测定采用邻苯三酚比色法[15]。土壤微生物主要类群数量的测定采用稀释涂布平板法[16],其中细菌:牛肉膏蛋白胨培养基;真菌:马丁氏培养基;自生固氮菌:阿须贝无氮培养基;硝化细菌:硝化细菌培养基;反硝化细菌:反硝化细菌培养基。
使用美国 Mo-Bio的土壤DNA提取试剂盒(power soil DNA kit)提取土壤微生物总 DNA。提取产物用1%琼脂糖电泳检测。用Bio-Rad(伯乐)公司的C1000-Touch型PCR仪,采用细菌通用引物(338—GC 5′—CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGG GCCTACGGGAGGCAGCAG—3′,518R5′—ATTACCGCGGCTGGT-GG—3′)扩增土壤中总细菌。采用50μl的反应体系,其中5μl的10×Buffer,4μl的dNTP(2.5mM)、1U Taq酶、引物量各10pmol,DNA模板量10ng。细菌的16SrDNA使用Touchdown法进行扩增,程序是94℃预变性5min;94℃下1min,65℃下1min,72℃3min(退火温度每循环降0.5℃,共20个循环,降至55℃);94℃下1min,55℃下1min,72℃3min(共10个循环);72℃终延伸10min[17]。
采用真菌18SrDNA通用引物(NS15′—GTAGTCATATGCTTGTCTC —3′GC-Fang 5′—CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCC CCGCCCCATTCCCCGTTACCCGTTG—3′)扩增土壤中总真菌。采用50μl的反应体系,其中5μl的10×Buffer,4μl的dNTP(2.5mM)、1U的Taq酶、引物量各10pmol,DNA模板量10ng。真菌18SrDNA的扩增程序是94℃预变性3min;94℃下1min,50℃下1 min,72℃3min(共40个循环);72℃终延伸10min[18]。
变性梯度凝胶电泳使用Bio-Rad基因突变仪,使用10%聚丙烯酰胺凝胶,制胶和电泳缓冲液为1×TAE,浓度梯度为30%~60%(7mol/L尿素和40%去离子甲酰胺为100%变性),电泳电压120V,时间8h,用SYB greenⅡ(1∶10 000,体积比)染色1h。Bio-Rad公司Versa DOC仪器系统下成像,Quantaty one 4.6.2软件对DGGE图谱进行分析。使用Shannon-Weiner指数和Simpson′s diversity指数来表示土壤微生物群落多样性,计算公式为:

式中:H——香农—威纳指数;D——辛普森多样性指数;EH——均匀度指数;Pi——样品的多度值;S——每个样品中的电泳条带数目。
1.4 土壤生物学肥力的评价方法
应用多元统计分析方法,以各主成分特征值贡献率为权重,加权计算各样地土壤生物学肥力指标值,以评价各样地土壤的生态肥力特征[12,19-20]。
使有机碳、全氮、碱解氮、蔗糖酶、脲酶、过氧化氢酶、多酚氧化酶、细菌、真菌、固氮菌、硝化细菌、反硝化细菌依次为X1—X12,将数据进行标准化处理后,经过主成分分析,得到变量,计算得分系数,进而依据IFI公式得出不同样地的IFI值。
1.5 数据处理
采用 Excel 2003与SPSS 19.0对数据进行统计分析和计算。
2 结果与分析
2.1 不同植被恢复模式对土壤理化性质的影响
在不同的植被恢复模式下土壤有机碳、全氮、C/N,碱解氮的含量变化见表2,表层土壤中有机碳含量YC最高,且显著高于CH和YCN。下层土壤中三种模式间差异显著,其中YC含量最高。而土壤全氮含量和C/N在三种样地间也表现出相同变化趋势。与此同时,土壤碱解氮含量变化表现为表层土壤YC和YCN显著高于CH,但前两者之间无显著差异;下层土壤也表现出相同变化趋势。
2.2 不同植被恢复模式对土壤酶活性的影响
不同的植被恢复模式土壤酶的活性不同(表3)。从表层土壤来看三种恢复模式之间蔗糖酶活性无显著差异,但在下层土壤中YC的酶活性显著高于其它模式。脲酶的变化趋势与蔗糖酶不同,表层土壤中YC的酶活性显著高于CH和YCN,后二者间无显著差异;下层土壤表现出相同趋势。过氧化氢酶活性与土壤微生物的活动有关,在上层土壤中三种恢复模式间差异显著,其中YC最高,YCN最低;但在下层土壤中三种模式间无显著差异。多酚氧化酶通常被认为与土壤的腐殖化程度有关,其中在表层土壤YCN显著低于YC和CH,后二者间无显著差异;下层土壤也呈相同规律。
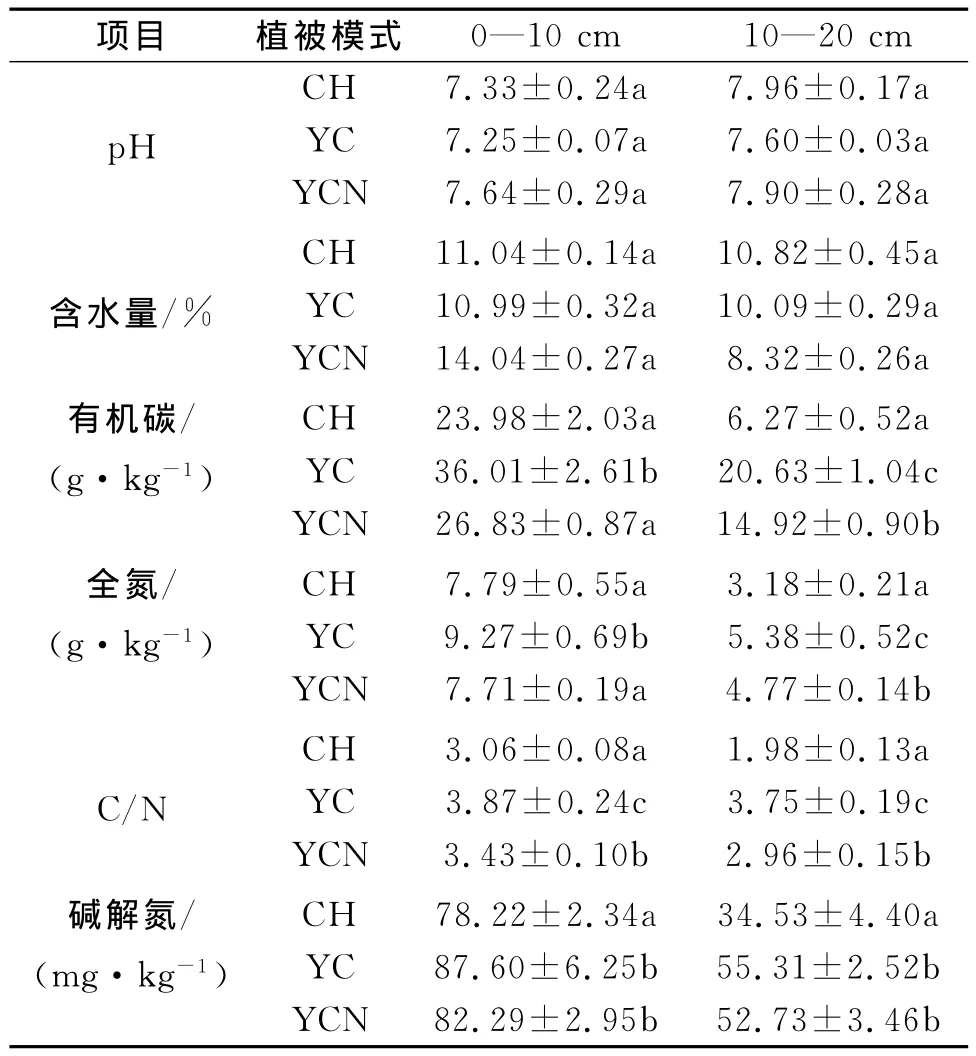
表2 不同样地的土壤理化性质
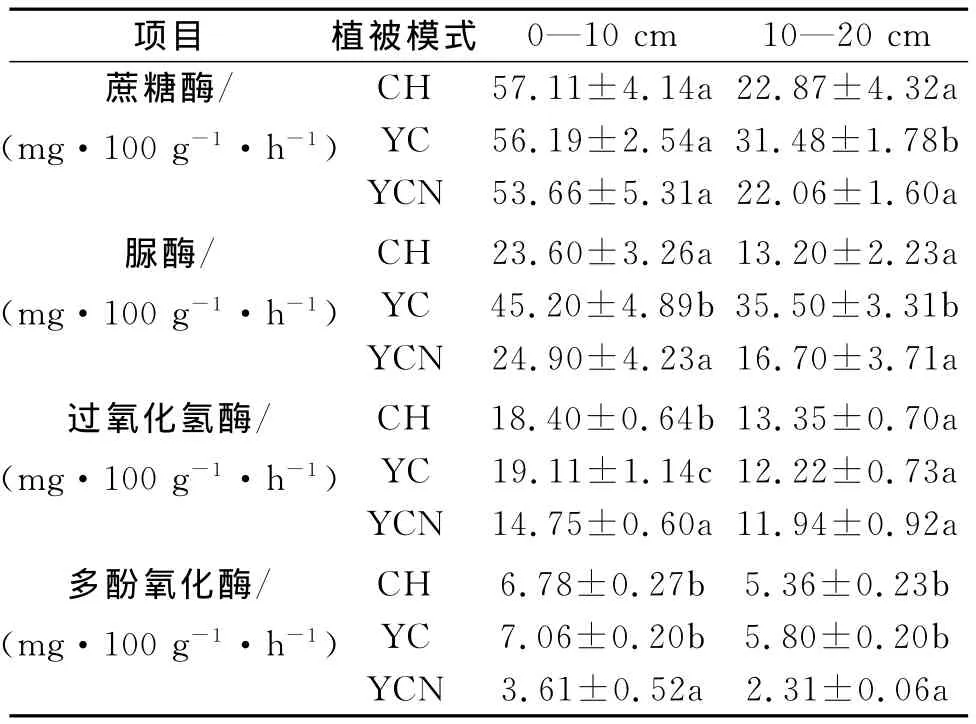
表3 不同样地的土壤酶活性
2.3 不同植被恢复模式对土壤微生物数量的影响
对安太堡露天矿不同植被恢复模式土壤微生物数量分析表明,表层土壤中YC的细菌数量显著高于CH和YCN,后二者间无显著差异;在下层土壤中三种模式差异显著,其中YC最高,CH最低。真菌数量表现出不同的变化规律,上层土壤YCN显著高于其它模式,下层土壤不同样地间均无显著差异。固氮菌和反硝化细菌在上层土壤中变化规律相同,不同植被模式间均无显著差异;在下层土壤中固氮菌数量表现为CH显著低于YC和YCN,反硝化细菌数量则是YC显著高于CH和YCN。同时,CH和YCN的硝化细菌数量显著高于YC且二者间无显著差异,下层土壤则均无显著差异(表4)。
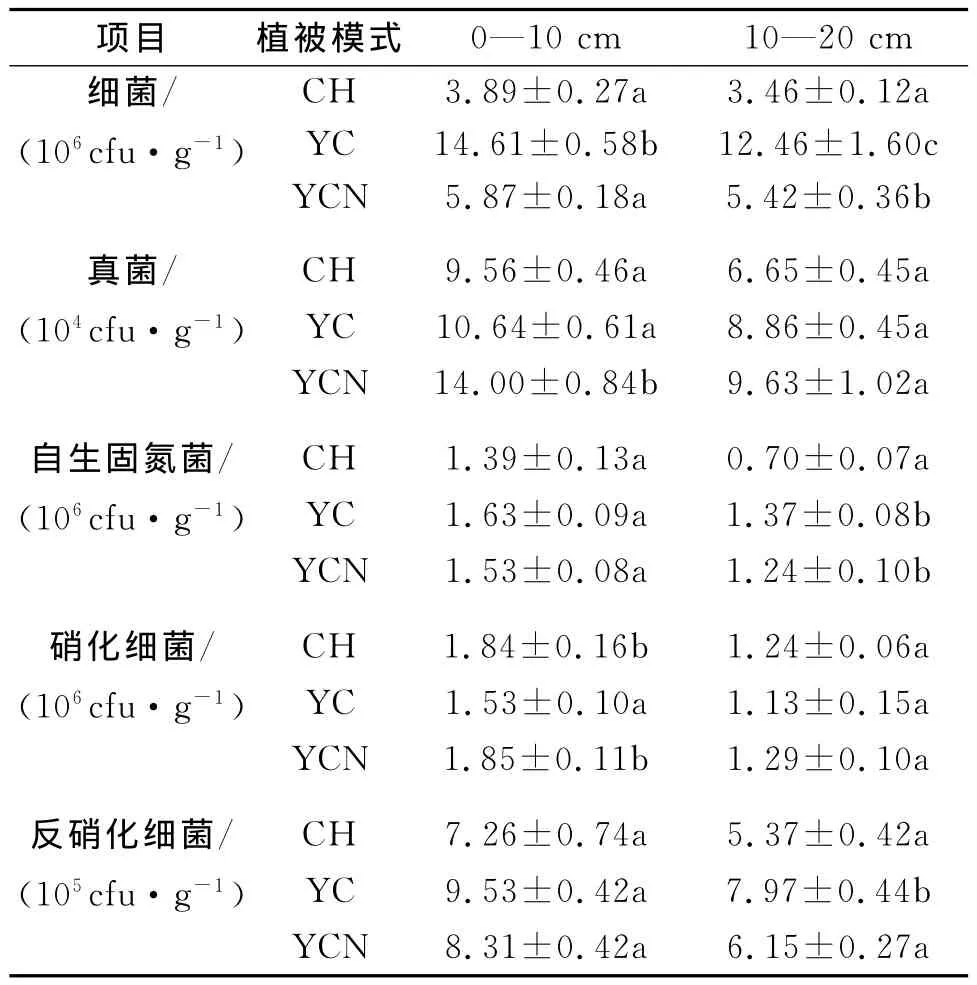
表4 不同样地的土壤微生物数量
2.4 不同植被恢复模式对土壤微生物群落多样性的影响
16SrDNA扩增的DGGE条带的图像分析表明(图1A),在3个样地中共有5个优势细菌DNA条带,条带的数量在5~7之间变化,说明不同的植被恢复模式影响细菌的多样性和结构。在CH中条带数最少,只有5条,分别是A、B、C、D、E,并且这五个条带在所有样地中均有出现,说明这些细菌为该类型土壤中常见类型,并且广泛分布。可以看到YCN的条带数增加到了6条,即具有新的条带F。YC的条带数为7条,即增加了G、H,可见细菌的群落多样性显著不同。
18SrDNA扩增的DGGE条带图像分析表明(图2B),在3个样地中共有6个优势DNA条带,条带数量在7~9之间变化,反映出不同的植被恢复模式影响真菌的群落多样性。在CH中,条带数最少,只有7条,分别是A、B、C、D、E、F、K,并且除K之外,其余条带在所有样地均有出现,说明这些真菌为该类型土壤中常见种类。还可以看到YC条带数增加到了9条,即具有新的条带G、L、M、YCN的条带数为9条,增加了新的条带H、I,可见植被恢复对真菌群落多样性影响不同。
同时,不同植被恢复模式土壤中细菌、真菌的群落多样性通过多样性指数反映出来,由表5可见,细菌的群落多样性从香农指数和辛普森指数来看均表现为YC最高,真菌的群落多样性从香农指数和辛普森指数来看均表现为YCN最高。此外,三种样地的细菌、真菌群落多样性均匀度指数较为接近。
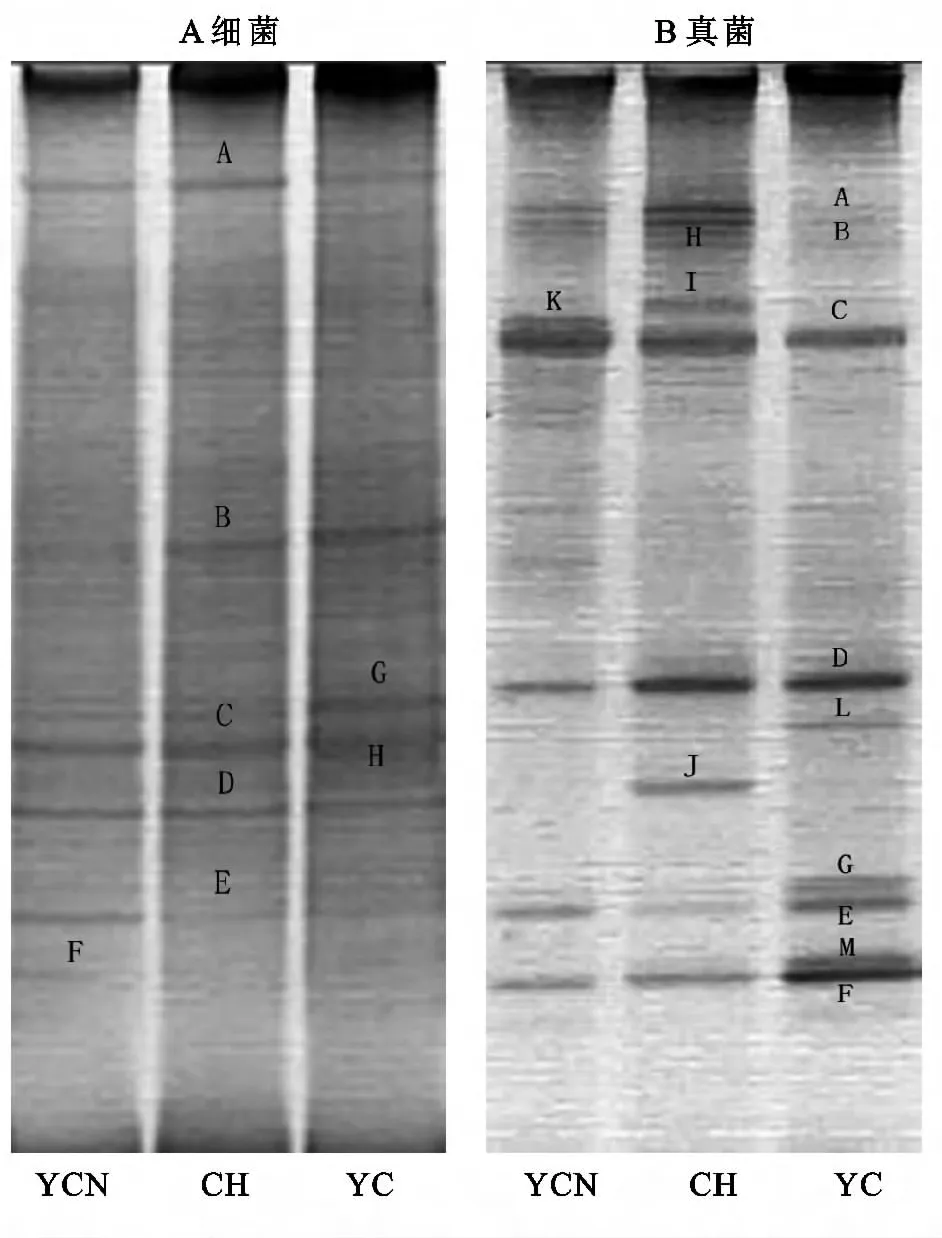
图1 不同样地土壤细菌、真菌的DGGE图谱

表5 不同样地土壤细菌、真菌的多样性指数
2.5 不同植被恢复模式土壤生物学肥力评价
为了全面反映土壤的生物学活性,需要进一步分析土壤各个生物学指标与土壤生物学肥力的关系,在前人研究方法基础上,使用主成分的分析方法评价各植被模式下的土壤生物学肥力高低。使用X1,X2…X12分别代表有机碳、全氮、碱解氮、蔗糖酶、脲酶、过氧化氢酶、多酚氧化酶、细菌、真菌、固氮菌、硝化细菌、反硝化细菌。
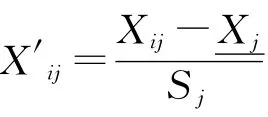
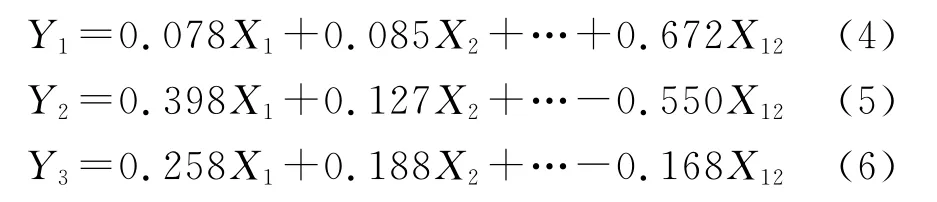
各主成分的因子得分见表6。可以看出,第一主成分Y1主要反映了有机碳、全氮、碱解氮、蔗糖酶、细菌、真菌、固氮菌、硝化细菌、反硝化细菌等指标的综合变量,对土壤生物学肥力评价十分重要。第二主成分Y2主要反映了蔗糖酶、脲酶、过氧化氢酶、多酚氧化酶等指标的综合变量,对土壤生物学肥力评价具有一定作用。第三主成分Y3主要反映了固氮菌、碱解氮、硝化细菌等指标的综合变量,对土壤生物学肥力评价具有一定作用,但影响较小。
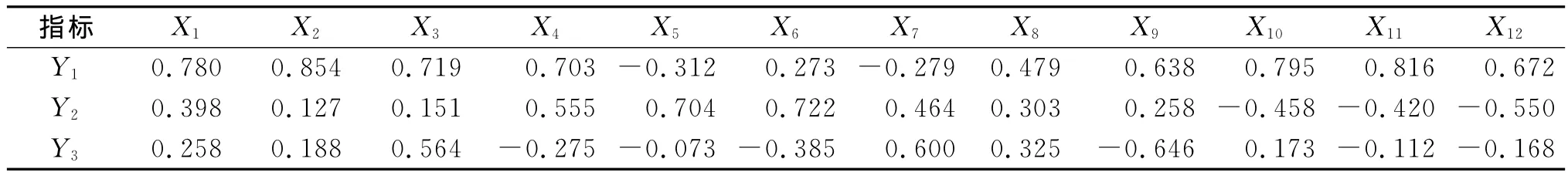
表6 土壤生物学指标主成分因子得分系数矩阵

由表7可见,不同植被恢复模式土壤生物学指标综合评价得分值(IFI)不同。依据其得分多少进行排序,可知表层土壤YC>CH>YCN;下层土壤YC>YCN>CH。可以看到,不同植被恢复模式的土壤生物学性状具有明显差异,并且表现出表层土壤高于下层土壤的趋势。其中YC土壤生物学性状最优。
2.6 土壤理化性质、土壤酶活性与土壤微生物数量的相关性
通过对复垦地土壤理化性质、土壤酶活性和土壤微生物数量相关性分析表明,三类指标均存在相关关系,但相关程度有所不同(表8)。pH与蔗糖酶显著负相关;有机碳与全氮、C/N、碱解氮极显著正相关,与蔗糖酶显著正相关,与脲酶、多酚氧化酶极显著负相关;全氮与C/N、碱解氮、脲酶、真菌极显著正相关,与蔗糖酶、自生固氮菌显著正相关,与多酚氧化酶极显著负相关;C/N与碱解氮极显著正相关,与蔗糖酶显著正相关,与脲酶、多酚氧化酶极显著负相关;碱解氮与多酚氧化酶极显著负相关,与脲酶、过氧化氢酶、反硝化细菌显著负相关;蔗糖酶与细菌、硝化细菌极显著正相关,与真菌、自生固氮菌显著正相关,与多酚氧化酶极显著负相关,与脲酶显著负相关;脲酶与多酚氧化酶极显著正相关;过氧化氢酶与反硝化细菌极显著正相关,与真菌显著正相关;多酚氧化酶与细菌极显著负相关,与真菌、自生固氮菌显著负相关;细菌与真菌、自生固氮菌、硝化细菌、反硝化细菌极显著正相关;真菌与自生固氮菌、硝化细菌、反硝化细菌极显著正相关;自生固氮菌与硝化细菌、反硝化细菌极显著正相关;硝化细菌与反硝化细菌极显著正相关。土壤理化性质与酶活性相关性较强,可能是土壤酶参与促进土壤物质代谢与转化,而土壤酶与微生物相关密切,可能与土壤酶大部分来源于微生物有关。
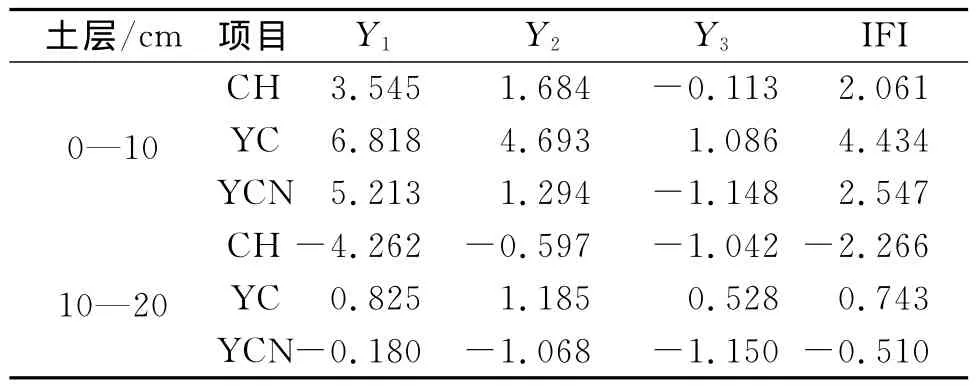
表7 各样地土壤肥力综合指标值
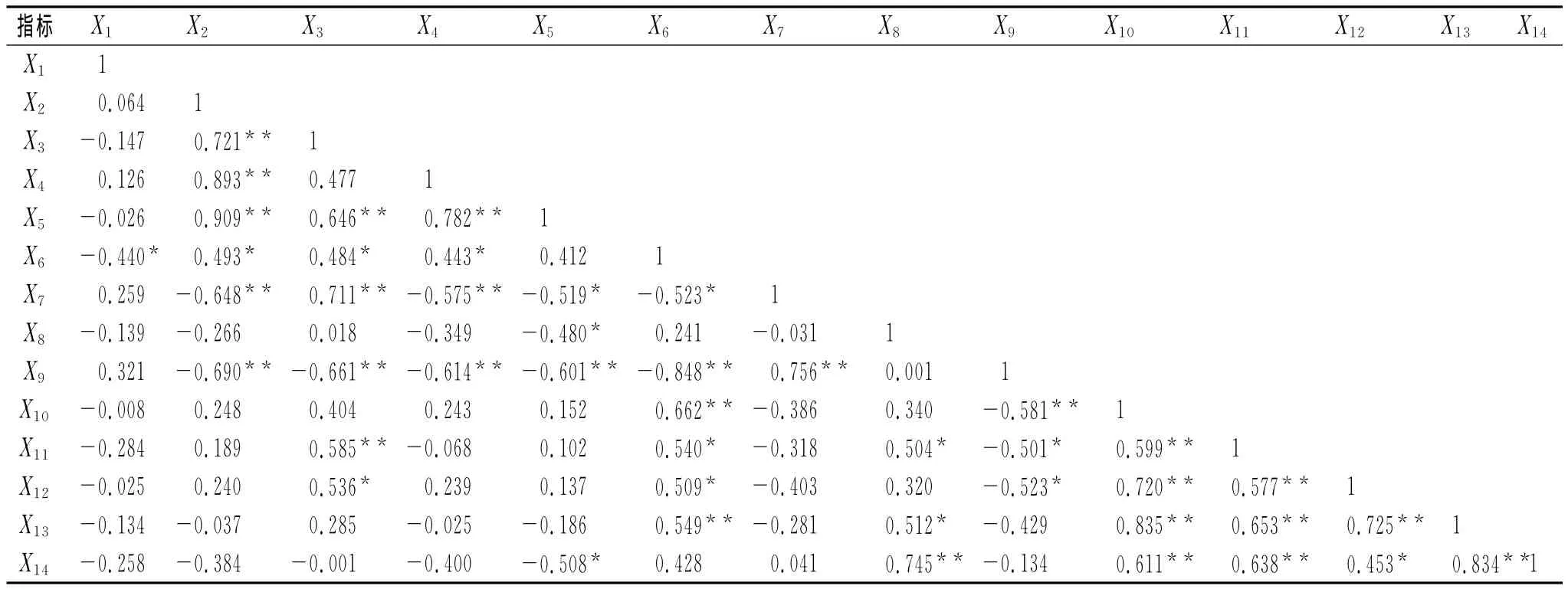
表8 土壤理化性质、酶活性与微生物数量的相关性
3 讨 论
(1)安太堡露天矿复垦区完全是由人工建成、土壤结构破坏极其剧烈、植被恢复从零开始的生态修复区,如何对复垦区植被恢复模式进行科学、合理的筛选搭配是在安太堡露天矿进行植被恢复所面临的主要问题之一。本研究结果表明,对不同植被模式生态肥力的比较呈现YC>CH>YCN,说明油松—刺槐混交林的恢复效果较好,这也与本课题组进行生态调查时所观测到的结果一致,也说明了检测指标的选取与不同植被实际生长情况具有一致性。
(2)通过主成分分析,得到对安太堡露天矿区复垦地土壤生态肥力综合评价起主要作用的若干指标,如有机碳、全氮、碱解氮、蔗糖酶、细菌数量、真菌数量、固氮菌数量等。通过比较这些指标的优劣,可为安太堡露天矿区植被恢复效果评价及植被模式筛选提供科学依据。
(3)在安太堡露天矿复垦地三种植被模式中均表现出碳氮含量随土层加深而递减,表现出植被恢复下土壤有机质和氮素具有一定表聚性。植被产生的凋落物为土壤提供了有机物质原料,促进了土壤物质循环,提高了土壤肥力,进而促进了植物生长发育,形成良性循环,逐步提高了土壤质量[21]。
(4)同时,土壤酶活性也表现出相同的变化趋势。安韶山等[22]认为大多数植被恢复模式对土壤的脲酶活性有着促进作用。安太堡露天矿进行植被恢复后,土壤蔗糖酶和脲酶活性的增强,表明土壤中碳素和氮素循环转化强度有较大的提高。此外,本研究的结果也说明土壤酶活性与土壤生物学肥力有关并且可以作为衡量土壤生物学性状高低的指标之一[23]。
(5)土壤微生物数量因植被模式和土壤层次不同而存在显著差异,这可能是由于不同植被模式植物根系生长和互作不同所致,Bosalo等[24]根据扩增的16SrDNA的DGGE指纹图谱分析,发现微生物群落结构的不同与不同的植被模式有关。植被生长使得土壤微生物种类趋于丰富,群落多样性更高[25],而本研究结果也证实了这一点。不同的恢复模式形成不同的微生态环境,为土壤微生物生长提供不同的食物来源与生长条件,导致了土壤微生物群落结构的多样化。随着植被生长演替和种植时间增加,植被对土壤的改造也趋于增强[26],并促进土壤理化性质良性发展,提高了土壤酶活性和微生物数量,影响了土壤微生物群落多样性,改善了土壤的生物学性状。
(6)本研究结果说明,土壤理化性质与土壤的酶活性和微生物数量具有不同程度的相关,说明土壤理化性质、酶活性和微生物数量之间相互影响。不过三类指标的相关性会因为植被、土壤、大气、地理、环境综合影响而出现不同状况。
4 结 论
植被恢复对于安太堡露天矿区复垦地土壤质量改善具有重要影响,不同的植被模式影响效果不同。通过比较不同样地土壤理化性质指标,可见油松—刺槐混交林的相关数值较好;同时,对土壤酶活性进行综合比较,可知油松—刺槐混交林的相关指标较好;此外,不同的土壤微生物类群也表现出这一趋势,土壤细菌、真菌群落多样性也呈现相同变化规律。从土壤生物学指标综合评价得分值来看,油松—刺槐混交林恢复效果最好,土壤有机碳、全氮、碱解氮、蔗糖酶、细菌数量、真菌数量、固氮菌数量等可作为植被模式筛选与土壤生态肥力评价的科学指标。
[1] 杨修,高林.德兴铜矿矿山废弃地植被恢复与重建研究[J].生态学报,2001,21(11):1932-1940.
[2] 曹银贵,白中科,刘泽民,等.安太堡露天矿区土地类型变化研究[J].西北林学院学报,2007,22(2):44-48.
[3] 毕如田,白中科,李华,等.基于RS和GIS技术的露天矿区土地利用变化分析[J].农业工程学报,2008,24(12):201-204.
[4] 黄丹勇.矿区土地复垦与生态环境恢复综述[J].湖南有色金属,2011,27(6):45-48.
[5] 台培东,李培军,贾宏宇,等.排土场边坡人工沙棘灌丛对风滚植物的固留作用及生态效应[J].应用生态学报,2001,12(6):833-836.
[6] 王改玲,王小利,李东方,等.安太堡露天煤矿复垦地土壤养分相关研究[J].煤矿环境保护,2001,15(5):25-27.
[7] 魏忠义,马锐,白中科,等.露天矿大型排土场水蚀特征及其植被控制效果研究:以安太堡露天煤矿南排土场为例[J].水土保持学报,2004,18(1):164-167.
[8] 钟爽,刘志斌.生态学在露天煤矿排土场生态恢复中的应用[J].露天采矿技术,2006(2):51-53,55.
[9] 李晋川,王文英.安太堡露天煤矿新垦土地植被恢复的探讨[J].河南科学,1999(增刊):92-95.
[10] 台培东,孙铁珩,贾宏宇,等.草原地区露天矿排土场土地复垦技术研究[J].水土保持学报,2002,16(3):90-93.
[11] 章家恩,廖宗文.试论土壤的生态肥力及其培育[J].土壤与环境,2000,9(3):253-256.
[12] 魏媛,喻理飞,张金池,等.退化喀斯特植被恢复过程中土壤生态肥力质量评价:以贵州花江喀斯特峡谷地区为例[J].中国岩溶,2009,28(1):61-67.
[13] 薛建春,蔡松.生态脆弱矿区土地利用动态变化研究:以平朔矿区为例[J].水土保持研究,2011,18(6):204-207.
[14] Kelly J J,Tate R L.Effects of heavy metal contamination and remediation on soil microbial communities in the vicinity of azincsmelter[J].Journal of Environmental Quality,1998,27(3):609-617.
[15] 关松萌.土壤酶及其研究法[M].北京:农业出版社,1986.274-339.
[16] 中国科学院南京土壤研究所.土壤微生物试验法[M].北京:科学出版社,1983.
[17] 王奇赞,徐秋芳,姜培坤,等.天目山毛竹入侵阔叶林后土壤细菌群落16SrDNA V3区片段PCR的DGGE分析[J].土壤学报,2009,46(4):662-669.
[18] Lisa A M,Brenda S,Michael G S.Comparative denaturing gradient gel electrophoresis analysis of fungal communities associated with whole plant corn silage[J].Journal of Microbial,2001,47(9):829-841.
[19] 张庆费,宋永昌,由文辉.浙江天童植物群落次生演替与土壤肥力的关系[J].生态学报,1999,19(2):174-178.
[20] 骆伯胜,钟继洪,陈俊坚.土壤肥力数值化综合评价研究[J].土壤,2004,36(1):104-106.
[21] 黄耀,沈雨,周密,等.木质素和氮含量对植物残体分解的影响[J].植物生态学报,2003,27(2):183-188.
[22] 安韶山,黄懿梅,郑粉莉.黄土丘陵区草地土壤脲酶活性特征及其与土壤性质的关系[J].草地学报,2005,13(3):233-237.
[23] 张焱华,吴敏,何鹏,等.土壤酶活性与土壤肥力关系的研究进展[J].安徽农业科学,2007,35(34):11139-11142.
[24] Bosalo D A,Girvan M S,Verchot L.Soil microbial community response to land use change in an agricultural landscape of western Kenya[J].Micorbial Ecology,2005,49(1):50-62.
[25] 夏北成,Zhou J,Tiedje J M.土壤细菌类克隆群落及其结构的生态学特征[J].生态学报,2001,21(4):574-578.
[26] 周涛,戴全厚,吴秀芹,等.喀斯特山区退耕还林地土壤养分效应及评价[J].水土保持研究,2011,18(6):71-74.
