FISH检测痰脱落细胞3、8、9、17染色体异常情况,研究肺癌诊断新手段*
2015-12-16李林
李林
FISH检测痰脱落细胞3、8、9、17染色体异常情况,研究肺癌诊断新手段*
李林①
目的:应用荧光原位杂交(fluorescence in situ hybridization,FISH)技术对痰脱落细胞染色体异常情况进行分析,探讨FISH辅助诊断肺癌的可行性和有效性。方法:选择2014年6月-2015年6月本院收治的疑似肺癌患者30例作为研究对象,采用3、8、9、17号染色体着丝粒探针对其痰脱落细胞进行FISH检测并进行痰脱落细胞学检查。结果:肺癌确诊患者痰脱落细胞中3、8、9、17号染色体畸变阳性率分别为41.67%、45.83%、58.33%、41.67%;FISH检测和痰脱落细胞学检查的敏感度分别为83.33%和20.83%,特异性分别为66.67%和100%,诊断符合率分别为80.00%和36.67%,FISH检测敏感度和诊断符合率均高于痰脱落细胞学检查,比较差异均有统计学意义(P<0.05)。结论:肺癌的发生发展与染色体畸变有关,FISH检查可明显提高肺癌诊断准确率,可作为肺癌诊断新手段。
肺癌; 荧光原位杂交; 痰脱落细胞
肺癌是当今世界上最常见的威胁人类生命健康的恶性肿瘤[1]。近年来由于女性吸烟人群数量的逐渐增加,肺癌总发病率也随之显著增加[2]。据相关统计学结果表明,肺癌的发病率和死亡率均占我国大多数城市恶性肿瘤的首位。影像学检查如胸部X射线、CT检查、肺穿刺活检,支气管镜检查和痰脱落细胞学检查均是临床诊断肺癌的有效手段,MiRNA作为血清标志物也为肺癌早期诊断提供了新的研究途径[3-4]。与其他方法相比,痰脱落细胞学检查具有取材简单、安全、患者无创伤等优点,且可以判断肿瘤的组织学类型,对肺癌的治疗有重要意义。荧光原位杂交(fluorescence in situ hybridization,FISH)技术是一门新兴的分子细胞遗传学技术,可用于检测染色体数目和结构的异常变化,为恶性肿瘤的研究提供了新的技术支持,目前被广泛用于诊断尿路上皮癌、血液系统肿瘤以及宫颈癌等恶性肿瘤[5]。本研究利用FISH技术检测30例疑似肺癌患者痰脱落细胞3、8、9、17号染色体异常情
况,探讨FISH作为肺癌诊断新手段的应用价值,现报道如下。
1 资料与方法
1.1 一般资料 选择2014年6月-2015年6月本院收治的疑似肺癌患者30例作为研究对象,其中女10例,男20例,年龄45~78岁,中位年龄65岁。经病理学诊断证实为肺癌24例,其中鳞癌14例,小细胞肺癌3例,腺癌7例;TMN分期:Ⅰ~Ⅱ期9例,Ⅲ~Ⅳ期15例。良性病变6例,其中肺炎3例,肺结核3例。
1.2 方法 收集新鲜痰液,嘱患者晨起后去除口腔唾液,陈腐痰及鼻腔分泌物,并咯出喉部痰液,取漱口后深呼吸用力咯出的肺部痰液2~3口,连续3 d,留置于无菌盛痰瓶中,每例收集约20mL,分为2等份各为10mL,送检处理,分别用于FISH检测和常规痰细胞检测,具体方法如下。
1.2.1 FISH检测
1.2.1.1 痰标本的制备 将收集到的10mL新鲜痰液放入置有Sacco manno固定液的试管固定[6]。用搅拌棒搅匀后,1500 r/min,离心10min弃去上清,0.25%胶蛋白酶室温消化10min后,加入血清终止消化,1500 r/min,离心10min弃去上清。PBS洗涤后,1500 r/min,离心10min弃去上清,用Sacco manno固定液重悬细胞,滴在载玻片上。
1.2.1.2 探针选择 选择3、8、9和17号染色体为研究对象进行标记和检测。杂交时3号和17号为一组,8号和9号为一组做双色荧光原位杂交,3、8号标记为红色,9、17号标记为绿色。
1.2.1.3 FISH实验 (1)探针杂交混合物配制:将1×标准柠檬酸盐溶液(SSC)、55%甲酰胺、10%硫酸葡聚糖、1 mg/mL鲑鱼精DNA配成20 ng/mL探针杂交混合物。(2)探针变性:将配好的探针杂交混合物于75 ℃水溶变性10min,变性后立即入冰,加到染色体载玻片上染色。(3)载玻片的杂交前处理:70%乙酸处理10min;PBS洗3次,5min/次;100 mg/L核糖核酸酶A,2×SSC 37 ℃消化60min,2×SSC洗3次,5min/次;70%、90%、100%乙醇梯度脱水处理各3min,风干;70%甲酰胺、2×SSC 75 ℃变性各3min;立即入冷70%、90%、100%乙醇脱水各处理3min,风干。(4)杂交:将变性过的探针加到上述变性的载玻片上,rubber solution封片,放置在湿盒中37 ℃杂交过夜。(5)杂交后洗涤:杂交结束后,载玻片在42 ℃的50%甲酰胺,2×SSC中洗3次,5min/次,2×SSC中洗3次,5min/次。(6)检测:将玻片置于室温70%乙醇中洗涤3min,取出后在暗处风干,在样本区域滴加15μL DAPI,盖上盖玻片,避光保存15~20min。(7)结果观察:用NIKON荧光显微镜观察结果。
1.2.1.4 对照研究 上述4个染色体特异探针和8例健康人(其中男5例,女3例)的外周血细胞中期分裂染色体杂交,以确证各探针杂交的特异性并计数400个细胞中具有≤1个杂交信号和≥3个杂交信号的细胞比例,用于计算每个探针具有≤1个杂交信号和≥3的杂交信号的细胞的99%可信限(上限),作为判定标本中异倍体的标准,选择具有某一杂交信号异常数目的细胞所占的比例≥10%作为制定异常信号的标准。
1.2.1.5 质量控制 每一批杂交试验都带一张正常血细胞的染色体片,若杂交后,正常染色体片中各探针具有2个杂交信号的比例明显低于对照研究中的平均比例,或杂交信号很多,难以分辨,则视为该次杂交失败,弃之重新杂交。
1.2.2 痰脱落细胞学检测 将收集好的患者新鲜痰液10mL标本送常规细胞病理学检查,连送3d。
1.3 统计学处理 采用SPSS 17.0 统计软件对所得数据进行分析,计数资料以率(%)表示,比较采用 χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 对照研究 计算出的99%可信限(上限)作为结果判定的标准:即患者标本中具有1个3、8、9、17号染色体杂交信号的细胞所占的百分比分别为≥3.83%、≥3.61%、≥4.73%、≥3.77%时视为丢失;有≥3个3、8、9、17号染色体杂交信号的细胞所占的百分比分别为≥4.72%、≥4.84%、≥2.75%、≥4.91%时视为染色体拷贝数增多,见表1。
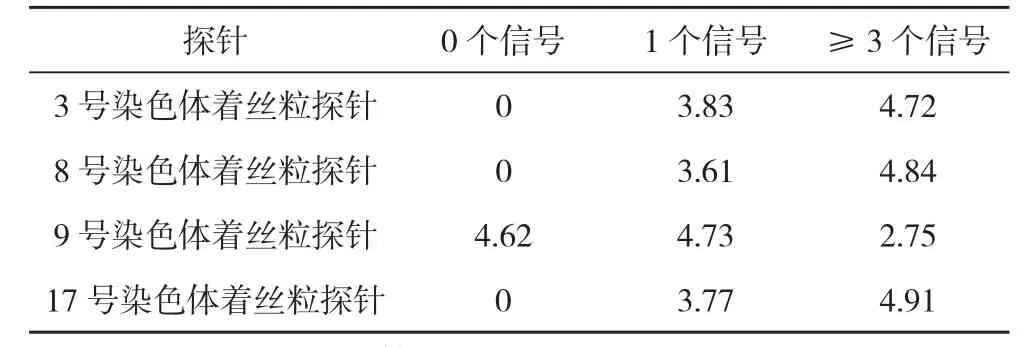
表1 正常细胞中染色体数目畸变率 %
2.2 肺癌患者染色体畸变分析及探针诊断肺癌 肺癌患者新鲜痰液中染色体均存在不同程度的畸变:3号染色体表现为单体、三体、四体或者多体或3p缺失;8号染色体表现为单体,三体,四体或多体,也可表现为8p;9号染色体多表现为9p缺失,也可表现为完全缺失;17号染色体表现为三体、四体或多体。3、8、9、17号染色体探针单独使用敏感度均低于4种染色体探针联合使用,比较差异均有统计学意义(P<0.05),见表2。

表2 4种染色体探针及其组合诊断肺癌结果比较
2.3 FISH与痰脱落细胞学检测肺癌的敏感度和特异性比较 FISH检测的敏感度、诊断符合率均高于痰脱落细胞学检测,比较差异均有统计学意义(P<0.05),见表3。

表3 FISH与痰脱落细胞学检测肺癌的敏感度、特异性及诊断符合率比较 %
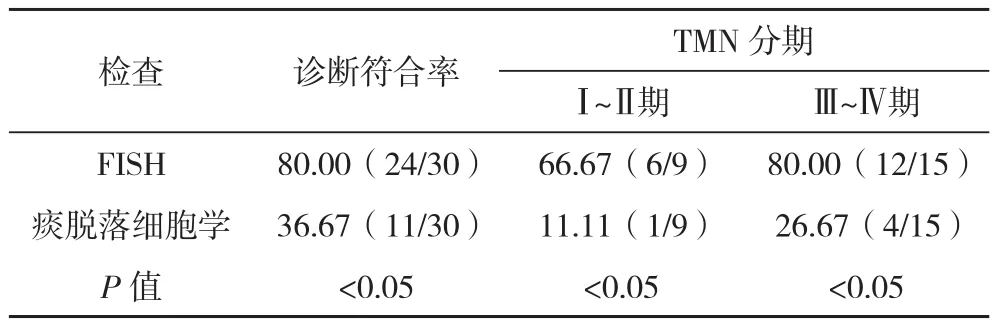
续表3
3 讨论
肺癌死亡率居高不下的主要原因在于多数肺癌患者确诊时已是晚期,即使采用综合治疗方法,患者治愈率仍不尽如人意[7]。如何提高肺癌早期诊断率成为降低肺癌高死亡率的重要课题。痰是气管或支气管的分泌物和肺泡的渗出物借助于支气管黏膜上皮纤毛运动,管壁平滑肌的收缩和咳嗽的气流的口腔排出物。利用痰细胞学检查诊断技术是肺癌高发人群进行防癌筛查的一种常规检测手段,但痰脱落细胞学检查肺癌检出率较低,特异性较差[8]。因此寻找一种特异性和敏感性较高,可辅助痰脱落细胞学检查诊断肺癌的方法,成为肺癌早期诊断研究的新方向。
相关研究结果表明,肺癌的发展与染色体不稳定性密切相关,特别是与3、8、9、17号染色体的非整倍体有关。3号染色体短臂(3p)和9号染色体短臂(9p)上遗传物质丢失是早期肺癌发生发展过程中的频发事件[9]。高树庚等[10]用FISH对21例非小细胞肺癌(non-small cell lung cancer,NSCLC)短期培养的肺癌组织和癌旁支气管上皮细胞中3p和9p丢失进行分析,21例中均检测到3p或9p丢失,3p和9p共同丢失率为57.14%(12/21),3p或9p单独丢失率为42.86%(9/21),9p丢失率在肺癌组织和癌旁支气管上皮细胞中均比3p高,提示肺癌发生发展过程中9p丢失发生可能性更大。
8号染色体拷贝数增多与肺癌晚期、高分级有一定关系。8q22~q24是c-myc基因染色体定位区域,c-myc基因激活后,与细胞增殖相关的核蛋白p62作为其产物过度表达,从而使细胞快速增殖[11]。谢菁等[12]利用FISH检测肺癌间期细胞部分染色体数目改变,结果表明8号染色体在NSCLC和SCLC中扩增率分别是46.2%和43.75%,且8号染色体扩增现象随着临床病理分期的进展更加明显,但二者间无统计学相关性。因此,8号染色体拷贝数增多可能会引起c-myc基因扩增,参与了肺癌形成的进展阶段。
多个与肿瘤相关的基因如抑癌基因p53,肿瘤分化与转移相关HER2/neu基因等均定位于17号染色体上,17号染色体异常的意义更为重要。p53是研究较早较为深入的一种抑癌基因,60%~70%的恶性肿瘤中发现p53的2个等位位点有突变或缺失存在,p53基因突变的肿瘤恶性程度相对较高,易侵袭周围组织或者向远处转移。Brabender等[13]发现,HER2/neu基因表达过度,EGFR和HER2/neu高水平共表达均作为影响NSCLC预后不良的因素,EGFR和HER2/neu对NSCLC患者术后复发及选择是否接受密集辅助治疗有重要作用。Onn等[14]进一步研究发现,EGFR和HER2/neu在蛋白水平同步过表达可增加复发可能性,降低NSCLC1期患者存活率,这一研究结果为靶向治疗提供了方向。
FISH技术以荧光标记的单链核苷酸为探针,遵循碱基互补配对原则,与待测未知单链核苷酸杂交,通过荧光显微镜观察肿瘤细胞内染色体数目和结构的改变情况。FISH技术敏感性高,特异性好,操作简单,空间定位精确,结果观察直接清晰,目前已经被广泛应用于一些实体瘤的诊断和先天性疾病的产前诊断[15]。利用FISH技术检测痰脱落细胞染色体异常情况也被证实为可行,FISH联合常规痰脱落细胞学检查可明显提高肺癌诊断准确率,可作为肺癌诊断新手段[16]。
本研究30例疑似肺癌患者,经病理确诊为肺癌24例,良性病变6例。统计结果分析,痰脱落细胞学特异性(100%)虽然高于FISH检测结果(66.67%),但两者比较差异无统计学意义(P>0.05)。在24例肺癌确诊患者中,FISH检测阳性20例(83.33%),而痰脱落细胞学检测阳性5例(20.83%),阳性检出率FISH检测明显高于痰脱落细胞学检测,比较差异有统计学意义(P<0.05)。敏感度和诊断符合率结果显示,FISH检测明显均优于痰脱落细胞学检测,比较差异均有统计学意义(P<0.05)。Voss等[17]在137例疑似肺癌患者支气管镜检样本中选取78例,FISH检测检测出肺癌的敏感
度(71%)明显高于传统细胞学检查(51%)(P=0.07),该结果与本文研究结果一致。杨晓东等[18]研究结果显示,自发性荧光支气管镜组肺癌确诊率明显优于白光电子支气管镜组,对肺癌早期诊断有重要价值。
本研究确诊肺癌24例,早期(Ⅰ~Ⅱ期)9例,晚期(Ⅲ~Ⅳ期)15例。Rivera等[19]研究表明,取得脱落肿瘤细胞的容易程度与肿瘤的大小成正比关系,即肿瘤越大,越易取得脱落肿瘤细胞,晚期痰脱落肿瘤细胞相对于早期痰脱落肿瘤细胞敏感度更高。本研究中,早期肺癌痰脱落细胞学敏感度为11.11%(1/9),晚期的敏感度26.67%(4/15),与上述结果相一致。但也有部分学者持其他观点,咳出的痰液细胞质量高低直接影响痰脱落细胞诊断结果,Miller等[20]研究结果表明,至少有10%的痰液标本不足以检测痰脱落细胞形态。本研究结果中,FISH检测早期肺癌敏感度66.67%和晚期肺癌敏感度80.00%均高于痰脱落细胞学检测,比较差异均有统计学意义(P<0.05)。
本组24例确诊肺癌痰脱落细胞标本中,4种染色体探针联合使用相比于单独使用1种染色体探针可提高FISH检测的敏感性。肺癌发生发展是一个涉及多基因多步骤的过程,染色体非整倍体改变是痰脱落肿瘤细胞的重要特征,对于肺癌发生、发展以及预后有重要意义。FISH技术可以明显提高染色体异常的检出率,一方面说明FISH技术提供了直接观察大量肺癌细胞遗传学改变的手段,能够反映某一染色体数量改变的范围和分布情况;另一方面也论证了FISH技术检测肺癌中染色体异常的可行性,为临床肺癌患者的诊断、病理分类、预后及治疗方案的选择提供新的依据。综上所述,FISH技术检测3、8、9、17号染色体异常情况,可明显提高早期肺癌检出率,对肺癌早期诊断、早期治疗及肺癌治疗效果的提高有重要价值,可作为肺癌诊断的辅助手段在临床推广应用。
[1] Spiro S G,Porter J C.Lung cancer-where are we today?Current advances in staging and nonsurgical treatment[J].American Journal of Respiratory and Critical Care Medicine,2002,166(9):1166-1196.
[2] Jemal A,Travis W D,Tarone R E,et al.Lung cancer rates convergence in young men and women in the United States:analysis by birth cohort and histologic type[J].International Journal of Cancer,2003,105(1):101-107.
[3] Varella-Garcia M.Molecular cytogenetics in solid tumors:laboratorial tool for diagnosis, prognosis, and therapy[J].The Oncologist,2003,8(1):45-58.
[4]曾凤枝.MiRNA及其与肺癌早期诊断的新认识[J].中国医学创新,2012,9(30):154-156.
[5]曹志星,吕威,赵晔,等.FISH检测宫颈上皮内瘤变及其旁组织中hTERC基因表达的变化及意义[J].中国医学创新,2014,11(23):1-6.
[6] Saccomanno G,Saunders R P,Ellis H,et al.Concentration of carcinoma or atypical cells in sputum[J].Acta cytologica,1963,1(7):305-310.
[7]苏忠,陈宏.肺癌的综合治疗[J].中国医学创新,2009,6(31):151-152.
[8]李剑颖.痰细胞学检查在肺癌诊断中的临床价值[J].中国医学创新,2010,7(15):137-138.
[9] Caballero O L,Cohen D,Liu Q,et al.Loss of chromosome arms 3p and 9p and inactivation of P16INK4a in normal epithelium of patients with primary lung cancer[J].Genes,Chromosomes and Cancer,2001,32(2):119-125.
[10]高树庚,董向阳.人肺癌组织3p和9p丢失的研究[J].肿瘤防治杂志,2002,9(4):359-361.
[11] Kubokura H,Tenjin T,Akiyama H,et al.Relations of the c-myc gene and chromosome 8 in non-small cell lung cancer:analysis by fluorescence in situ hybridization[J].Annals of Thoracic and Cardiovascular Surgery,2001,7(4):197-203.
[12]谢菁,薛永权,黄建安,等.应用荧光原位杂交技术检测肺癌间期细胞部分染色体数目的改变[J].中国综合临床,2006,22(1):30-33.
[13] Brabender J,Danenberg K D,Metzger R,et al.Epidermal growth factor receptor and HER2-neu mRNA expression in non-small cell lung cancer is correlated with survival[J].Clinical Cancer Research,2001,7(7):1850-1855.
[14] Onn A,Correa A M,Gilcrease M,et al.Synchronous overexpression of epidermal growth factor receptor and HER2-neu protein is a predictor of poor outcome in patients with stage I non-small cell lung cancer[J].Clinical Cancer Research,2004,10(1):136-143.
[15] Speicher M R,Carter N P.The new cytogenetics:blurring the boundaries with molecular biology[J].Nature Reviews Genetics,2005,6(10):782-792.
[16] Varella-Garcia M Schulte A P,Wolf H J,et al.The detection of chromosomal aneusomy by fluorescence in situ hybridization in sputum predicts lung cancer incidence[J].Cancer Prevention Research,2010,3(4):447-453.
[17] Voss J S,Kipp B R,Halling K C,et al.Fluorescence in situ hybridization testing algorithm improves lung cancer detection in bronchial brushing specimens[J].American Journal of Respiratory and Critical Care Medicine,2010,181(5):478-485.
[18]杨晓东,鲍文华,张智勇,等.荧光支气管镜在肺癌早期诊断中的临床分析[J].中国医学创新,2013,10(14):74-76.
[19] Rivera M P,Mehta A C.Initial diagnosis of lung cancer:ACCP evidence-based clinical practice guidelines[J].CHEST Journal,2007,132(3 suppl):131S-148S.
[20] Miller Y E,Vu K O,Kennedy T C,et al.Lack of association between sputum atypia and chronic obstructive pulmonary disease mortality[J].Journal of Thoracic Oncology,2006,1(4):302-307.
Research on a New Mean for the Diagnosis of Lung Cancer:Fluorescence in Situ Hybridization in the Detection of Abnormalities of Chromosome 3,8,9,17 in Exfoliated Cells of Sputum Samples/
LI Lin.//Medical Innovation of China,2015,12(32):001-004
Objective:To analyze the chromosome abnormalities of exfoliated cells in sputum samples by fluorescence in situ hybridization and to explore the possibility and validity of FISH examination for the diagnosis of lung cancer.Method:30 patients who were suspected with lung cancer in our hospital from June 2014 to June 2015 were selected as the research objects.They were given FISH examination by using centromeric probes of chromosome 3,8,9,17 to examine chromosome abnormalities of sputum exfoliated cells,sputum cytology detection was also given to them.Result:The aberration rate of chromosomes 3,8,9 and 17 in lung cancer patients’ sputum exfoliated cells were 41.67%,45.83%,58.33% and 41.67% respectively.The sensitivity of FISH and sputum cytology detection were 83.33% and 20.83% respectively,the specificity of them were 66.67% and 100% respectively and the diagnostic accordance rate of them were 80.00% and 36.67% respectively.The sensitivity and the diagnostic accordance rate of the FISH examination were higher than those of the sputum cytology detection,the differences were statistically significant(P<0.05).Conclusion:Chromosome aberrations plays an important role in the development of lung cancer.FISH technique can significantly improve the accuracy rate of diagnosis for lung cancer.It can be used as a new mean for the diagnosis of lung cancer.
Lung cancer; Fluorescence in situ hybridization; Sputum exfoliated cell
10.3969/j.issn.1674-4985.2015.32.001
2015-07-29) (本文编辑:王利)
江西省卫生计生委科技计划(20155485)
①江西省肿瘤医院 江西 南昌 330029
李林
First-author’s address:The Tumor Hospital of J iangxi Province,Nanchang 330029,China
