耐酸植物乳杆菌的紫外诱变选育及性质的研究
2015-12-16尹义敏田丰伟翟齐啸王刚张秋香张灏陈卫
尹义敏,田丰伟,翟齐啸,王刚,张秋香,张灏,陈卫,2
(1.江南大学食品学院,江苏无锡214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡214122)
0 引言
乳酸菌是能够利用糖类发酵产乳酸的一类无芽孢、革兰氏阳性细菌的总称,包括乳杆菌、乳球菌和双歧杆菌等至少23个属[1]。广泛应用于医药、食品和饲料等行业中,被公认为是安全的食品级微生物[2]。乳酸菌能维持肠道平衡[3]、降低血清胆固醇[4-6]、增强免疫能力[7]等。
乳酸菌发酵不断积累的乳酸,以及胃酸环境严重影响其生理活性。因此,耐酸性被认为是益生乳酸菌筛选过程中重要的因素之一[8]。近年来,适应性进化和定向进化被广泛应用于极端微生物的筛选,并且成功选育一些耐极端环境的微生物,但周期相对较长[9-12]。所以,传统的诱变育种筛选菌株仍是不错的选择。
本实验对Lactobacillus planturam CCFM8661进行紫外诱变,通过低pH MRS培养基筛选出两株耐酸能力提高且性能较稳定的诱变菌株。
1 实验
1.1 菌株与培养基
实验所用菌株为植物乳杆菌(Lactobacillus planta⁃rum CCFM8661),为江南大学食品学院生物技术中心实验室自行分离。在MRS培养基中培养,培养条件为37℃(24 h)。筛选培养基为pH值为3.5和3.0的MRS培养基(用浓度为1 mol/L的HCl调节)。
1.2 方法
1.2.1 实验流程
菌种活化→初始菌株生长曲线的测定→菌悬液的制备→紫外诱变处理→耐酸突变株的初筛→耐酸突变株的复筛→突变株耐酸能力的分析→遗传稳定性的测定
1.2.2 生长曲线的测定
将活化的菌株以2%的接种量接种到MRS液体培养基中,37℃培养,每隔2 h取样测定
OD600值,以空白MRS培养基为对照。以时间为横坐标,OD600值为纵坐标,绘制初始菌株的生长曲线。
1.3 菌悬液的制备
将活化初始菌株以2%接种量接种到MRS液体培养基中,37℃恒温培养至对数生长期中后期。取出10 mL菌液,在6 000 r/min下离心10 min,弃掉上清液,收集菌体。然后用浓度为0.1 mol/L pH值为7.0磷酸缓冲液(PBS)洗涤3次,主要是将残留的培养基洗净。将细胞重新悬浮在PBS缓冲液中,将细胞浓度调节到108mL-l,制成菌悬液。最后加入玻璃株振荡分散10 min,用无菌脱脂棉过滤,使形成单细胞,分散程度达90%~95%。
1.4 紫外诱变处理
取制备好的菌悬液5 mL于直径9 cm的无菌平皿中,在其中加入转子。紫外灯打开预热30 min,以稳定光波。将盛有菌悬液的平皿放置磁力搅拌器上,放到离功率为15W的紫外灯30 cm处,开启磁力搅拌器,打开平皿盖,暴露紫外光下照射一定时间,边搅拌边照射,力求使细胞均匀吸收紫外线光波。使用秒表计时,分别照射15,30,45,60,75,90 s。以上照射过程是在有红光的暗室内进行,以免光修复。
1.5 菌株致死率的测定
分别取经过UV照射处理的菌液与未照射处理的(作为空白对照)菌悬液1 mL进行梯度稀释。取0.1 mL稀释液在MRS固体培养基上涂匀,将平板用黑布包好,倒置于37℃恒温培养箱中培养24 h,待平板上长出菌落进行计数计算致死率[13]。实验三次平行,取平均值。
致死率为
致死率=(A-B)/A×100%,
式中:A为未经照射处理菌体长出的菌落数;B为紫外照射处理菌体长出的菌落数。
1.6 耐酸突变株的筛选
挑选形状规则的诱变后单菌落移至MRS液体培养基上,并置于37℃,培养24 h。再以2%接种量分别接种于含200 μL pH3.5 MRS培养基的96孔板中,继续培养24 h后,使用酶标仪测得OD600,计算相对生长率。将初筛得到相对生长率明显高于出发菌株的菌体挑选出来,以2%接种量转接到含200 μL pH3.0 MRS培养基的96孔板中,37℃下培养24 h,用酶标仪测得OD600,计算相对生长率[14],即相对生长率=(d-b-c)/(a-b-c)× 100%,
式中:a为测定的菌株在pH=6.3的培养基中生长的吸光值;b为测得的空白培养基的吸光值;c为计算得接种时的吸光值(10%接种量×菌株活化后的吸光值);d为测定的菌株在pH=3.5培养基中生长的吸光值。
1.7 遗传稳定性分析
将上述实验得到的突变株在MRS液体培养基中连续传代10次,将每一代都接种到pH值为3.0的MRS液体培养基中,37℃培养24 h。取每次传代菌株的菌液测定其OD600,计算相对生长率。每代重复三次,观察其遗传稳定性。
1.8 突变株的耐酸性能分析
为了比较突变株与原始菌株在pH值为3.5条件下的生长情况,将正突变株与出发菌株分别接种到pH值为3.5的MRS液体培养基中,37℃下培养24 h。然后梯度稀释,测定活菌数。
将突变株与原始菌株接种到pH值为3.0的MRS液体培养基中,胁迫不同时间,梯度稀释涂在MRS平板上测定活菌数和存活率来比较分析存活能力。
2 结果与分析
2.1 L.plantarum CCFM8661的生长曲线
为了保证诱变处理时细胞具有一定的浓度从而可以增加细胞变异数,选择对数生长中后期的细胞进行诱变处理。生长曲线如图1所示。
由图1可以看出,L.plantarum CCFM8661的对数期在4~14 h,之后菌液浓度基本保持不变,因此选用12 h的菌体制备菌悬液进行紫外诱变处理。

图1 L.plantarum CCFM8661的生长曲线
2.2 紫外诱变剂量的确定
用于微生物诱变的紫外线剂量的表示方法,可分绝对剂量和相对剂量。绝对剂量需要用一种剂量仪来测定,由于操作困难,不常被采用。常采用紫外线的致死率来表示相对剂量。
根据文献报道[12],一般认为诱变后菌体的致死率在90%~95%效果较好,更容易筛选出变异幅度较大的突变菌株。因此本文以此为依据确定最佳诱变剂量。
以照射时间为横坐标,致死率(%)为纵坐标绘制L.plantarum CCFM8661的致死率曲线,如图2所示。

图2 L.plantarum CCFM8661的致死率曲线
由图2可以看出,随着紫外线照射时间的延长,致死率逐渐上升。当照射15 s时,致死率为65.27%。当照射30 s时,致死率达到90.30%,之后致死率趋于平缓。按照菌体致死率大约在90%~95%之间的诱变剂量来观察其正突变率。因此,本研究采取照射时间为30 s,致死率为90.30%。
2.3 耐酸突变株的筛选
对L.plantarum CCFM8661紫外诱变30 s,从诱变后的突变菌株中挑取107个菌落进行筛选,分别编号为V-1到V-107,在pH3.5的MRS液体培养基中初筛得到13株相对生长率明显高于原始菌株,然后在pH3.0的MRS液体培养基进行复筛。13株菌的相对生长率具体数据结果如表1所示。表1中数据为三组平行的平均值。
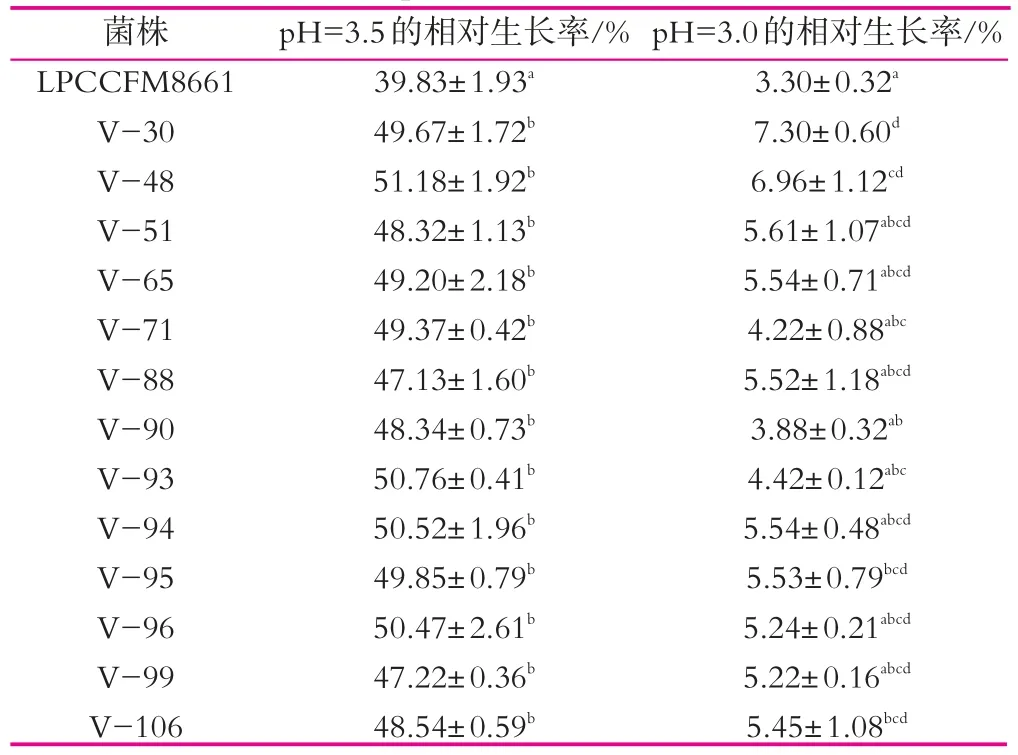
表1 菌株在不同pH值的培养基中的相对生长率
由表1可以看出,经过初步筛选,有13株突变菌株在pH值为3.5的MRS液体培养基中相对生长率明显高于原始菌株;经过pH值为3.0的培养基进行复筛,其相对生长率提高幅度不大,仅有两株突变株相对生长率大于6%。其中,V-30在pH值为3.5的相对生长率由39.83%提高到49.67%,V-48相对生长率由39.83%提高到51.18%;V-30在pH值为3.0的相对生长率由3.30%提高到7.30%,V-48相对生长率由3.30%提高到6.96%。所以由此可判断V-30与V-48较原始菌株更能耐受pH值为3.5与pH值为3.0的酸环境。即V-30与V-48作为下面实验研究的目标突变株。
2.4 突变株遗传稳定性的分析
L.plantarumCCFM8661的突变菌株V-30和V-48遗传稳定性的测定结果如图3所示。
由图3可以得出,在pH值为3.0的条件下突变株V-30和V-48每传一代的相对生长率都比较稳定,没有出现原位回复突变的情况,由此可以说明诱变菌株的遗传稳定性较好。
2.5 突变株的耐酸能力比较分析
为了分析突变菌株的耐酸性质,将原始菌株与突变株在pH值为3.5条件培养测定活菌数,在pH值为3.0条件下分别培养2,4和6 h测定存活率,结果如图4所示。图4中,V-30与V-48的活菌数明显高于原始菌株,分别是原始菌株的2.06和2.46倍。不同字母代表的组别间具有显著性差异(P<0.05)。

图3 遗传稳定性测定结果

图4 突变菌株在pH3.5的MRS液体培养基中的生长能力
由图4可以看出,在pH值为3.5的MRS中培养24 h后,V-30与V-48的活菌数明显高于原始菌株,分别是原始菌株的2.06和2.46倍。

图5 突变株在pH=3.0 MRS培养基中的存活率
图5为突变菌株V-30、V-48和原始菌株L.plan⁃tarumCCFM8661对盐酸胁迫的耐受性。由图4可以看出,随着盐酸胁迫时间的延长,原始菌株与突变菌株的存活率都存在不同程度的下降,当胁迫6 h后,原始菌株存活率为44%,而突变株V-30存活率为74.58%,V-48存活率为76.74%,分别提高了30.58%和32.74%。
3 讨论
乳酸菌作为益生菌,发挥其益生作用必须达到一定的活菌数。然而,外部的酸胁迫环境与人体内胃酸溶液都严重地影响了它的生理特性。因此,提高乳酸菌的酸耐受性是非常有必要的。而紫外诱变作为一种传统的诱变育种方法,条件简单、易于操作,在筛选耐极端环境的乳酸菌也有成功的报道。
本研究选择L.plantarum CCFM8661作为出发菌株,通过紫外诱变的方法来提高耐酸能力。结果表明,经过紫外诱变得到的两株突变株V-30与V-48在pH值为3.5和3.0的相对生长率均有所提高,且在pH值为3.0条件下存活能力也明显增强。表明紫外诱变对植物乳杆菌提高耐酸性是有效果的,为进一步研究耐酸机制奠定了基础。
[1]任大勇,李昌,秦艳青,等.乳酸菌益生功能及作用机制研究进展[J].中国兽药杂志,2011,45(2):47-50.
[2]WASSENAAR T M,KLEIN G.Safety Aspects and Implications of Regulation of Probiotic Bacteria in Food and Food Supplements[J].J Food Prol,2008,71(8):1734-1741.
[3]尹胜利,杜鉴,徐晨.乳酸菌的研究现状及其应用[J].生物工程,2012,37(9):25-29.
[4]AVAREZRC OLMOS M,OBERHELMAN R.Probiotic agents and infectious diseases:a modernPerspective on a traditional therapy[J].Clinical Infectious Diseases,2001,32:1567-1576.
[5]张美铃,周志华,赵立平.粪便中大肠杆菌多态性分子研究[J].微生物学通报,2005,,32(2):5-9.
[6]王立平,徐杰,云月英,等.蒙古国传统发酵酸马奶中乳杆菌潜在益生特性的研究[J].中国乳品工业,2005,33(4):4-10.
[7]MATTILA-SANDHOLM T,MYLLARINEN P.CRITTENDEN R,et al.Technological challenges for futureProbiotic foods[J].International dairy journal,2002,12(2/3):173-182.
[8]PARVEZ S,MALIK K A,KANG S A,et al.Probiotics and their fermented food products are beneficialFor health[J].J Appl Microbiol,2006,100:1171-1185.
[9]WANG Y,LI Y,PEI X,et al.Genome-shuffling improved acid tolerance and l-lactic acid volumetric productivity in Lactobacillus rhamnosus[J].J Biotechnol,2007,129(3):510-515.
[10]SHI D J,WANG C L,WANG K M.Genome shuffling to improve thermotolerance,ethanol tolerance and ethanol productivity of Saccharomyces cerevisiae[J].J Ind Microbiol Biot,2009,36(1):139-147.
[11]PORTNOY V A,BEZDAN D,ZENGLER K.Adaptive laboratory evolution-harnessing the power of biology for metabolic engineering[J].Curr Opin Biotech,2011,22(4):590-594.
[12]ZHANG J,WU C,DU G,et al.Enhanced acid tolerance in Lactobacillus casei by adaptive evolution and compared stress response during acid stress[J].Biotechnol Bioproc Eng,2012,17(2):283-289.
[13]吕红线,林建群,林建强.L-乳酸高产菌株的诱变选育[J].中国酿造,2008,185(8):8-10.
[14]诸葛健.工业微生物实验技术手册[M].北京:中国轻工出版社,1994.
