应用菌落免疫印迹技术测定多菌株发酵乳中鼠李糖乳杆菌生长与存活特征
2015-12-16杨振泉贡湘磊叶平徐同林高璐顾瑞霞
杨振泉,贡湘磊,叶平,徐同林,高璐,顾瑞霞
(1.扬州大学食品科学与工程学院,江苏扬州 225127;2.江苏省乳品生物技术与安全控制重点实验室,江苏扬州225127;3.泰州市产品质量监督检验所,江苏泰州 225309)
0 引言
鼠李糖乳杆菌(Lactobacillus rhamnosus)具有平衡肠道菌群、调节免疫功能等生理功效,是目前研究最为深入的乳酸菌之一[1,2]。发酵乳是活性益生菌的主要载体,研究显示添加鼠李糖乳杆菌发酵的牛乳能够产生抑菌、降血压、抗突变等多种活性因子[3,4]。建立快速特异的鼠李糖乳杆菌计数方法对于评价发酵乳中有效活菌数、研究发酵和贮藏过程中活菌变化规律具有重要意义[5]。相比现有的益生菌计数方法[6-9],菌落免疫印迹技术(Colony immunoblotting,CIB)更加快速、廉价,适合复杂生态体系中细菌的分离和计数[10,11],但该法在鼠李糖乳杆菌选择性计数方面国内外还没有相关报道。菌毛蛋白(FimI)是高粘附性鼠李糖乳杆菌表面特有的标志物[12],本文应用重组FimI抗体(anti-rFimI)建立了鼠李糖乳杆菌CIB计数方法,并对长寿人群来源的鼠李糖乳杆菌grx19(CGMCC No.5519)[13]在多菌株发酵乳体系中的生长与存活特征进行研究,旨在为鼠李糖乳杆菌grx19发酵乳产品的质量控制提供新的检测方法。
1 实验
1.1 材料
鼠李糖乳杆菌grx19(Lactobacillus rhamnosus grx19,CGMCC No.5519)菌株;保加利亚乳杆菌LB(Lactobacillus bulgaricus,LB)和嗜热链球菌ST(Streptococcus thermophilus,ST)均分离自商品化酸奶发酵剂;重组鼠李糖乳杆菌鞭毛亚基多克隆抗体(anti-rFimI)由本室制备;MRS培养基;PCR试剂、HRP标记的羊抗鼠IgG以及细菌16S rDNA扩增引物8F:5'-AGAGTTTGATCCTGGCTCAG-3'和 15R:5'-AAGGAG GTGATCCAGCCGCA-3',其他化学试剂均为国产分析纯。
1.2 发酵剂的制备
将菌株grx19、LB和ST冻干菌粉接种5 mL MRS液体培养基,37℃厌氧培养36 h,取培养物以5%(V/V)接种量接种MRS液体培养基,37℃厌氧培养24 h,4℃离心收集菌体(4 000 g,10 min),用PBS缓冲液悬浮菌体,并调整OD600nm=0.5,菌株grx19、LB和ST按不同体积比混合,制备菌悬液Amix(0∶1∶1)、Bmix(0.01∶1∶1)、Cmix(0.1∶1∶1)、Dmix(1∶1∶1)、Emix(10∶1∶1),所制得的混合菌悬液置4℃保藏备用。
1.3 菌落免疫印迹
将单菌株及混合菌株悬液用PBS缓冲液梯度稀释,选取3个适当的稀释度进行MRS平板涂布,37℃厌氧培养48 h后进行活菌计数,并选择分离良好的平板用于菌落免疫印迹测定。剪取与培养皿内径大小相同的硝酸纤维素(NC)膜,在去离子水中浸泡10 min,37℃干燥10 min。将NC膜置于培养基表面,使膜与培养基表面充分接触,室温静置5 min后取下NC膜,37℃干燥30 min;将转印膜放置在5%的脱脂乳中,室温封闭1 h;PBST缓冲液洗涤3次,置于anti-rFimI抗体稀释液中(稀释度为1∶2000)室温孵育1 h;PBST洗涤3次,置于HRP标记的羊抗鼠IgG(1∶1 000稀释)中孵育1 h;PBST洗涤3次,将转印膜浸入新鲜配制的DAB显色液中,避光显色10 min,待膜上出现明显斑点,用去离子水漂洗2次终止反应,将膜置于干净滤纸上自然干燥,分析阳性斑点对应的菌落及数量。
1.4 阳性菌落确证
挑取阳性斑点对应的菌落,接种MRS液体培养基,按文献[14]所述的CTAB方法提取基因组DNA;以基因组DNA为模板进行16S rDNA扩增。PCR反应体系为:2 μL模板(50 ng/μL)、4 μL dNTPs(25 mmol/μL)、引物8F(10 pmol/μL)和15R(10 pmol/ μL)各1.5 μL、10×Buffer 5 μL、MgCl2(25 mmol/L)5 μL、Tag酶(5 U/ μL)0.3 μL、加ddH2O补足至50 μL。PCR扩增程序为:94℃预变性5 min;94℃变性30 s,50℃退火30 s,72℃延伸1.5 min,35次循环;72℃延伸10 min。PCR产物委托上海生物工程有限公司测序,所得结果在基因库GenBank(http://www.ncbi.nlm.nih.gov)中进行Blasten比对,序列同源性大于99%设为相同种。
1.5 发酵乳样品制备
将12%的脱脂复原乳95℃杀菌5 min,冷却至42℃,分成A、B、C、D 4个接种组,每组设置3个重复,LB和ST均按体积分数为1.0%接种;grx19分别按0%(A组),0.1%(B组),1%(C组)和10%(D组)接种;接种物于42℃培养9 h,在第0,3,6和9小时取样测定grx19和LB+ST活菌数以及pH值。制备好的发酵乳样品置4 ℃贮藏28 d,在第1,7,14,21 d和28 d取样测定grx19及LB+ST活菌数。
1.6 pH测定
将发酵乳样品温度调节至20℃,采用数显式pH计测量。
1.7 活菌数测定
总活菌数检测按文献[15]方法进行,将发酵乳样品采用生理盐水梯度稀释,选取3个适当的稀释度进行MRS平板涂布,37℃恒温培养48 h后进行活菌计数;鼠李糖乳杆菌grx19活菌通过菌落免疫印迹法计数,试验方法同1.3所述;LB+ST活菌数根据免疫印迹试验中的阴性菌落数计算,取3次重复试验的平均值表示活菌数(单位:mL-1)。
1.8 统计与分析
试验结果取3次试验的的平均值,组间差异采用Sigmaplot 10.0软件中的t检验模式进行统计分析,以P<0.05为有统计学意义。
2 结果与讨论
2.1 鼠李糖乳杆菌grx19 CIB检测方法建立
将菌株grx19、LB和ST的混合菌悬液,梯度稀释后涂布MRS平板,厌氧培养48 h形成的菌落通过转印和CIB处理后,grx19菌落在NC膜上形成清晰的菌落印迹,而LB和ST则不能形成印迹(如图1所示)。16S rDNA测序鉴定结果证实所有阳性菌落(图1中箭头所示)均为鼠李糖乳杆菌(序列同源性大于99%),结果表明应用鼠李糖乳杆菌菌毛抗体anti-rFimI(稀释度1∶2 000)作为检测抗体,所建立的菌落免疫印迹法能够特异性的检测MRS分离平板上的鼠李糖乳杆菌菌落。
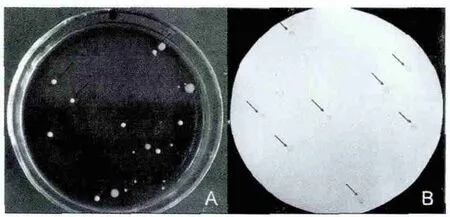
图1 鼠李糖乳杆菌grx19菌落免疫印迹检测方法的建立
2.2 混合菌悬液中鼠李糖乳杆菌grx19的CIB计数结果
以不同比例混合的grx19、LB和ST菌悬液作为模拟样品,应用MRS平板分离结合CIB对其中的grx19以及LB+ST活菌进行计数,结果如表1所示。表中数据显示grx19单菌株悬液形成的CIB菌落阳性率为100%,而LB、ST以及Amix等不含grx19的菌悬液形成的阳性菌落均为0,菌悬液Bmix、Cmix、Dmix和Emix中阳性菌落比例分别为0.5%,3.3%,35.1%和84.4%;与预设的grx19比例(0.6%,5.8%,38.1%和86.0%)基本一致(R2=0.998)。随机挑取阳性菌落进行16S rDNA测序鉴定,结果100%为鼠李糖乳杆菌。结果表明所建立的计数方法能够反应混合菌株样品中的grx19的活菌数量变化。

表1 菌落免疫印迹法对不同菌悬液中grx19活菌数的测定结果
2.3 发酵过程中活菌数变化
应用MRS平板计数结合CIB方法对接种不同浓度grx19、LB和ST发酵乳中的活菌数进行检测,结果如图2所示。发酵过程中,LB+ST总活菌数均呈现快速上升趋势,A、B、C、D四个接种组LB+ST活菌浓度分别由1.4×107mL-1上升到4.3×108~6.9×108mL-1,而grx19在B组(0.1%接种)中活菌数由0.7×106mL-1上升到3.6×106mL-1,D组(10%接种量)中的grx19活菌数由7×107mL-1上升到2.2×108mL-1,均显示了较慢的生长速度。鼠李糖乳杆菌grx19的起始接种浓度对发酵乳中LB+ST增殖具有一定影响,A组和B组在4个取样点LB+ST活菌数变化没有显著差异(P>0.05),表明低接种量grx19(B组)对LB+ST生长没有显著影响;中等接种量grx19(C组)在发酵6 h对LB+ST增殖具有一定促进作用;在高接种量grx19(D组)中,在0~3 h显示了促进效应,但在6 h后对LB+ST的增殖显示了一定的抑制效应。
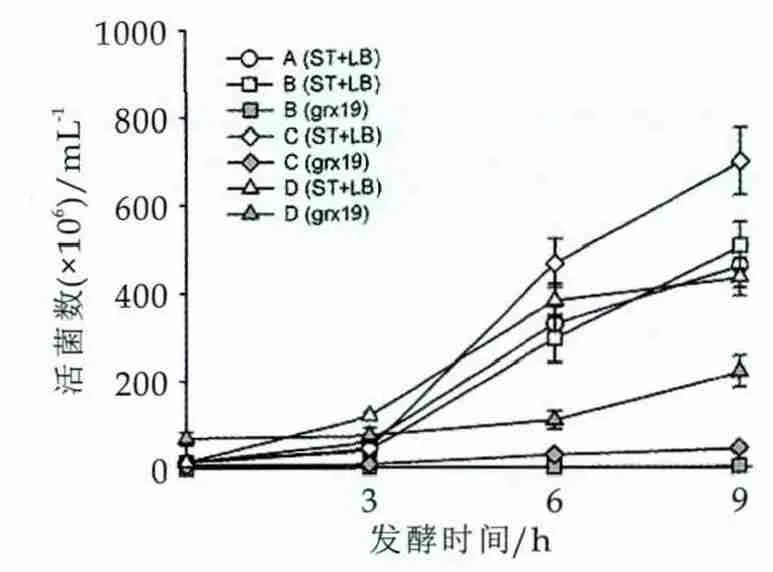
图2 发酵过程中grx19和LB+ST活菌数变化
2.4 发酵过程中pH值的变化
在发酵过程中,不同接种组的pH值变化趋势如图3所示,由图3可知发酵过程中乳的pH值呈不断下降趋势,不同接种物起始pH在6.3至6.5之间,发酵终点pH值在4.3至4.6之间,发酵3~6 h内pH值下降最为迅速,但接种组A、B、C、D之间的pH变化没有显著差异,结果表明接种grx19菌株后没有显著影响凝乳和产酸。

图3 发酵过程中pH值变化
2.5 4℃冷藏过程中活菌数变化
应用MRS平板计数结合菌落免疫印迹方法对不同发酵乳在4℃冷藏过程中的活菌数进行测定。结果如图4所示。由图4可知,在整个冷藏期内,发酵乳LB+ST活菌浓度在冷藏7 d后均呈现显著降低的趋势。A(LB+ST)、B(LB+ST+0.1%grx19)、C(LB+ST+1%grx19)、D(LB+ST+10%grx19)四个接种组的LB+ST活菌数下降值分别为4.83×108,4.62×108,6.36×108和4.47×108mL-1,第28 d存活率分别为7.8%,16.3%,8.7%和7.2%;grx19活菌数在冷藏14 d后呈现显著降低的趋势,B、C、D接种组中grx19活菌下降值分别5.05×106,3.12×107,1.69×108mL-1,第28 d存活率分别为31.6%,30.2%,32.2%,显著高于LB+ST存活率(P<0.01),表明grx19耐低温冷藏能力显著高于LB和ST。
3 结论
(1)应用鼠李糖乳杆菌菌毛蛋白亚基FimI抗体建立的菌落免疫印迹方法,具有高度选择性和特异性,方法简便快速,能够用于检测多菌株发酵乳中鼠李糖乳杆菌的活菌动态变化,可为鼠李糖乳杆菌产品质量控制和活菌计数提供新方法。
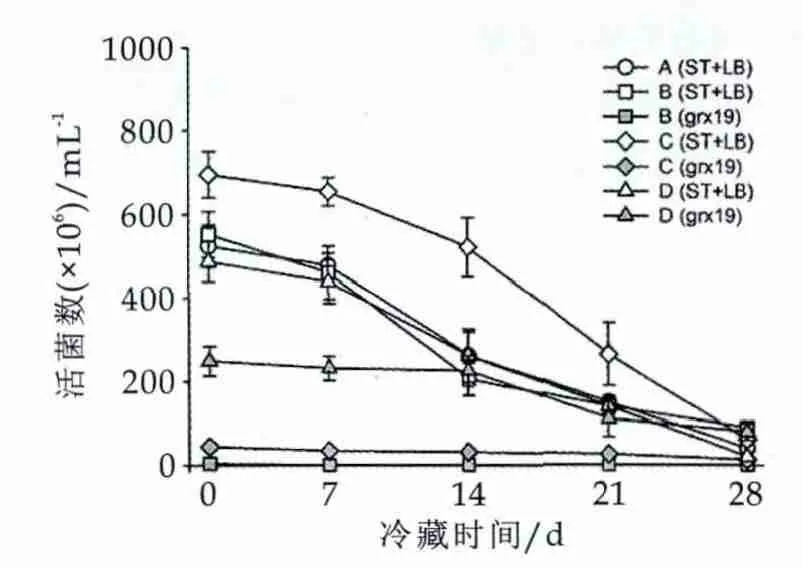
图4 4℃冷藏过程中grx19和LB+ST活菌数变化
(2)鼠李糖乳杆菌grx19(CGMCC No.5519)在发酵过程中增殖速度慢于常规发酵剂菌株,在发酵乳中添加(0.7-7)×106mL-1grx19,在发酵过程中对发酵剂菌株嗜热链球菌和保加利亚乳杆菌的生长和产酸影响不大,但高接种量的grx19(7×107mL-1)在发酵后期对发酵剂菌株生长有一定抑制效应。
(3)发酵乳中的鼠李糖乳杆菌grx19在4℃冷藏28 d后存活率保持在30%左右,耐低温冷藏能力显著高于常规发酵剂菌株LB和ST,表明该菌株可用于生产长货架期的活菌型乳酸菌饮料及发酵乳制品。
[1]LEBEER S,CLAES I,TYTGAT H L P,et al.Functional analysis of Lactobacillus rhamnosus GG pili in relation to adhesion and immunomodulatory interactions with intestinal epithelial cells[J].Appl Environ Microbiol,2012,78:185-193.
[2]TUO Y,ZHANG W,ZHANG L,et al.Study of probiotic potential of four wild Lactobacillus rhamnosus strains[J].Anaerobe,2013,21:22-27.
[3]杨红梅,林汉亮.鼠李糖乳杆菌在酸奶中的应用研究[J].新疆畜牧业,2011,10:30-32.
[4]田丰伟,丁纳,赵建新,等.鼠李糖乳杆菌YHOC137及其发酵乳的体外抗致突变作用[J].食品工业科技,2008,29(4):71-74.
[5]TRIPATHI M K,GIRI S K.Probiotic functional foods:Survival of probiotics during processing and storage[J].J.Funct Foods,2014,9:225-24.
[6]包秋华,张家超,李梅花,等.一种快速定性和定量检测发酵乳中L.rhamnosus的方法[J].乳业科学与技术,2010,5:225-227.
[7]ACHILLEOS C,BERTHIER F.Quantitative PCR for the specific quantification of Lactococcus lactis and Lactobacillus paracasei and its interest for Lactococcus lactis in cheese samples[J].Food Microbiol,2013,36:286-295.
[8]SAKAI T,OISHI K,ASAHARA T,et al.M-RTLV agar,a novel selective medium to distinguish Lactobacillus casei and Lactobacillus paracasei from Lactobacillus rhamnosus[J].Int J Food Microbiol,2010,139:154-160.
[9]LENA M D,QUERO G M,SANTOVITO E,et al.A selective medium for isolation and accurate enumeration of Lactobacillus casei-group lactobacilli in probiotic milks and dairy products[J].Int Dairy J,2015,47:27-36.
[10]DUEZ H,PELLETIER C,COOLS S,et al.A colony immunoblotting method for quantitative detection of a Bifidobacterium animalis probiotic strain in human faeces[J].J Appl Microbiol,2000,88:1019-1027.
[11]WIECKOWSKA-SZAKIEL M,BUBERT A,ROZALSKI M,et al.Colony-blot assay with anti-p60 antibodies as a method for quick identification of Listeria in food[J].Int J Food Microbiol,2002,72:63-71.
[12]REUNANEN J,VON OSSOWSKI I,HENDRIDKX A P A,et al.Characterization of the SpaCBA pilus fibers in the probiotic Lactobacillus rhamnosus GG[J].Appl Environ Microbiol,2012,78:2337-2344.
[13]顾瑞霞,陈旭娇,丁缪华,等.鼠李糖乳杆菌grx19及其应用[P].中国:ZL201110441666.7,2012-12-12.
[14]萨姆布鲁克J,拉塞尔著D W.分子克隆实验指南[M].3版.北京:科学出版社,2002:68-105.
[15]GB 4789.35—2010,食品安全国家标准:食品微生物学检验乳酸菌检验[S].北京:中国标准出版社,2010.
