重组人血管内皮抑制素单药对非小细胞肺癌肿瘤血管微环境影响的初步研究
2015-12-16沈钰新赵伟新王升平陈佳艳蒋国
沈钰新,赵伟新,王升平,陈佳艳,3,刘 笛,蒋国,樊
1. 复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海200032 ;
2. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海200032 ;
3. 南京医科大学附属南京第一医院放疗科,江苏 南京 210006
重组人血管内皮抑制素单药对非小细胞肺癌肿瘤血管微环境影响的初步研究
沈钰新1,赵伟新1,王升平2,陈佳艳1,3,刘 笛1,蒋国1,樊1
1. 复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海200032 ;
2. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海200032 ;
3. 南京医科大学附属南京第一医院放疗科,江苏 南京 210006
背景与目的:临床数据显示对于局部晚期或晚期非小细胞肺癌(non-small cell lung cancer,NSCLC),重组人血管内皮抑制素(恩度)联合放疗或化疗较传统化放疗可能更具优势,但其机制,特别是对血管微环境的影响依旧不甚明确。该研究通过CT灌注成像技术(dynamic contrast-enhanced perfusion computed tomography,CT perfusion)对NSCLC肿瘤局部血流灌注进行定量分析,评估恩度单药对NSCLC肿瘤血管微环境的影响。方法:经细胞学或组织学确认的初治ⅢB/Ⅳ期NSCLC患者可入组本研究。全部患者接受7.5 mg/m2恩度单药治疗14 d,于基线期及治疗后分别接受CT灌注成像检查,获取灌注图像并定量分析血流灌注参数:血流量(blood flow,BF)、血容量(blood volume,BV)以及血管表面通透性(permeability surface,PS)。结果:7例患者(4例为ⅢB期,3例为Ⅳ期)入组,均完成基线期及恩度单药治疗后CT灌注扫描。血流灌注参数BF、BV、PS的中位值于治疗前后分别为27.1/48.9 mL·(100 mL·min)-1、86.8/84.8 mL·100 mL-1以及45.0/54.0 mL·(100mL·min)-1。经过14 d恩度单药治疗,肿瘤BF值较治疗前显著上升(P=0.028),而BV值与PS值变化无统计学意义(BV:P=0.398;PS:P=0.237)。结论:恩度单药治疗局部晚期或晚期NSCLC后,可导致肿瘤局部灌注血流量明显上升而通透性和血容量则变化不明显。
非小细胞肺癌;内皮抑素;CT灌注成像;肿瘤微环境
2014中国肿瘤登记年报显示:在我国肺癌已成为发病率及死亡率均为第一的恶性肿瘤。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总体80%~85%,由于其起病隐匿,约80%患者初诊时已失去手术机会[1-2]。近年来,多项临床研究显示,重组人血管内皮抑制素(Endostar,恩度)联合化放疗治疗局部晚期或晚期NSCLC,相比传统化、放疗,具有提高总有效率、局控率且安全性好等优势[3-7]。然而,其作用机制尚不明确,且恩度单药作用于NSCLC肿瘤内微血管的直接效应也研究甚少。
CT灌注成像(dynamic contrast-enhanced perfusion computed tomography,CT-p)作为一种无创的、定量分析并获取肿瘤局部灌注图像的新技术,已广泛用于评估肺癌、肝癌和头颈部鳞癌等多种肿瘤的血管生成状态[8-10]。本研究采用CT灌注成像技术,通过对肿瘤局部血流灌注进行定量分析,评估恩度单药对局部晚期或晚期NSCLC肿瘤内微血管的影响,为探讨恩度联合化放疗的作用机制提供部分依据。
1 资料和方法
1.1 入组与排除标准
本研究通过复旦大学附属肿瘤医院伦理委员会审核。入组标准为:(1) 细胞学或组织学确认的NSCLC;(2) 无法根治性切除局部晚期或晚期NSCLC;(3) PS评分0~1分;(4) 预计生存期≥12周;(5) 足够的器官和骨髓功能储备;(6) 能理解本研究并已签署知情同意书。排除标准:(1) 进行过针对原发疾病的抗肿瘤治疗;(2) 伴有CT灌注成像或恩度治疗的禁忌证。
1.2 治疗与评价方案
重组人血管内皮抑制素注射液由山东先声麦得津生物制药有限公司生产(国药准字S20050088,每支15 mg/3 mL,2.4×105U/支)。全部患者接受7.5 mg/m2恩度单药治疗14 d,于基线期及治疗后分别接受CT灌注成像检查,获取灌注图像并定量分析血流灌注参数。
1.3 CT灌注扫描设备及参数
研究采用Siemens 64多层螺旋CT扫描仪(Siemens Definition;Siemens Medical Solutions,Forchheim,Germany)进行检查。首先,行常规CT平扫,确定病变部位及灌注扫描范围。确定肿块后,将包括肿块最长径层面的相邻4层选定为靶层面,行CT灌注扫描。通过高压注射器经肘正中静脉注入非离子型对比剂优维显(Ultravist,370 mg I/mL) 50 mL,流速5 mL/s。灌注扫描模式采用多层连续动态电影扫描,电压120 kV,电流50 mAs,重建层厚为4×7.2 mm,数据采集时间为50 s,延迟时间0 s (即注射对比剂与灌注扫描同时开始)。
1.4 灌注参数图像分析
将扫描所得200幅(每层50幅,4层)图像数据传送至Siemens专用图像处理工作站(CT workplace;Siemens Healthcare,Erlangen,Germany),采用预装的Syngo Body Perfusion CT(Syngo 2006G;Siemens Medical Solutions)软件处理数据。由1名资深放射科医师进行肿瘤感兴趣区(Region of interest,ROI)的勾画及测量。对于肿瘤区域ROI的选择,避开明显的坏死、钙化区域,尽最大可能覆盖病灶,但不选取肿瘤边缘。选用Lung Cancer灌注专用子软件分析并获取血流量(blood flow,BF)、血容量(blood volume,BV)以及血管表面通透性(permeability surface,PS)参数。
1.5 统计学处理
所有数据均采用SPSS 20.0进行统计处
2 结 果
2.1 一般资料
自2009年7月—2010年6月,7例初诊于复旦大学附属肿瘤医院的患者入组本研究。其中男性6例,女性1例;中位年龄51岁(46~64岁);4例为ⅢB期,3例为Ⅳ期(恶性胸腔积液2例,脑转移1例);T2a1例,T2b5例,T31例;N21例,N36例;M04例,M1a2例,M1b1例。所有患者均经细胞学或组织学病理证实为NSCLC,其中,腺癌5例,鳞癌2例。
2.2 CT灌注参数
全部患者均接受基线期及恩度单药治疗后CT灌注扫描。
7例患者基线期CT灌注参数BF、BV、PS的中位值分别为21.7 mL·(100 mL·min)-1、86.8 mL·100 mL-1以及45 mL·(100 mL·min)-1。经过14 d恩度单药治疗,BF、BV、PS参数中位值分别为48.9 mL·(100 mL·min)-1、84.8 mL·100 mL-1以及54.0 mL·(100 mL·min)-1。对治疗前后两组数据进行Wilcoxon符号秩检验,结果显示,肿瘤BF值较治疗前显著上升(P=0.028),而BV值与PS值变化无统计学意义(BV:P=0.398;PS:P=0.237)。表1所示为治疗前后灌注参数变化及相关系数。
恩度单药治疗后,患者BF值平均上升至基线期2.04倍(范围:0.87~3.20),绝对值提高了(18.8±18.5) mL·(100 mL·min)-1。而BV、PS值较基线期平均上升至1.70倍(范围:0.71~5.57)以及1.26倍(范围:0.82~1.89),绝对值较基线期分别上升了(14.1±32.0) mL·100 mL-1、(7.63±16.0) mL·(100 mL·min)-1。图1~3所示为各患者接受恩度治疗前后血流灌注参数变化。图4所示为1名58岁男性患者ROI勾画选择以及治疗前后血流灌注图像。该患者初诊为右上肺腺癌伴脑转移(Ⅳ期,T2bN3M1b),恩度治疗后,其BF值较基线期上升了70%,BV值升高30%,而PS值较治疗前下降了15%。肿瘤局部BF值或BV值越高提示局部血供越丰富,PS值越高提示血管表面通透性越强。通过CT灌注图像,我们可以直观地看出该患者接受恩度治疗后肿瘤局部血供(BF、BV值)较基线期上升,而血管表面通透性(PS值)较治疗前有所下降。
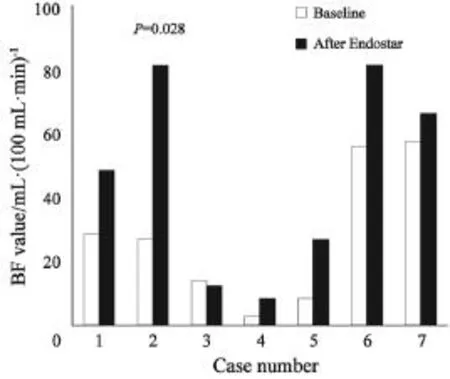
图 1 各例患者治疗前后血流量参数值Fig. 1 Blood flow (BF) changes before and after Endostar monotherapy in all 7 cases
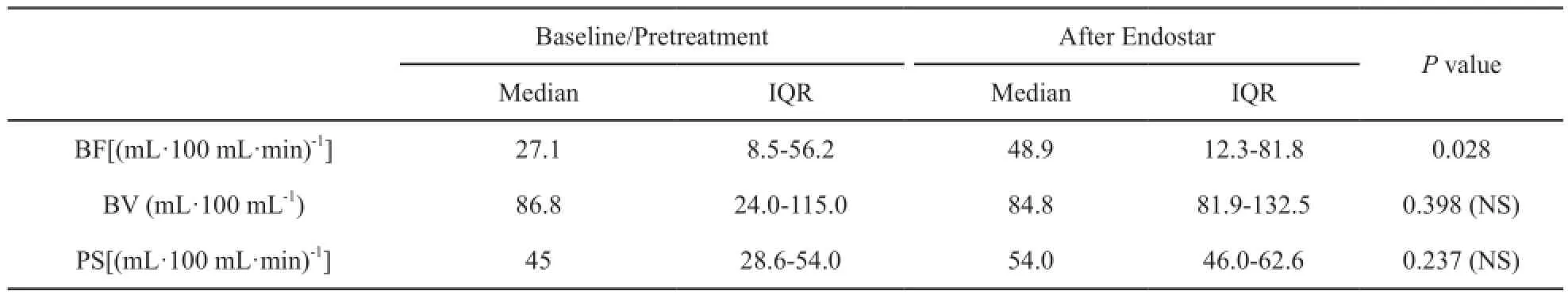
表 1 恩度治疗前后灌注参数Tab. 1 Changes in functional parameters before and after endostar monotherapy
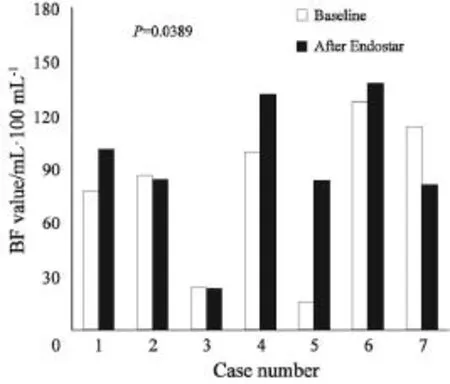
图 2 各例患者治疗前后血容量参数值Fig. 2 Blood volume (BV) changes before and after Endostar monotherapy in all 7 cases
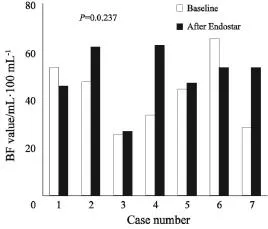
图 3 各例患者治疗前后血管表面通透性参数值Fig. 3 Permeability surface (PS) changes before and after Endostar monotherapy in all 7 cases
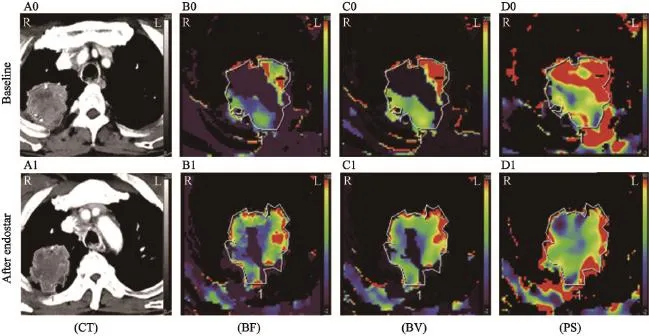
图 4 1例患者基线期及恩度治疗后CT灌注图像Fig. 4 Axial CT and CT perfusion imaging in a 58-year-old male patient with a diagnosis of stage Ⅳ adenocarcinoma of the right upper lobe at baseline and after Endostar treatment
3 讨 论
自1971年,Folkman[11]教授提出恶性肿瘤的生长与转移依赖于新生血管生成这一学说,抗血管生成治疗作为一项靶点独特、可协同治疗、不易耐药、低毒性且抗肿瘤应用广谱的治疗策略[12-13],已成为部分肿瘤一线治疗推荐方案。1997年,O’Reilly等[14]发现了一种新的内源性抗血管生成因子——内皮抑素(Endostatin),能够特异性抑制肿瘤血管内皮细胞的增殖、迁移以及生成。1999年,由我国研究人员自主研发的重组人血管内皮抑制素注射液——恩度问世,并于2005年被国家食品药品监督管理局批准联合化疗应用于复发和转移的NSCLC的治疗[15]。
已有多项临床研究显示,对于晚期
NSCLC,恩度联合化疗较单纯化疗更有优势。2005年的一项多中心Ⅲ期临床试验提示,晚期NSCLC中恩度联合长春瑞滨+顺铂(NP)方案较单纯NP化疗组,总有效率分别为35.4%、19.5%(P=0.0003),中位肿瘤进展时间分别为6.3及3.6个月(P=0.0000)[7]。2011年,一项随机Ⅱ期临床研究[6]显示,恩度联合紫杉醇+卡铂(TP)方案治疗晚期NSCLC,其疾病控制率较单纯化疗组显著提高(P= 0.004)。同年12月,Ge等[5]通过对15个临床试验1 335例患者进行荟萃分析,再次证明恩度联合铂类药物为基础的化疗方案能够提高晚期NSCLC治疗的总有效率,且有较好的安全性。
不仅用于协同化疗,恩度联合放疗的优势在近几年的研究中也逐渐被认可。2011年,Jiang等[3]通过对比恩度联合放疗以及单纯放疗的各25例Ⅰ~Ⅲ期NSCLC患者,发现恩度组较单纯放疗组具有更高的总有效率以及更优的1年、2年局控率。2014年,Bao等[4]报道的一项Ⅱ期临床试验显示,与既往研究相比,恩度联合化、放综合治疗对于提高Ⅲ期NSCLC患者的生存期及局控率具有潜在优势。
尽管临床数据显示恩度能够提高化放疗敏感性,但其作用机制尚不明确。主流观点认为,内皮抑素通过干扰血管内皮细胞生长因子、成纤维细胞生长因子信号转导通路,诱导内皮细胞停滞在G1期,诱导内皮细胞凋亡,阻止内皮细胞黏附移行,从而特异性抑制肿瘤血管内皮细胞的增殖、迁移以及生成[16-20]。2014年,Deng等[21]通过对接受单纯化疗与恩度联合化疗的晚期食管癌患者进行对比,发现接受2个周期(42 d)治疗后,联合治疗组肿瘤血流灌注参数BF、BV、PS以及肿瘤VEGF 表达较单纯化疗组均明显下降(P<0.05),且VEGF表达与BF、BV值呈正相关。郑心婷等[22]将24例晚期NSCLC分为恩度联合化疗组以及单纯化疗组,同样发现联合治疗组接受治疗(≥42 d)后BF值较治疗前明显下降,且下降幅度高于单纯化疗组。
多数研究探讨的是恩度联合抗肿瘤治疗后肿瘤的血流动力学改变,为了进一步了解恩度单药对NSCLC肿瘤微血管的直接影响,本研究通过运用CT灌注扫描,对接受14 d恩度单药治疗的局部晚期或晚期NSCLC患者进行监测。结果显示,接受恩度治疗后,患者肿瘤局部灌注BF值较治疗前显著上升。这一结果与2012年Jiang等[23]报道相一致。该研究显示,恩度治疗5 d后,10例Ⅱ/Ⅲ期NSCLC患者的BF值较基线期出现明显上升。
以上数据显示,恩度联合化疗综合治疗后肿瘤BF值会下降,而单药治疗后却呈上升趋势。究其原因,结合既往研究,我们认为可能与接受抗血管治疗后早期肿瘤血管正常化现象相关。2005年,Jain[24]首次提出抗血管生成治疗初期可能导致肿瘤血管出现短期“正常化”现象。2013年,Meng等[25]通过测定恩度治疗后路易斯肺癌(Lewis lung carcinoma,LLC)小鼠模型肿瘤的细胞凋亡、微血管密度、壁细胞血管的形态以及肿瘤缺氧的情况,提出恩度可能通过减少微血管密度,同时增加血管内皮的周细胞覆盖对肿瘤血管进行重塑,继而出现血管正常化现象。本研究中,患者接受恩度治疗后,肿瘤CT灌注BF值较治疗前明显上升。相对于正常血管,肿瘤新生血管由于发育不成熟,其血流灌注量较低。同时,肿瘤血流量升高,可能进一步提高对药物以及氧的运输能力,从而提高化疗以及放疗的治疗效力。
综上所述,恩度单药治疗局部晚期或晚期NSCLC,可导致患者肿瘤局部灌注BF上升,这可能与恩度提高化放疗敏感性相关。然而,由于患者数量有限且检测方法单一,我们后续将扩大样本量,同时联合MR弥散加权成像[26]、正电子发射计算机断层显像(PET/CT)等技术,进一步阐述恩度单药及联合化疗对NSCLC肿瘤血管及微环境的影响。
[1] SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9-29.
[2] CARNIO S, NOVELLO S, MELE T, et al. Extending survival of stage Ⅳ non-small cell lung cancer[J]. Semin Oncol,
2014, 41(1): 69-92.
[3] JIANG X D, DAI P, WU J, et al. Effect of recombinant human endostatin on radiosensitivity in patients with non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 83(4):1272-1277.
[4] BAO Y, PENG F, ZHOU Q C, et al. Phase Ⅱ trial of recombinant human endostatin in combination with concurrent chemoradiotherapy in patients with stage Ⅲ non-small-cell lung cancer[J]. Radiother Oncol, 2015, 114(2): 161-166.
[5] GE W, CAO D D, WANG H M, et al. Endostar combined with chemotherapy versus chemotherapy alone for advanced NSCLCs: a meta-analysis[J]. Asian Pac J Cancer Prev, 2011, 12(10): 2705-2711.
[6] HAN B, XIU Q, WANG H, et al. A multicenter, randomized, double-blind, placebo-controlled study to evaluate the efficacy of paclitaxel-carboplatin alone or with endostar for advanced non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6(6): 1104-1109.
[7] 王金万, 孙 燕, 刘永煜, 等. 重组人血管内皮抑素联合NP方案治疗晚期NSCLC随机、双盲、对照、多中心Ⅲ期临床研究[J]. 中国肺癌杂志, 2005, 8(04): 283-290.
[8] MILES K A, LEE T Y, GOH V, et al. Current status and guidelines for the assessment of tumour vascular support with dynamic contrast-enhanced computed tomography[J]. Eur Radiol, 2012, 22(7): 1430-1441.
[9] FRAIOLI F, VETERE S, ANILE M, et al. Computed tomography perfusion: a new method to evaluate response to therapy in lung cancer[J]. J Thorac Oncol, 2011, 6(9):1599-1600.
[10] GARCIA-FIGUEIRAS R, GOH V J, PADHANI A R, et al. CT perfusion in oncologic imaging: a useful tool?[J]. AJR Am J Roentgenol, 2013, 200(1): 8-19.
[11] FOLKMAN J. Tumor angiogenesis: therapeutic implications[J]. N Engl J Med, 1971, 285(21): 1182-1186.
[12] WU J M, STATON C A. Anti-angiogenic drug discovery:lessons from the past and thoughts for the future[J]. Expert Opin Drug Discov, 2012, 7(8): 723-743.
[13] 黄 诚, 张 晶, 柯明耀, 等. 贝伐单抗联合化疗治疗晚期多程治疗失败后的非小细胞肺癌临床观察[J]. 中国癌症杂志, 2012, 22(1): 47-51.
[14] O’REILLY M S, BOEHM T, SHING Y, et al. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth[J]. Cell, 1997, 88(2): 277-285.
[15] 常国栋, 李壮林, 秦加阳, 等. 重组人血管内皮抑制素(rh-Endostatin)大肠杆菌表达体系发酵条件的优化[J]. 生物工程学报, 2005, 21(04): 662-666.
[16] ABDOLLAHI A, HAHNFELDT P, MAERCKER C, et al. Endostatin’s antiangiogenic signaling network[J]. Mol Cell, 2004, 13(5): 649-663.
[17] HANAI J, DHANABAL M, KARUMANCHI S A, et al. Endostatin causes G1 arrest of endothelial cells through inhibition of cyclin D1[J]. J Biol Chem, 2002, 277(19):16464-16469.
[18] LING Y, YANG Y, LU N, et al. Endostar, a novel recombinant human endostatin, exerts antiangiogenic effect via blocking VEGF-induced tyrosine phosphorylation of KDR/Flk-1 of endothelial cells[J]. Biochem Biophys Res Commun, 2007, 361(1): 79-84.
[19] LU N, LING Y, GAO Y, et al. Endostar suppresses invasion through downregulating the expression of matrix metalloproteinase-2/9 in MDA-MB-435 human breast cancer cells[J]. Exp Biol Med (Maywood), 2008, 233(8): 1013-1020.
[20] LING Y, LU N, GAO Y, et al. Endostar induces apoptotic effects in HUVECs through activation of caspase-3 and decrease of Bcl-2[J]. Anticancer Res, 2009, 29(1): 411-417.
[21] DENG W Y, SONG T, LI N, et al. Clinical observation and therapeutic evaluation of Rh-endostatin combined with DP regimen in treating patients with advanced esophageal cancer[J]. Asian Pac J Cancer Prev, 2014, 15(16): 6565-6570.
[22] 郑心婷, 林丽珠, 杨贤卫. CT灌注成像对非小细胞肺癌化疗及血管靶向治疗疗效的评价[J]. 中国肿瘤临床与康复, 2012, 19(03): 254-257.
[23] JIANG X D, DAI P, QIAO Y, et al. Clinical study on the recombinant human endostatin regarding improving the blood perfusion and hypoxia of non-small-cell lung cancer[J]. Clin Transl Oncol, 2012, 14(6): 437-443.
[24] JAIN R K. Normalization of tumor vasculature: an emerging concept in antiangiogenic therapy[J]. Science, 2005, 307(5706): 58-62.
[25] MENG M B, JIANG X D, DENG L, et al. Enhanced radioresponse with a novel recombinant human endostatin protein via tumor vasculature remodeling: experimental and clinical evidence[J]. Radiother Oncol, 2013, 106(1): 130-137.
[26] 沈丽娟, 周良平. 磁共振弥散加权成像技术在肾脏肿瘤诊断中的研究和进展[J]. 中国癌症杂志, 2014, 24(5): 387-391.
Microenvironment changes induced by Endostar monotherapy in patients with non-small cell lung
cancer: a pilot study
SHEN Yuxin1, ZHAO Weixin1, WANG Shengping2, CHEN Jiayan1,3, LIU Di1,
JIANG Guoliang1, FAN Min1(1.Department of Radiation Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2.Department of Radiology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 3.Department of Radiation Oncology, Nanjing First Hospital Affiliated to Nanjing Medical University, Nanjing 210006, Jiangsu, China)
FAN Min E-mail: fanming@fudan.edu.cn
Background and purpose: Clinical data show that Endostar, a recombinant human endostatin, has the therapeutic benefit for patients with non-small cell lung cancer (NSCLC) while combined with chemotherapy or radiotherapy. However, the microenvironment changes induced by Endostar monotherapy in NSCLC is not yet clear. The purpose of this study was to prospectively study tumor vascular effects of Endostar monotherapy in patients with locally advanced or advanced NSCLC by dynamic contrast-enhanced perfusion computed tomography (CT perfusion, CT-p). Methods: Previously untreated patients with histologically or cytologically confirmed locally advanced or advanced NSCLC were eligible. All patients received daily Endostar (7.5 mg/m2) for 14 days. CT-p scans were acquired at the baseline and post-treatment. CT-p parameters, such as blood flow (BF), blood volume (BV) and permeability surface PS (area product), were measured in all patients. Results: Of all 7 patients enrolled, four were staged as ⅢB and three as stage Ⅳ (2 with malignant pleural effusion, 1 with brain metastasis). The median BF, BV and PS values of baseline
Non-small cell lung cancer; Endostatin; CT perfusion; Microenvironment
10.3969/j.issn.1007-3969.2015.10.011
R734.2;R73-37
A
1007-3639(2015)10-0817-06
2015-03-26
2015-05-28)
樊旼 E-mail:fanming@fudan.edu.cn
and post-treatment were 27.1/48.9 mL/100 mL/min, 86.8/84.8 mL/100 mL and 45.0/54.0 mL/100 mL/min, respectively. After administration of Endostar for 14 days , BF showed a significant increase compared with that at baseline (P=0.028), whereas no significant changes were found in BV (P=0.398) and PS (P=0.237) values. Conclusion: Our results suggest that Endostar monotherapy induces a significant increase in BF whereas no significant difference in BV and PS.
