共刺激分子B7-H3在骨肉瘤组织中的表达及临床意义
2015-12-16张英泽
王 玲,刘 磊,陈 伟,张英泽
1.河北医科大学第三医院骨科研究所,河北 石家庄 050011;
2.河北医科大学第四医院肿瘤研究所,河北 石家庄 050011
共刺激分子B7-H3在骨肉瘤组织中的表达及临床意义
王 玲1,2,刘 磊1,陈 伟1,张英泽1
1.河北医科大学第三医院骨科研究所,河北 石家庄 050011;
2.河北医科大学第四医院肿瘤研究所,河北 石家庄 050011
背景与目的:B7-H3是近年来新发现的协同刺激分子B7家族成员,但目前其在骨肿瘤中的表达及作用机制尚不明确。该研究旨在通过检测人骨肉瘤中B7-H3分子的表达,分析其与患者临床病理因素以及术后生存时间之间的关系。方法:采用免疫组织化学法检测61例人骨肉瘤组织、对应癌旁组织及良性骨肿瘤组织中B7-H3分子的表达以及肿瘤浸润T淋巴细胞的浸润程度。结果:骨肉瘤组织中B7-H3分子表达的阳性率为91.8(56/61),而B7-H3在癌旁及骨纤维结构发育不良组织中几乎不表达。B7-H3分子在骨软骨瘤中表达率为56.8%,但染色强度明显弱于骨肉瘤组织。B7-H3的表达与患者的Ennecking分期、是否发生肺转移之间的差异有统计学意义(P<0.05),与肿瘤组织中CD8+T淋巴细胞浸润程度呈负相关(P<0.05),与患者预后呈负相关(P<0.05)。结论:B7-H3在人骨肉瘤中组织异常高表达,并与肿瘤的进展、患者的预后密切相关;B7-H3可能参与了骨肉瘤微环境中的CD8+T细胞功能的调节,促使肿瘤细胞逃避免疫监视。
B7-H3;骨肉瘤;免疫组织化学
骨肉瘤是由间胚叶细胞发展而来的一种恶性程度极高的、严重威胁人类健康和生命的原发性骨肿瘤[1-2]。该肿瘤的发病率占原发性恶性骨肿瘤的20%~40%,发生率约为3/100万。骨肉瘤可发生于任何年龄,尤其好发于10~30岁的青少年[3-4]。骨肉瘤起病隐匿、恶性度高、病情进展快,很多患者在确诊时往往已经发生了肺部的微小转移。因此,骨肉瘤患者总体的治疗效果仍不尽人意,诊治形势十分严峻。因此,探索更为有效的治疗方法是一个亟待解决的难题。
随着医学技术的飞速发展,肿瘤的免疫治疗逐渐成为继手术、放化疗之外的有效治疗模式[5-6]。但是,目前骨肉瘤的抗肿瘤免疫机制尚未完全明确,探讨更为有效的免疫治疗策略有赖于对机体抗肿瘤免疫反应的进一步认识。通常认为,T细胞介导的免疫反应在抗肿瘤免疫中发挥了关键作用。众所周知,T细胞的活化有赖于双重信号,不仅需要抗原肽-MHC分子复合物与TCR的相互作用,还需要抗原递呈细胞与T细胞表面的共刺激分子来提供第二刺激信号[7]。B7家族分子及其配体多是重要的共刺激分子,在介导T细胞免疫反应中发挥关键作用,成为抗肿瘤免疫策略最有希望的治疗靶点[8]。因此,探讨B7家族分子在骨肉瘤中的表达及作用,将有助于寻找潜在的治疗靶点,提供新的骨肉瘤的免疫治疗策略。
1 资料和方法
1.1 研究对象
收集2004年1月—2009年12月河北医科大学第三医院手术切除的骨肿瘤标本118例,所有标本均有详细临床资料,组织标本均经过HE染色、读片,病理证实其中骨肉瘤61例,骨软骨瘤37例,骨纤维结构发育不良20例。术前患者均未接受放化疗治疗。所有标本的收集均经过河北医科大学第三医院的许可及患者的知情同意。在骨肉瘤患者中,年龄小于等于20岁的34例,大于20岁的27例。本研究所有组织标本均经病理学诊断确诊,常规石蜡包埋,制成厚4 μm的组织切片用于免疫组织化学检测。同时取癌旁组织行免疫组织化学检测作为对照。
1.2 试剂
羊抗人B7-H3多克隆抗体购自美国R&D公司,兔抗人CD4+、CD8+免疫组化单克隆抗体购自福州迈新生物技术开发有限公司,山羊超敏二步法免疫组织化学试剂盒购自北京中衫金桥生物技术有限公司,UltraSensitiveTMS-P超敏试剂盒购自福州迈新生物技术开发有限公司。
1.3 免疫组织化学法
标本经4%甲醛溶液浸泡固定,常规脱水,透明,石蜡包埋,切片。二甲苯脱蜡,在梯度乙醇内水化。抗原修复后,于0.3%的H2O2中浸泡20 min阻断内源性抗原。用PBS洗3次,用10%的正常血清温育以阻断背景非特异性的染色。羊抗人B7-H3多克隆抗体 (1∶100) 湿盒内温育过夜。经PBS洗后加生物素标记二抗(北京中杉金桥生物技术有限公司),37 ℃作用30 min;加辣根酶标记的链霉卵白素工作液,37 ℃作用30 min,DAB显色。苏木精复染,脱水,透明,封片。CD4+、CD8+免疫组织化学染色方法同上。
1.4 结果判定
免疫组织化学结果由2位病理科主任医师进行独立阅片。B7-H3染色结果评估:光镜下每张切片中选肿瘤细胞较多的5个高倍视野,每个视野计数100个细胞。以细胞质或细胞核含棕黄色颗粒判断为阳性细胞,并进行阳性细胞染色强度评分:无染色(与背景颜色相似)为0分、轻度染色(淡黄色)为1分、中度染色(棕黄色)为2分、重度染色(棕褐色)为3分。染色阳性细胞率小于33%肿瘤细胞着色为1分,33%~66%肿瘤细胞着色为2分,大于66%肿瘤细胞着色为3分。将2项评分之积作为该患者的总评分,总评分小于等于3分定义为低表达,大于3分定义为高表达。
CD4+、CD8+T淋巴细胞浸润程度根据T淋巴细胞在肿瘤中的分布情况,可划分为4个等级:0为无浸润,1为局部少量浸润,2为适度浸润,3为大量浸润。其中0和1归为低度浸润组,2和3归为高度浸润组。
1.5 统计学处理
采用SPSS 17.0软件对数据进行统计分析。B7-H3的表达与临床病理变量之间的关系采用χ2检验及Fisher精确检验分析,B7-H3与肿瘤浸润T淋巴细胞之间的相关性用Spearman相关性分析。采用Kaplan-Meier法进行生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 B7-H3在骨肉瘤组织中的表达
免疫组织化学结果显示,B7-H3分子主要定位于骨肉瘤细胞的细胞质和细胞膜(图1)。在61例骨肉瘤患者中,B7-H3阳性表达56例,阳性率为91.8%。按照B7-H3染色强度划分,9例(16.1%)为弱阳性表达,29例(51.8%)为中等强度阳性表达,18例(16.1%)为强阳性表达。而与这些骨肉瘤组织相对应的癌旁正常组织标本中B7-H3分子表达强度均较弱或不表达。在收集的骨软骨瘤及骨纤维结构发育不良的标本中,B7-H3分子的表达率仅分别为56.8%和85.0%。其中:在骨软骨瘤标本中,B7-H3中等强度阳性表达率为33.3%,弱阳性表达率为66.7%;在骨纤维结构发育不良的标本中,B7-H3分子几乎均呈弱阴性表达状态。
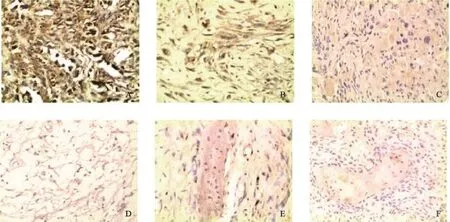
(SP, ×200)图 1 B7-H3分子在骨肉瘤、骨软骨瘤及骨纤维结构发育不良组织中的表达Fig. 1 B7-H3 expressions in osteosarcoma, osteochondroma and bone fibrous dysplasia tissues
2.2 骨肉瘤组织中B7-H3的表达水平与患者临床病理参数的相关性
在骨肉瘤组织中B7-H3阳性表达率与患者年龄、性别、肿瘤发生部位、病理分型等差异均无统计学意义(P>0.05),与患者的Ennecking分期、是否发生肺转移之间的差异有统计学意义(P<0.05)。随着患者肿瘤Ennecking分期的增加,B7-H3的表达水平增强;有肺转移的患者B7-H3的表达水平增强(表1)。
2.3 骨肉瘤组织中B7-H3的表达水平与T淋巴细胞浸润程度的相关性
为了进一步检测骨肉瘤组织中B7-H3的表达水平与T淋巴细胞浸润程度,分别进行了CD4+、CD8+的免疫组织化学染色。结果发现,CD4+T淋巴细胞浸润程度在B7-H3高表达组和B7-H3低表达组之间差异无统计学意义(P=0.299)。但Spearman相关分析检验发现,骨肉瘤组织中B7-H3的表达水平和CD8+T淋巴细胞
浸润程度呈负相关(P=0.004,表2)。
2.4 B7-H3在骨肉瘤中的表达和患者预后的关系
Kaplan-Meier生存分析结果显示,B7-H3阳性表达的患者,其预后与B7-H3阴性表达的患者差异有统计学意义。B7-H3高表达者总体生存率明显低于低表达者(P= 0.011,图2)。其中,B7-H3高表达组平均复发时间为25.7个月,明显短于B7-H3低表达组38.8个月(F=1.344,t=2.601,df=35,P=0.014)。在33例发生肺转移的患者中,75.8%的患者B7-H3表达阳性。
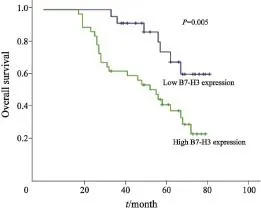
图 2 骨肉瘤组织中B7-H3的表达水平和患者预后的关系Fig. 2 The relationship between prognosis of osteosarcoma patients anel B7-H3 protein expression in osteosarcoma
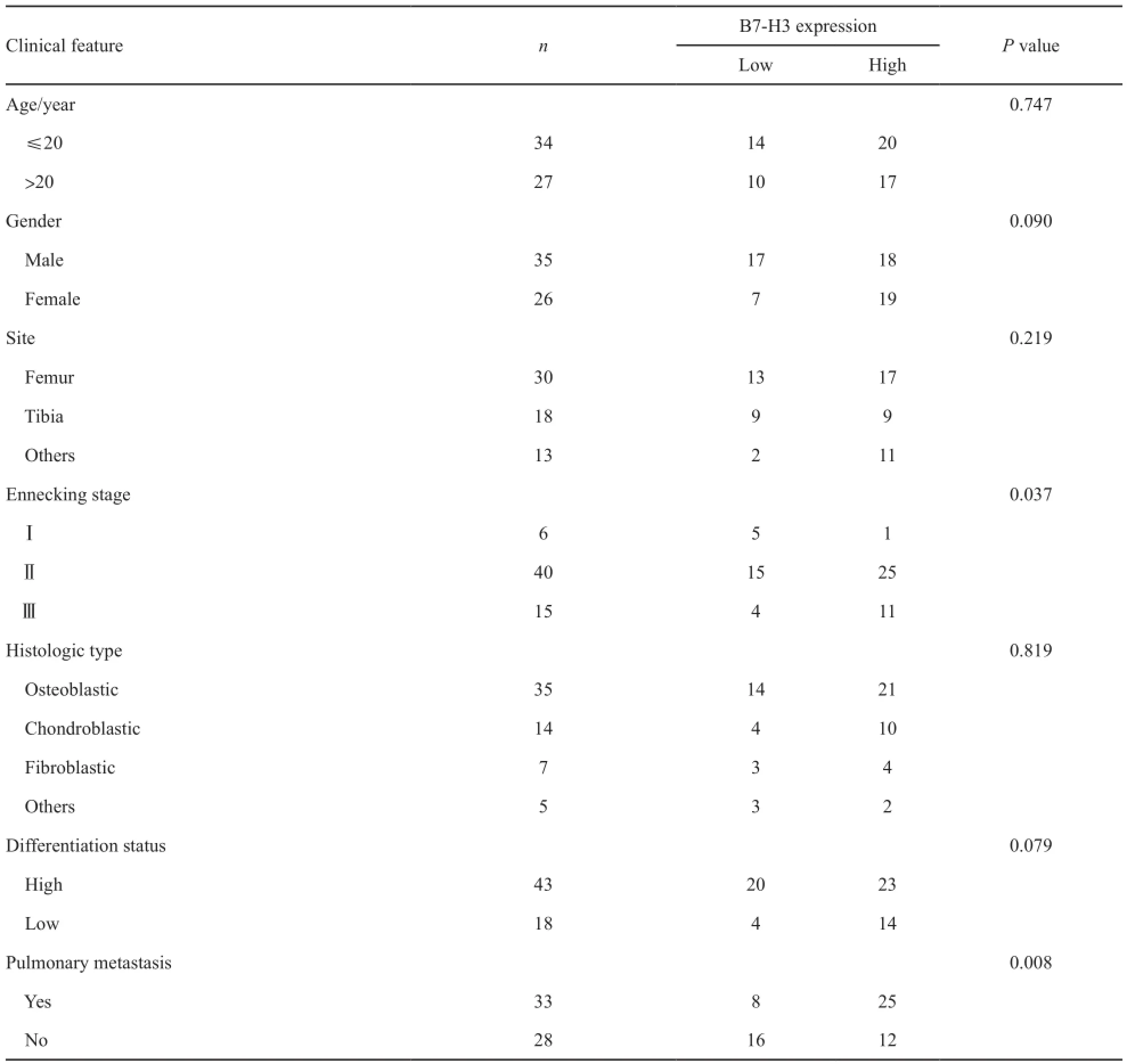
表 1 骨肉瘤患者B7-H3表达水平与临床病理因素之间的关系Tab. 1 The relationship between B7-H3 expression and clinicopathological features in osteasarcoma patients
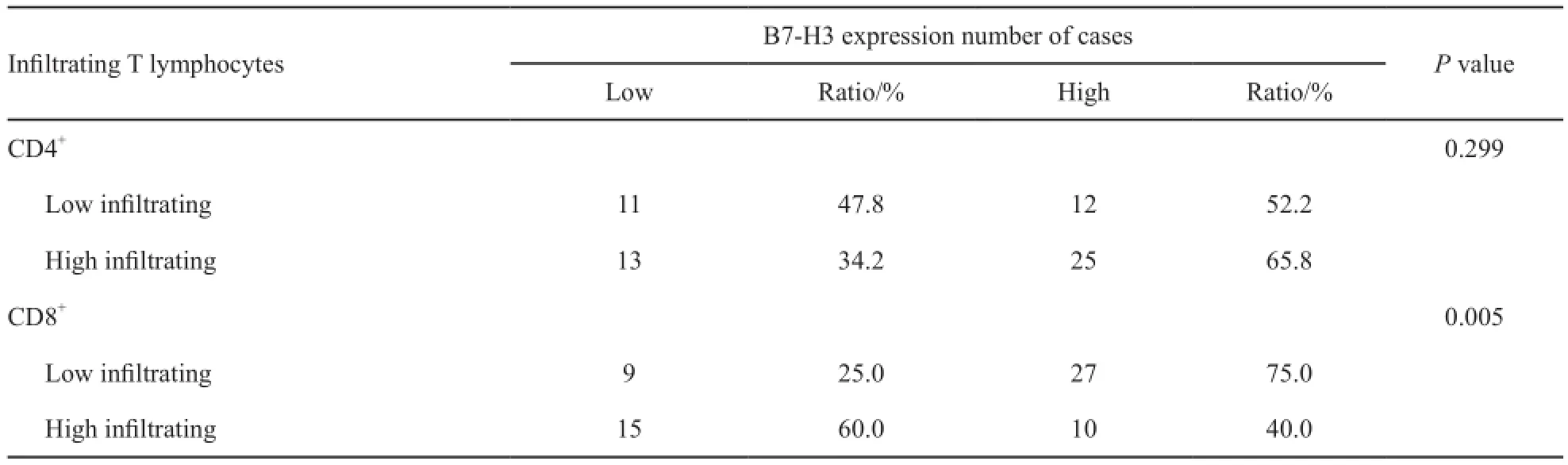
表 2 骨肉瘤组织中B7-H3表达与T细胞浸润程度的相关性Tab. 2 Correlation between infiltrating T lymphocytes and B7-H3 expression in osteosarcoma tissues
3 讨 论
骨肉瘤来源于骨及软组织中能够产生骨质和类骨质的间质细胞,其病理特征是有肉瘤组织的特征和肿瘤性成骨现象。目前,通过术前辅助化疗可以消除肿瘤周围水肿,使肿瘤周围的界限趋于清楚为术中成功彻底剥除瘤灶提供机会。但骨肉瘤具有很高的全身转移的倾向,约20%的患者在初次诊断的时候已经发生肺转移,另外还有40%的患者晚期发生远处器官的转移。转移过程中的癌症细胞得以存活的另一个重要的前提条件是在整个转移过程中肿瘤细胞能够逃逸宿主对其的免疫监视作用。肿瘤细胞可通过下调其细胞表面的MHCⅠ类分子或是共刺激分子,使宿主细胞毒性T淋巴细胞不能够正确识别肿瘤细胞,从而也就不能对肿瘤细胞起到正常的监视作用。
B7-H3作为共刺激分子B7家族新成员,是由Chapoval等[9]于2001年在cDNA文库中首先发现的。B7-H3是一种Ⅰ型跨膜蛋白,主要存在2种剪接体,鼠B7-H3细胞外段由IgV-IgC 2个免疫球蛋白结构域组成,而人B7-H3细胞外段包含2个衔接的IgV-IgC-IgV-IgC结构域[10]。B7-H3 mRNA在人体组织中广泛表达[11],而其蛋白表达谱却十分局限。资料显示,B7-H3蛋白高表达于许多肿瘤组织,包括胃癌、肺癌、前列腺癌、肾癌、成神经细胞瘤等,并与肿瘤生物学特性、患者的预后转归有很大关系[12]。研究发现,B7-H3对T细胞有共刺激作用[10],在抗CD3+抗体存在情况下,B7-H3能够促进CD4+、CD8+T细胞增殖,并能选择刺激IFN-γ的分泌。然而,目前仍有部分学者认为,B7-H3在某些肿瘤中发挥着共抑制作用。Suh等[13]和Prasad等[14]发现鼠和人类B7-H3均能够抑制CD4+T细胞的活化和细胞因子如IFN-γ、IL-4的生成。
在本研究中,人骨肉瘤组织标本中B7-H3分子在肿瘤细胞上呈现异常高表达,阳性率高达91.8%,并且B7-H3分子在骨肉瘤标本癌旁组织几乎不表达。此外,对于良性骨软骨瘤和骨纤维结构发育不良患者标本,B7-H3分子阳性率及染色强度均显著下调,提示B7-H3分子的表达可能较特异地在恶性骨肿瘤中表达。通过结合患者临床病理资料分析,发现骨肉瘤组织中B7-H3分子的表达水平与患者Ennecking分期及是否发生肺转移密切相关。患者Ennecking分期越高,B7-H3表达越强,发生肺转移的患者B7-H3的表达水平显著增高。这些结果提示,B7-H3参与了骨肉瘤的发生、发展,并可能促进肿瘤的转移。
肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)是肿瘤微环境中发挥免疫监视和杀伤的主要细胞。一般来说,肿瘤浸润淋巴细胞中绝大多数细胞为T淋巴细胞。不同肿瘤来源的TIL细胞中,CD4+、CD8+T细胞的比例有差异,大多数情况下以CD8+T细胞为主[15-16]。本研究通过免疫组织化学的方法对骨肉瘤组织中浸润的T淋巴细胞进行了染色,并结
合B7-H3分子的表达水平分析,结果发现B7-H3在骨肉瘤中的表达水平与CD8+T细胞的浸润呈负相关,与CD4+T细胞的浸润无相关性。CD8+T淋巴细胞在肿瘤微环境中发挥重要作用,其数量和功能的改变能有效评价机体抗肿瘤反应水平和患者预后情况[17]。本研究结果提示,B7-H3分子可能发挥免疫共抑制的作用,直接或间接抑制了CD8+T淋巴细胞,促进肿瘤逃避免疫监视。此外,结合患者生存资料,本研究发现B7-H3在骨肉瘤中的表达水平和患者预后呈负相关。这与B7-H3在胃癌[18]、非小细胞肺癌[19]、乳腺癌[20]、前列腺癌[21]中的研究结果相似,提示B7-H3在肿瘤细胞中的异常表达与肿瘤进展密切相关。
综上所述,本研究系统检测了B7-H3在骨肉瘤组织中的表达情况,并对其与各临床病理要素之间的相关性进行了初步分析,表明B7-H3与骨肉瘤的发生、发展密切相关。这提示B7-H3分子有可能成为判断骨肉瘤疾病进展及预后的一个新指标,但是B7-H3在骨肉瘤中的免疫调控中的作用及机制有待于进一步明确。
[1] ANNINGA J K, GELDERBLOM H, FIOCCO M, et al. Chemotherapeutic adjuvant treatment for osteosarcoma: where do we stand? [J]. Eur J Cancer, 2011, 47(16): 2431-2445.
[2] RITTER J, BIELACK S S. Osteosarcoma [J]. Ann Oncol, 2010, Suppl 7: vii 320-325.
[3] JEON D G, SONG W S. How can survival be improved in localized osteosarcoma? [J]. Expert Rev Anticancer Ther, 2010, 10(8): 1313-1325.
[4] DAI X, MA W, HE X, et al. Review of therapeutic strategies for osteosarcoma, chondrosarcoma, and Ewing's sarcoma[J]. Med Sci Monit, 2011, 17(8): 177-190.
[5] HONG C W, ZENG Q. Awaiting a new era of cancer immunotherapy [J]. Cancer Res, 2012, 72(15): 3715-3719.
[6] GHAFOURI-FARD S. siRNA and cancer immunotherapy[J]. Immunotherapy, 2012, 4(9): 907-917.
[7] PODOJIL J R, MILLER S D. Molecular mechanisms of T-cell receptor and costimulatory molecule ligation/blockade in autoimmune disease therapy [J]. Immunol Rev, 2009, 229(1): 337-355.
[8] GREAVES P, GRIBBEN J G. The role of B7 family molecules in hematologic malignancy [J]. Blood, 2013, 121(5): 734-744.
[9] CHAPOVAL A I, NI J, LAU J S, et al. B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production[J]. Nat Immunol, 2001, 2(3): 269-274.
[10] LING V, WU P W, SPAULDING V, et al. Duplication of primate and rodent B7-H3 immunoglobulin V- and C-like domains: divergent history of functional redundancy and exon loss [J]. Genomics, 2003, 82(3): 365–377.
[11]SUN M, RICHARDS S, PRASAD D V, et al. Characterization of mouse and human B7-H3 genes [J]. J Immunol, 2002, 168(12): 6294-6297.
[12] TRAN C N, THACKER S G, LOUIE D M, et al. Interactions of T cells with fibroblast-like synoviocytes: role of the B7 family costimulatory ligand B7-H3 [J]. J Immunol, 2008, 180(5):2989-2998.
[13] SUH W K, GAJEWSKA B U, OKADA H, et al. The B7 family member B7-H3 preferentially down-regulates T helper type1-mediated immune responses [J]. Nat Immunol, 2003, 4(9):899-906.
[14] PRASAD D V, NGUYEN T, LI Z, et al. Murine B7-H3 is a negative regulator of T cells [J]. J Immunol, 2004, 173(4):2500-2506.
[15] SCHATTON T, SCOLYER R A, THOMPSON J F, et al. Tumor-infiltrating lymphocytes and their significance in melanoma prognosis [J]. Methods Mol Biol, 2014, 1102:287-324.
[16] LEE S, MARGOLIN K. Tumor-infiltrating lymphocytes in melanoma [J]. Curr Oncol Rep, 2012, 14(5): 468-474.
[17] MAHMOUD S M, PAISH E C, POWE D G, et al. Tumor infiltrating CD8+lymphocytes predict clinical outcome in breast cancer [J]. J Clin Oncol, 2011, 29(15): 1949-1955.
[18] WU C P, JIANG J T, TAN M, et al. Relationship between costimulatory molecule B7-H3 expression and gastric carcinoma histology and prognosis [J]. World J Gastroenterol, 2006, 12(3): 457-459.
[19] SUN Y, WANG Y, ZHAO J, et al. B7-H3 and B7-H4 expression in non-small-cell lung cancer [J]. Lung Cancer, 2006, 53(2): 143-151.
[20] ARIGAMI T, NARITA N, MIZUNO R, et al. B7-H3 ligand expression by primary breast cancer and associated with regional nodal metastasis [J]. Ann Surg, 2010, 252(6):1044-1051.
[21] ROTH T J, SHEININ Y, LOHSE C M, et al. B7-H3 ligand expression by prostate cancer: a novel marker of prognosis and potential target for therapy [J]. Cancer Res, 2007, 67(16):7893-7900.
Expression of costimulatory molecule B7-H3 in human osteosarcoma and its clinical significance
WANG Ling1,2, LIU Lei1, CHEN Wei1, ZHANG Yingze1(1. Hebei Orthopaedic Research Institute, Third Hospital of Hebei Medical University, Shijiazhuang 050011, Hebei, China; 2. Hebei Cancer Research Institute, Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, Hebei, China)
ZHANG Yingze E-mail: dryzzhang@126.com
Background and purpose: B7-H3 is a newly identified member of the B7-family of co-stimulatory molecule, and however, its exact role in human osteosarcoma is still unclear. The purpose of this study was to examine the expression of B7-H3 in osteosarcoma tissues and to investigate its correlations with clinicopathological factors and overall survival in patients with osteosarcoma. Methods: The expression of B7-H3 and the intensity of tumorinfiltrating T lymphocytes (TILs) in pathologic specimens of osteosarcoma, osteochondroma and bone fibrous dysplasia tissues were evaluated by immunohistochemical assay. Results: The expression rate of B7-H3 was 91.8% (56/61) in osteosarcoma lesions, while B7-H3 was barely expressed in adjacent normal tissues and bone fibrous dysplasia tissues. The intensity of B7-H3 expression in osteochondroma was 56.8%, which was significantly decreased compared with osteosarcoma tissues. Tumor B7-H3 expression was associated with Ennecking stage and pulmonary metastasis, while inversely correlated with the number of tumor-infiltrating CD8+ T cells (P<0.05). Moreover, patients with high tumor B7-H3 levels had a significantly shorter survival time and recurrence time than patients with low tumor B7-H3 levels (P<0.05). Conclusion: B7-H3 is overexpressed in human osteosarcoma tissues, and B7-H3 expression is highly correlated with tumor development and overall patients’ prognosis. Moreover, overexpression of B7-H3 in tissues can reflect CD8+T cell infiltration and may help tumor cells avoid immune surveillance.
B7-H3; Osteosarcoma; Immunohistochemistry
10.3969/j.issn.1007-3969.2015.10.002
R738.6
A
1007-3639(2015)10-0768-06
2014-09-28
2015-06-20)
国家自然科学基金青年基金项目(81402228);河北省自然基金青年项目(H2015206216);河北省高等人才帮扶计划;河北省博士后重点资助项目(B2013005004)。
张英泽 E-mail:dryzzhang@126.com
